颅咽管瘤患者术后代谢变化及其相关因素分析
2022-01-05郑坤杰杨国庆母义明
郑坤杰 杨国庆 母义明
颅咽管瘤(CP)是起源于垂体胚胎发育过程中颅颊囊残存的鳞状上皮细胞的良性肿瘤,通常生长于鞍区,与下丘脑、垂体柄、垂体有密切的毗邻关系。CP可发生在任何年龄,有两个明显的分布高峰,分别为5~14岁及65~74岁,且与性别和种族无关[1]。肿瘤压迫和治疗肿瘤的手段(如肿瘤切除手术、放疗等)均可能损伤下丘脑-垂体功能,导致内分泌功能及机体能量代谢紊乱。目前针对CP患者内分泌功能紊乱的研究较多,但对于能量代谢紊乱的研究甚少。本文通过回顾分析CP患者术前和术后垂体功能及代谢的变化,探讨CP术后引起的下丘脑性肥胖及伴发的糖脂、血尿酸代谢紊乱及其影响因素,为CP术后科学的随访和管理提供依据。
对象与方法
1.对象:2011年1月~2019年12月于解放军总医院第一医学中心治疗及随访的CP患者52例。纳入标准:(1)首次接受手术治疗,术前临床资料完整;(2)术后病理确诊为CP;(3)术后随访2个月及以上,并有术后身高、体重、血糖、血脂、血尿酸及垂体功能记录;(4)活动不受限;(5)术后肾上腺皮质功能减退者接受激素替代治疗,术后2个月调整至合适的替代剂量,无糖皮质激素替代过量的表现。排除标准:(1)病理报告不明确或未取得病理报告;(2)病例资料不完整;(3)肾功能异常(内生肌酐清除率不在正常参考值范围内)、肝功能异常(转氨酶高于正常范围上限值2倍以上)及心功能不全。
2方法
(1)临床资料收集:通过电子病历、医学影像信息系统搜集CP患者的治疗方案、手术分型、术前及术后下丘脑-垂体功能、身高、体重、BMI、空腹血糖(FPG)、血脂[甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)]、血尿酸(SUA)的资料,分析计算手术前后超重及肥胖的比例,并进行体重改变百分比的相关因素分析。
(2)相关诊断标准:①超重/肥胖:成人超重及肥胖诊断参照2003年中国成人超重和肥胖症预防与控制指南:BMI 18.5~23.9 kg/m2为正常,24.0~27.9 kg/m2为超重,≥28.0 kg/m2为肥胖;儿童超重及肥胖的标准参照2009年首都儿科研究所生长发育研究室制定的中国0~18岁儿童BMI关于超重及肥胖的诊断标准[2]。②中枢性尿崩症:成人尿量连续2 h>250 ml/h或尿量>5 000 ml/24 h,尿比重<1.005;儿童尿量>6 ml·kg-1·h-1,尿比重<1.005。③生长激素缺乏:低血糖兴奋试验时生长激素峰值<5 ng/ml或胰岛素样生长因子-1<同年龄段正常参考值下限。④性腺功能减退:成年女性月经周期紊乱或闭经而黄体生成素(LH)或卵泡刺激素(FSH)水平未升髙;成年男性出现性功能不全、睾酮降低和(或)LH及FSH水平降低,或无论男女存在LH及FSH水平异常低下均被认定为继发性性腺功能减退。⑤甲状腺功能减退:游离甲状腺素(FT4)水平下降伴促甲状腺激素(TSH)正常或下降。⑥肾上腺皮质功能减退:低血糖兴奋试验时血皮质醇峰值<496.8 nmol/L或早晨8时血浆皮质醇<138 nmol/L,伴促肾上腺皮质激素正常或下降。⑦高泌乳素血症:血泌乳素高于正常参考值上限(男性>17.7 μg/L,女性>29.2 μg/L)。⑧全垂体功能减退:中枢性尿崩症、生长激素缺乏、性腺功能减退、甲状腺功能减退及肾上腺皮质功能减退均存在。
结 果
1.CP患者术前一般情况:纳入分析的52例CP患者中,男35例,平均年龄(30.89±15.60)岁,其中<18岁者5例;女17例,平均年龄(35.53±18.19)岁,其中<18岁者3例。术后随访时间为2个月~6年。所有病例术前均行头颅磁共振或CT检查,其中囊性肿瘤18例,实性肿瘤6例,囊实性肿瘤28例。共采用4种手术入路,包括经翼点入路、经鼻蝶入路、经额底纵裂入路、经纵裂-胼胝体-穹窿入路。根据CP的QST外科分型标准[3],52例CP患者中鞍膈下起源CP(Q型)19例,鞍上脑室外蛛网膜袖套起源肿瘤(S型)11例,鞍上三脑室底内型CP(T型)22例。
2.CP患者手术前后下丘脑-垂体功能比较:52例CP患者中,3例术后垂体功能评估资料不完全,其余49例患者均完成手术前后全垂体功能评估,结果显示,与术前比较,术后发生全垂体功能减退、生长激素缺乏、性腺功能减退、甲状腺功能减退、肾上腺皮质功能减退及中枢性尿崩症患者比例均明显升高(P<0.05)。手术前后高泌乳素血症患者比例比较差异无统计学意义(P>0.05)。见表1。
3.CP患者手术前后代谢指标的变化:44例成人CP患者中,34例术后体重增加,4例术后体重无明显改变,6例术后体重轻度下降,术后体重改变百分比为8.96%(-5.06%,47.14%)。8例<18岁CP患者中,4例术前体重正常,术后1例体重正常,其余3例术后超重或肥胖;4例术前体重超重,术后1例体重降至正常,1例仍超重,2例肥胖。综合分析成人及<18岁CP患者结果显示,术前超重、肥胖比例为40.38%(21/52)、9.62%(5/52),术后为42.31%(22/52)、28.85%(15/52),较术前明显增加(P<0.05);术后BMI较术前也明显升高(P<0.05)。术前有糖尿病患者1例,术后新发4例,共有糖尿病患者5例。与术前比较,术后血LDL-C、TG和SUA水平均明显升高,HDL-C明显降低(P<0.05);而手术前后FPG和TC水平比较差异无统计学意义(P>0.05)。见表2。
4.成人CP患者术后体重增加百分比的影响因素分析:根据术后体重增加百分比将44例成人CP患者分为体重增加≥10%组(16例)和体重增加<10%组(因有3例术后垂体功能评估资料不完全,故纳入单因素和多因素分析共25例)进行比较结果显示,体重增加≥10%组患者年龄及术后高泌乳素血症患者比例明显低于体重增加<10%组(P<0.05),见表3。将两组比较P<0.1的指标纳入logistic回归模型结果显示,年龄(β=-0.083,OR=0.920,95%CI0.859~0.985,P=0.017)和术后高泌乳素血症(β=-1.691,OR=0.184,95%CI0.039~0.869,P=0.033)是成人CP患者术后体重增加的保护因素。
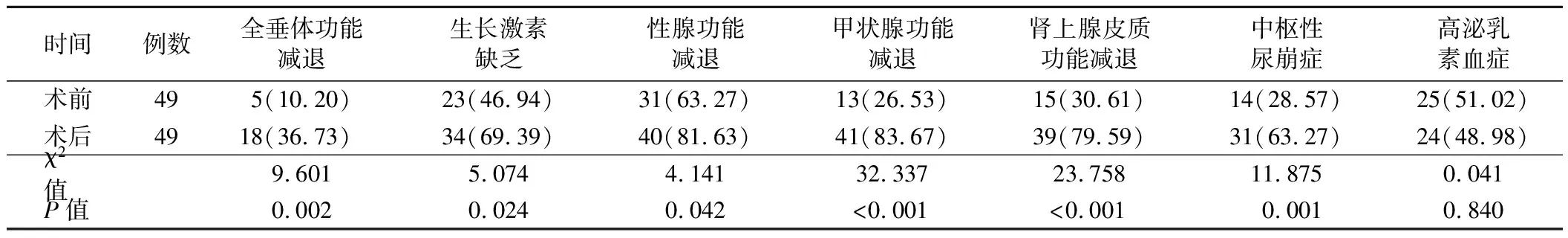
表1 CP患者手术前后下丘脑-垂体功能比较[例,(%)]
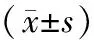
表2 CP患者手术前后代谢指标的变化

表3 体重增加≥10%组和体重增加<10%组临床资料比较[例,(%)]
讨 论
尽管CP为良性肿瘤,生存率高,但由于其毗邻下丘脑、视交叉、垂体柄等重要结构,无论选择何种治疗方式,都无法避免因肿瘤本身或治疗如手术、放射治疗等引起的下丘脑结构损伤,进而引起腺垂体功能减退、尿崩症及下丘脑性肥胖等并发症,严重影响患者的生活质量[4-5]。下丘脑性肥胖是指下丘脑能量稳态调节系统结构或功能损伤引起的食欲亢进和短期内体重显著增加综合征。研究发现,儿童CP患者术后前6个月BMI快速增加,随后进入体重稳定阶段,成人CP患者严重肥胖常发生于术后1年内,常伴血糖、血脂及血压等多种代谢改变[6]。
CP患者的肿瘤占位效应如损伤下丘脑负责控制饥饿和饱腹感的中枢,会影响能量平衡的调节,引发肥胖。生理情况下,下丘脑弓状核是能量平衡的关键调节中枢,瘦素、脂肪组织相关细胞因子及胰岛素信号经两组神经元传导作用于此。下丘脑损伤所导致的瘦素和胰岛素信号通路破坏,可致下丘脑性肥胖的发生[7-8]。影像学研究发现,肥胖的严重程度与下丘脑受损程度呈正相关[9]。
本研究发现,CP患者术后BMI、超重及肥胖比例较术前明显增高,血LDL-C及TG水平均明显升高,HDL-C明显降低。正如Wijnen等[10]的研究表明,与普通人群比较,CP患者术后高血压、肥胖、低HDL-C血症、高TG血症的发病率更高,更易患代谢综合征。多项研究显示,CP患者术前肥胖比例为11.4%~21%,术后肥胖比例可增至48.7%~84%,较术前明显增高[11-14]。
Wijnen等[15]研究发现,与普通人群比较,CP患者术后患2型糖尿病、脑梗死的发病风险明显增加,且呼吸循环疾病的死亡率亦明显增加,女性、儿童起病CP、脑积水、肿瘤复发可视为CP患者患2型糖尿病、脑梗死及死亡率增加的危险因素。本研究结果显示,CP患者术后FPG较术前轻度增加,但差异无统计学意义,可能与随访时间短、病例数量偏少有关,且随访病例缺乏餐后血糖及胰岛功能结果,无法统计餐后血糖及胰岛功能变化情况。
研究表明,超重或肥胖与高尿酸血症(HUA)关系密切,相互作用,互为因果[16。梅彩霞等[17]研究结果显示,HUA的患病率和血尿酸水平均随着BMI增加而升高。王静等[18]发现TG为HUA发生的独立危险因素,其中TG每升高1 mmol/L,男性发生HUA的风险升高25.7%,女性发生HUA的风险升高37.0%。本研究结果显示,CP患者术后SUA水平较术前明显增高,可能与术后BMI明显增高及血脂紊乱直接相关。
垂体功能减退在CP患者中最为常见,可以发生在术前、术中和(或)术后,对患者的长期预后和生活质量影响较大[5]。本研究中,与术前比较,CP患者术后生长激素缺乏、性腺功能减退、甲状腺功能减退、肾上腺皮质功能减退、中枢性尿崩症患者比例均明显增高。术后全垂体功能减退发生率为36.73%,亦明显高于术前。表明CP患者术后垂体功能进一步恶化,需重新评估下丘脑-垂体功能,及时行激素替代治疗。
Andereggen等[19]对32例CP患者进行长达10年的随访发现,术后尿崩症可作为下丘脑性肥胖长期发展的独立危险因素。Wijnen等[10]研究结果显示,术后视觉损伤是发生代谢综合征及其组分的独立危险因素。本研究结果显示,年龄和术后高泌乳素血症是成人CP患者术后体重增加的保护因素,提示年龄较小及术后无泌乳素升高的成人CP患者术后体重增加的风险较高。与本研究结果相反,有研究显示,63%的泌乳素瘤患者有体重增加,泌乳素可通过调控与糖脂代谢相关的关键酶和转运蛋白,来影响整体代谢,从而增加体重[20]。这可能是由于本研究为单中心的回顾性研究,在病例的选择上可能存在偏倚;其次,本研究纳入的样本量较小且随访时间较短,行体重增加百分比的logistic回归分析时可能影响分析结果。
目前CP治疗主要包括饮食和生活方式干预、药物治疗及减重手术,药物治疗包括拟交感活性药物(如右旋安非他明)、降糖药物(如二甲双胍、吡格列酮及胰高血糖素样肽-1受体激动剂)、下丘脑-垂体激素替代疗法(如生长激素替代)、生长抑素类似物(如奥曲肽)等[21]。由于下丘脑在机体能量稳态调节中的作用复杂,下丘脑性肥胖目前仍是临床治疗的难点,病例报道有效的药物及减重手术的实际疗效有待进一步验证。
综上,CP患者术后下丘脑受损易引起下丘脑性肥胖及伴发糖脂和SUA代谢紊乱,且年龄较小及术后无泌乳素升高的成人CP患者术后体重增加的风险较高,需引起重视,术后需长期门诊随访。
