红光熊蜂线粒体CoI基因的克隆与特性分析
2022-01-05王丹丹卢建璋
王丹丹,卢建璋,王 星
(1.辽东学院农学院,辽宁 丹东 118003;2.浙江大学爱丁堡大学联合学院,浙江 海宁 314499)
红光熊蜂(BombusignitesSmith)是一类重要的传粉昆虫,具嚼吸式口器,吻喙长,接触植物柱头频率高;除大颚可用作咀嚼或塑蜡外,中舌、小颚外叶和下唇须合并构成复杂的食物管,借以吸食花蜜.与蜜蜂相比,熊蜂没有敏锐的信息交流系统,有利于植物的授粉[1];此外,熊蜂访花时间较长,抵御低温、弱光、高湿等恶劣生态环境的能力较突出[2-4].熊蜂主要分布在我国辽宁、黑龙江、河北和云南等地,在设施农业生产中的应用面积有逐年上升趋势.目前,各国已逐渐采用熊蜂授粉取代传统的震动授粉和激素点花授粉,成为世界公认的绿色食品安全生产中的重要一环[5-6].
线粒体DNA(mtDNA)是独立于动物细胞核外唯一拥有自身一套遗传密码子和蛋白质翻译系统(线粒体蛋白质的合成也在细胞质中进行)的遗传物质[7].其中,由线粒体参与编码的细胞色素C氧化酶(cytochrome C oxidase,Co),是一种存在于细菌或线粒体上的大型跨膜蛋白复合物,为真核生物线粒体内膜电子传递链上的终端酶,可以同时将4个细胞色素C的电子传递到一个氧分子上,还原为水,并合成ATP.真核细胞的细胞色素C氧化酶由13个亚基组成,其中CoI,CoII和CoIII基因为级联反应核心最大的3个亚基,分别由mtDNA编码,其余10个亚基均由细胞核DNA编码[8].CoI基因具有更大的系统发生信号范畴,其通用引物可覆盖大多数动物类群的5′端.因此,与核基因相比,CoI基因是药物作用偏好的靶基因.[9]磷化氢是粮食储备常用的高效熏蒸杀虫剂,是牛心细胞色素C氧化酶的非竞争性抑制剂,由于磷化氢对细胞色素C氧化酶具有特殊的翻译后修饰功能,阻断其接受电子将氧分子还原为水,可能是导致熊蜂等授粉昆虫致死的主要原因[10-13].本实验采用RT-PCR和RACE技术对红光熊蜂CoI基因进行了克隆、测序;采用DNAMAN,DNAstar和MEGA7.0等生物信息学软件预测了红光熊蜂CoI基因编码的蛋白质结构、功能和基本理化特性等,并基于氨基酸序列构建了红光熊蜂系统进化树,以为进一步研究红光熊蜂等授粉昆虫CoI基因的功能、明确分解周期较长的高毒性化学农药在熊蜂线粒体中的作用靶位点提供依据,为设计新型环保、无公害的杀虫剂奠定基础.
1 材料与方法
1.1 实验材料
选取繁育旺盛、健康无病的20日龄红光熊蜂工蜂.红光熊蜂工蜂由辽东学院农学院蜜蜂研究所人工室内饲养,饲养条件为无光照、相对湿度50%±5%、温度(28±0.5)℃.实验于2018年7月至2019年10月于辽东学院农学院基因工程实验室完成.
1.2 总RNA的提取
将工蜂于液氮下研磨至粉末状,4℃条件下迅速转入无菌的eppendorf管中,加入1.5 mL Trizol液体,按照Takara公司总RNA微量提取试剂盒(Takara insect total RNA isolation kit)操作步骤提取总RNA.采用1%琼脂糖凝胶电泳检测RNA的完整性,-80℃保存,以备后续试验.
1.3 红光熊蜂CoI基因全长cDNA基因的获得
1.3.1 红光熊蜂CoI基因cDNA片段的合成
按照Primer-Script RT reagent Kit(Takaka,www.takara-bio.com)反转录试剂盒操作说明,以红光熊蜂总RNA为模板,采用RT-PCR技术反转录生成cDNA第一链;下载NCBI数据库中已登记的熊蜂CoI基因cDNA的部分已知序列,采用Primer Premier 5.0软件设计RT-PCR特异性引物(即CoI1)(见表1),以已合成的cDNA第一链为模板进行PCR扩增.RT-PCR反应体系20 μL.cDNA 1 μL,上下游引物各1 μL,Taq 高分子混合物(Taq Master Mix)(2×) 13 μL,加灭菌ddH2O至20 μL.RT-PCR反应程序:94℃预变性4 min;94℃变性40 s,58℃退火50 s,72℃延伸3 min,35个循环;72℃延伸8 min.RT-PCR扩增产物利用1%琼脂糖凝胶电泳检测目的片段,回收后将片段与克隆载体pMD-19T连接,连接体系20 μL:1 μL T4连接酶、1 μL pMD-19T克隆载体,胶回收产物16 μL、T4连接酶Buffer 2 μL,16℃过夜连接;连接产物转化于大肠杆菌感受态细胞DH5α中,37℃孵育1 h,采用蓝白筛选法筛选出均匀白斑菌落,以M13a为引物(见表1)进行菌落PCR,鉴定后挑取阳性菌落置于5 mL含氨苄西林的LB中37℃,200 r/min培养12 h后提取质粒,限制性内切酶PstⅠ和BamHⅠ双酶切鉴定,阳性克隆质粒送交上海生工生物工程股份有限公司测序后进行Blast序列比对[14-16].

表1 引物信息
1.3.2CoI基因cDNA 3′-RACE PCR
按照3′-RACE 试剂盒(SMARTer TM RACE cDNA Amplification Kit)的操作说明书先后进行两轮巢式PCR.取3.75 μL总RNA为模板,1 μL 反转录接头引物3′CDS primer A,72℃孵育4 min、42℃孵育2 min后离心,合成3′-RACE第一链[17].首轮PCR扩增产物稀释100倍后取3 μL作为第二轮的模板.反应体系50 μL:3 μL 3′-RACE cDNA,1 μL上游引物CoI1F,4.5 μL下游引物UPM,1 μL dNTP Mix,1 μL Advantage 2 PCR Buffer (10×),1 μL Advantage 2 Polymerase Mix (50×),加灭菌ddH2O至50 μL.PCR反应程序:94℃预变性5 min;94℃变性50 s,58℃退火50 s,72℃延伸2 min,35个循环;72℃延伸8 min.其他操作步骤同1.3.1.
1.3.3CoI基因cDNA 5′-RACE PCR
按照5′-RACE 试剂盒(SMARTer TM RACE cDNA Amplification Kit)的操作说明书先后进行两轮巢式PCR,取3.75 μL总RNA为模板,1 μL接头反转录引物5′CDS primer A,72℃孵育4 min、42℃孵育2 min后离心收集产物,取1 μL SMARTerⅡ Aoligo加入试管中,合成5′-RACE第一链.首轮PCR扩增产物稀释100倍后取3 μL作为第二轮的模板.反应体系50 μL:3 μL 3′-RACE cDNA,5 μL上游引物UPM,1 μL下游引物CoI1R,1 μL dNTP Mix,1 μL Advantage 2 PCR Buffer (10×),1 μL Advantage 2 Polymerase Mix (50×),加灭菌ddH2O 至50 μL.PCR反应程序:94℃预变性5 min;94℃变性50 s,58℃退火50 s,72℃延伸2 min,35个循环;72℃延伸8 min.其他操作步骤同1.3.1.
1.3.4CoI基因生物信息学分析
将克隆得到的红光熊蜂CoI基因序列在NCBI数据库中进行Blast序列比对验证,采用DNAStar软件中的SepMan对红光熊蜂CoI全长cDNA序列进行拼接;采用在线软件ORF Finder 查找红光熊蜂CoI全长cDNA序列开放阅读框(ORF),利用DNAMAN软件对红光熊蜂CoI编码蛋白进行生物信息学分析,并在NCBI中采用BlastP程序将其与11种昆虫的CoI基因编码的氨基酸序列进行多重比对分析;采用MEGA 7.0软件邻接法(neighbor-joining)基于氨基酸序列构建系统发育树.采用在线软件ExPASy-ProtParam tool(http:∥www.expasy.org/tools/protparam.html)预测红光熊蜂CoI基因编码蛋白质的基本理化性质;利用在线工具TMHMM Server v.1.0(http:∥www.cbs.dtu.dk/services/TMHMM/)预测红光熊蜂CoI基因编码蛋白跨膜区域.
2 结果与分析
2.1 红光熊蜂CoI基因cDNA克隆与表达分析
通过RT-PCR技术克隆、拼接得到红光熊蜂工蜂CoI基因全长cDNA序列,通过ORF Finder在线分析发现,CoI基因含有一个1 050 bp的开放阅读框,起始密码子为ATG,终止密码子为TAA,编码349个氨基酸(见图1).在NCBI数据库进行的BlastP序列分析可见,CoI基因编码氨基酸序列与熊蜂CoI基因序列的一致性最高可达98%,与其他昆虫的同源一致性均在75%以上.

图1 红光熊蜂CoI基因ORF及其编码氨基酸序列
2.2 红光熊蜂CoI基因编码蛋白的基本理化性质预测
采用ExPASy-ProtParam tool(http:∥www.expasy.org/tools/protparam.html)软件在线分析红光熊蜂工蜂CoI基因编码蛋白质的基本理化性质可知,CoI含1 050 bp,编码349个氨基酸,预测蛋白质分子式C1789H2724N422O463S25,相对分子质量为38 350,理论等电点(pI)为5.79,偏酸性,半衰期为30 h;在CoI蛋白质的氨基酸组成中亮氨酸(Leu)所占比例最高为12.9%,缬氨酸(Trp)比例最低为0.9%;氨基酸残基带正电荷的(Arg + Lys)为8个,带负电荷的(Asp + Glu)为15个;CoI蛋白质的平均亲水系数为0.706,不稳定性指数为39.98(一般不稳定系数小于40的蛋白质视为稳定蛋白),脂溶性指数110.92.上述结果表明CoI编码的蛋白质为带负电的疏水性蛋白;采用在线软件SignalIP(http:∥www.cbs.dtu.dk/services/SignalIP/)预测红光熊蜂CoI基因编码蛋白N端信号锚定序列,结果显示,CoI蛋白具有信号肽,且信号肽的剪切位点位于第24和25号氨基酸之间(见图2),说明红光熊蜂CoI蛋白可能为具信号肽的分泌蛋白.采用在线工具TMHMM Server v.1.0(http:∥www.cbs.dtu.dk/services/TMHMM/)预测红光熊蜂CoI基因编码蛋白具8个跨膜区域,蛋白质的氨基端在膜外、羧基端在膜内(见图3);采用3-D在线模型构建软件Automatic Modeling Mode (http:∥swiss model.Eapasy.org/)构建三级结构,结果显示,红光熊蜂CoI蛋白质具8个α-螺旋,与图3中8个跨膜结构域相一致(见图4).

C-score:剪切位点值;S-score:S值的变化趋势;Y-score:S值和C值的综合参数,每一个氨基酸分别对应一个S值和一个C值,当S值和C值均较高时即为信号肽的位置.

图3 红光熊蜂CoI基因预测的蛋白跨膜结构域
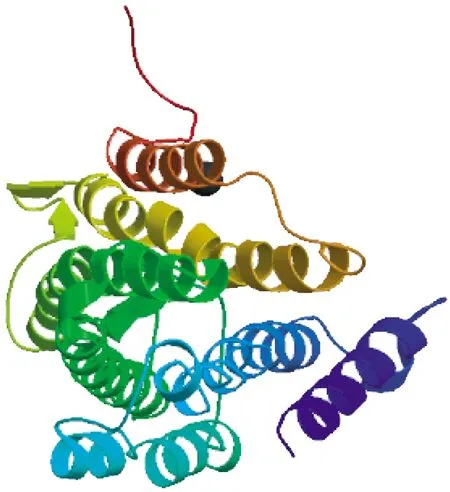
图4 红光熊蜂CoI蛋白的3-D结构预测模型
2.3 红光熊蜂CoI编码氨基酸聚类分析
在NCBI数据库中将红光熊蜂CoI编码的氨基酸序列进行BlastP比对分析,采用软件MEGA7.0的邻接法对与红光熊蜂CoI编码的氨基酸同源性较高的昆虫构建系统发育树(见图5).系统发育树显示,中华蜜蜂(Apiscerana)、意大利蜜蜂(Apismellifera)和黑盾胡蜂(Vespabicolor)聚为一支;红光熊蜂与地熊蜂(Bombusterrestris)聚为一支;紫棕象甲(Rhynchophorusphoenicis)、红棕象甲(Rhynchophorusferrugineus)和棕榈象甲(Rhynchophoruspalmarum)聚为一支;黄粉寄蝇(Tachinaflavosquama)、家蝇(Muscadomestica)、黑腹果蝇(Drosophilamelanogaster)聚为一支.由此可见,昆虫的CoI编码的氨基酸以目为单位各聚为支,膜翅目与鞘翅目进化关系较近,红光熊蜂的CoI氨基酸序列与地熊蜂进化关系较近,相似性达95%,其中膜翅目中华蜜蜂与意大利蜜蜂进化关系较近(93%),但双翅目黄粉寄蝇与膜翅目红光熊蜂的CoI氨基酸同源性不大,氨基酸序列同源性在35%~95%之间,这与昆虫的进化关系一致.

注:意大利蜜蜂Apis mellifera,中华蜜蜂Apis cerana ,黑盾胡蜂Vespa bicolor,红光熊蜂Bombus ignites,地熊蜂Bombus terrestri,紫棕象甲Rhynchophorus phoenicis,红棕象甲Rhynchophorus ferrugineus,棕榈象甲Rhynchophorus palmarum,黄粉寄蝇Tachina flavosquama,家蝇Musca domestica,黑腹果蝇Drosophila melanogaster.
3 讨论
授粉是农作物生产的重要环节,而品质和安全性已成为设施农产品追求的目标,所以越来越多的人采用熊蜂授粉取代人工激素对温室大棚果蔬进行授粉.但温室果蔬为防治病虫害而大量使用化学农药,严重影响熊蜂的健康与授粉,由NY/T2882.4—2016《农药登记环境风险评估指南第四部分:蜜蜂》的评估可见,大部分农药对熊蜂具经口性毒性.
线粒体具双层膜,电子传递链位于内膜,细胞色素C氧化酶是内膜的标志酶,而线粒体细胞色素C氧化酶被认为是化学农药主要作用的靶标,细胞色素C氧化酶是需氧菌和线粒体细胞内膜电子传递链的终端氧化酶,也是各种农药的作用靶标[18].真核细胞细胞色素C氧化酶包含13个亚基,其中CoI,CoII和CoIII是3个最大的核心亚基,均由mtDNA编码,且存在于绝大多数含血红素/铜(heme/copper)的终端酶中,是分子生物学领域中研究物种遗传多样性、进化史、分类鉴定等方面应用较多的基因.目前对其他物种细胞色素C氧化酶的研究较为深入,而对红光熊蜂细胞色素C氧化酶的研究尚未见报道.CoI基因是昆虫分类特征的重要基因,稳定且应用较广,为分析红光熊蜂CoI基因编码的氨基酸特征和蛋白质理化性质,以及红光熊蜂的系统发育亲缘关系提供了分子依据和基础性资料[19-20].本实验克隆了红光熊蜂CoI基因,测序、预测了氨基酸序列及其蛋白质理化性质;采用RT-PCR和RACE技术得到细胞色素C氧化酶的开放阅读框为1 050 bp,编码349个氨基酸;利用Swiss Model在线分析软件预测其含有8个跨膜结构,与其具有8个α-螺旋相一致,并且在第24和25号氨基酸之间存在信号肽的剪切位点,说明CoI有可能是分泌蛋白,且其5′端具有一段疏水性肽片段,其功能在于引导成熟的分泌蛋白跨膜进入目标位点.
线粒体mtDNA具有高拷贝数、母系遗传且亲缘进化率较恒定的特征,平均每百万年提高约2%,使之成为流行的遗传标记,评估分析系统发生率及进化关系[21].通过本实验的系统进化树分析可见,该序列与其他昆虫CoI氨基酸具有较高的同源一致性,说明在长期的生物进化工程中,CoI亚基具有较高的保守性,可能与CoI是线粒体细胞色素C氧化酶的核心亚基有关;此外,昆虫CoI编码的氨基酸以目为单位各聚为支,膜翅目与鞘翅目进化关系较近,与双翅目昆虫相对较远,这也符合昆虫的进化关系.由此说明,虽然CoI亚基保守性较高,但在不同物种间仍具有一定程度的核苷酸差异性,进而可以解释CoI亚基能在不同物种中行使其独特的生物学功能,这为进一步明确CoI亚基在各物种间的功能、明确化学农药在熊蜂线粒体中的作用位点提供了依据.
