胃癌外泌体lncRNA CASC11调控TLR4/NF-κB通路诱导M2型巨噬细胞极化
2022-01-04周安付张惠晶
周安付, 谭 琰, 张惠晶
(1.海南医学院第一附属医院消化内科, 海南 海口 570102 2.中国医科大学附属第一医院内镜科, 辽宁 沈阳 110001)
胃癌是常见的且致死率高的消化道恶性肿瘤之一,是癌症死亡的第三大病因,肿瘤转移威胁着胃癌患者的治疗效果,寻求新的胃癌诊断和治疗靶点仍然是研究的重点[1,2]。肿瘤免疫学研究不断发现,多种免疫细胞和免疫检查点均可用于恶性肿瘤的治疗,其中,巨噬细胞是肿瘤微环境中的主要免疫细胞,可分为M1和M2两种表型,M1型巨噬细胞具有促炎作用,但研究表明,M2型巨噬细胞与肿瘤的生长、转移、免疫逃逸等密切相关,亦与患者的预后密切相关[3]。肿瘤外泌体是一类由肿瘤细胞分泌的纳米级囊泡,研究表明,肿瘤外泌体可调控肿瘤的生长、转移以及免疫逃逸等病理进程,或可用于肿瘤的治疗和诊断[4]。外泌体内含lncRNA、miRNA、circRNA等遗传物质而调控靶组织和靶器官的功能,外泌体lncRNA可通过多种途径调控胃癌的发生发展,例如,外泌体lncRNA HOTTIP可调控胃癌的顺铂耐药[5]。在巨噬细胞调控方面,结直肠癌外泌体lncRNA RPPH1可促进M2型巨噬细胞极化[6],而胃癌外泌体lncRNA对巨噬细胞的调控尚无探究,lncRNA CASC11被研究在胃癌中高表达并且可调控胃癌的增殖、迁移以及侵袭[7],本文探究了胃癌外泌体中lncRNA CASC11对巨噬细胞极化的影响及机制。
1 材料与方法
1.1材料:人胃粘膜细胞GES-1,人胃癌细胞株MGC-803、SGC7901、MKN45,人单核细胞系THP1(购自中科院上海细胞库),脂质体LipofectamineTM 2000试剂盒和Trizol试剂盒(购自美国Invitrogen公司),逆转录试剂盒和SYBR Green qPCR试剂盒(购自TaKaRa公司),TSG101、CD9、CD63、TLR4、p-NF-κB、NF-κB、GAPDH抗体,山羊抗兔IgG二抗(购自美国Cell Signaling Technology公司)。
1.2细胞培养:GES-1细胞和MGC-803、MKN45、SGC7901细胞均培养于含10%胎牛血清的DMEM培养基中,THP1细胞培养于10%胎牛血清和50μmoL/L β巯基乙醇的DMEM培养基中,THP1细胞中加入100 ng/mL PMA培养48h后,使THP1分化为人单核巨噬细胞(M0型巨噬细胞)。共孵育:将THP1细胞在6孔板中诱导分化为M0型巨噬细胞,然后将6孔板中的培养基更换为含10μg/mL的外泌体,共孵育48h进行后续研究。
1.3细胞分组与转染:THP-1细胞分为Vector组(转染空白质粒)和lncRNA CASC11组(转染lncRNA CASC11过表达质粒),MGC-803细胞分为Vector组(转染空白质粒)和lncRNA CASC11组(转染lncRNA CASC11过表达质粒),按照上述分组,使用LipofectamineTM 2000试剂盒进行转染,转染成功后用于后续研究。
1.4外泌体的提取和鉴定:将各组细胞的培养基更换为含无外泌体胎牛血清的DMEM培养基,培养48h后收集细胞培养液,3000×g,离心15min,收集上清,100 000×g,离心70min,收集沉淀,加入10mL的PBS溶液重悬,100 000×g,离心70min,所得沉淀即为外泌体,用400μL PBS重悬后,-80℃保存。于透射电镜下观察外泌体的结构,Western blot检测外泌体标志蛋白TSG101、CD9、CD63。
1.5qRT-PCR:使用Trizol试剂盒提取GES-1细胞、各组胃癌细胞以及各组外泌体中的RNA,定量后,使用逆转录试剂盒试剂盒合成cDNA,SYBR Green qPCR试剂盒进行qRT-PCR反应,使用2-ΔΔCT法检测lncRNA CASC11及相关基因mRNA的表达。见表1。
1.6流式细胞术:取各组待检测的巨噬细胞5×105个重悬于200μL PBS溶液,每组细胞中加入2μg FITC-CD206抗体 和PE-CD14 抗体,避光条件下室温孵育30min,设置单独加入FITC-CD206抗体和单独加入PE-CD14 抗体的组别用于调补偿,孵育后用PBS清洗1次,流式细胞仪上机检测CD206+CD14+细胞比例。

表1 基因引物序列
1.7Western blot:使用RIPA蛋白裂解液试剂盒提取各组细胞及外泌体中的总蛋白,BCA试剂盒蛋白定量后,取每组蛋白10μg进行SDS-聚丙烯酰胺凝胶电泳,蛋白分离后进行PVDF转膜,封闭后将PVDF膜与TSG101、CD9、CD63、TLR4、p-NF-κB、NF-κB、GAPDH一抗共孵育过夜,洗膜后与二抗孵育1.5h,TBST清洗后,使用ECL试剂盒曝光,拍照,进行蛋白定量。
1.8统计学分析:使用GraphPad prism软件进行数据分析和作图,数据以均值±标准差表示,组间计量资料的比较采用t检验,P<0.05为差异具有统计学意义。
2 结 果
2.1外泌体鉴定结果:透射电镜检测结果(图1A)显示,GES-1 exo、MGC-803 exo、MKN45 exo、SGC7901 exo粒径在30~100nm之间,具有双层膜结构。Western blot检测(图1B)显示,GES-1 exo、MGC-803 exo、MKN45 exo、SGC7901 exo均表达TSG101、CD9、CD63,符合外泌体的特征。
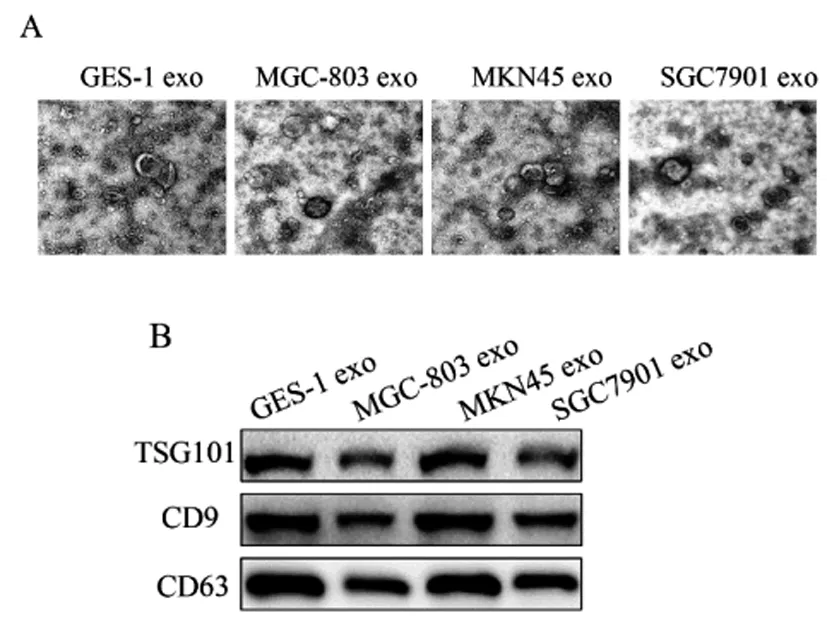
图1 外泌体鉴定结果
2.2lncRNA CASC11高表达于胃癌细胞及其外泌体:qRT-PCR检测结果(表2)显示,相比于GES-1细胞,MGC-803、MKN45、SGC7901细胞中lncRNA CASC11表达显著增加(P<0.05),相比于GES-1 exo,MGC-803 exo、MKN45 exo、SGC7901 exo中lncRNA CASC11表达亦显著增加(P<0.05),说明lncRNA CASC11高表达于胃癌细胞及其外泌体。
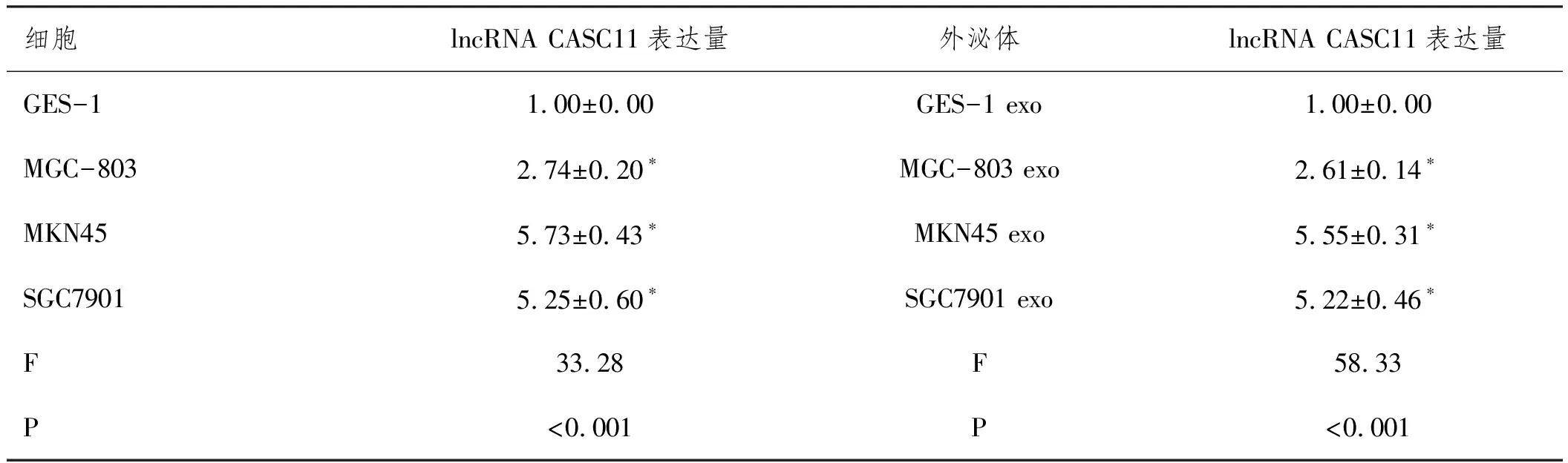
表2 各组细胞及外泌体lncRNA CASC11表达量比较
2.3lncRNA CASC11诱导M2型巨噬细胞极化:qRT-PCR和流式细胞术检测结果(表3,表4,表5)显示,相比于Vector组,lncRNA CASC11组巨噬细胞中M1型巨噬细胞标志物iNOS、CD16表达显著下调(P<0.05),M2型巨噬细胞标志物CD206、Arg-1和Ym1表达显著上调(P<0.05),M1型巨噬细胞特异型细胞因子TNF-α和IL-1β表达显著减少(P<0.05),M2型巨噬细胞特异型细胞因子TGF-β和IL-10表达显著增加(P<0.05),CD206+CD14+细胞比例显著增加(P<0.05),说明lncRNA CASC11可显著诱导M2型巨噬细胞极化。
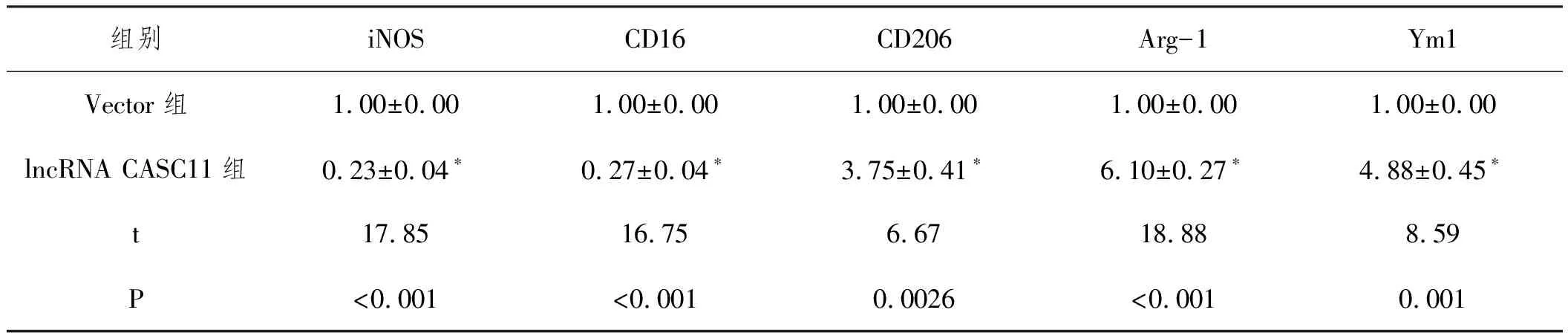
表3 各组细胞iNOS CD16 CD206 Arg-1和Ym1表达比较

表4 各组细胞TNF-α IL-1β TGF-β IL-10表达比较
2.4胃癌外泌体诱导M2型巨噬细胞极化:将外泌体与单核巨噬细胞孵育后,检测结果(表6,表7,表8)显示,相比于PBS组,MGC-803 exo、MKN45 exo和SGC7901 exo组巨噬细胞中M2型巨噬细胞标志物CD206、Arg-1和Ym1表达显著上调(P<0.05),M2型巨噬细胞特异型细胞因子TGF-β和IL-10表达显著增加(P<0.05),CD206+CD14+细胞比例显著增加(P<0.05),M1型巨噬细胞标志物iNOS、CD16表达显著下调(P<0.05),M1型巨噬细胞特异型细胞因子TNF-α和IL-1β表达显著减少(P<0.05),而GES-1 exo组细胞上述指标无显著变化(P>0.05),说明胃癌细胞外泌体可显著诱导M2型巨噬细胞极化。
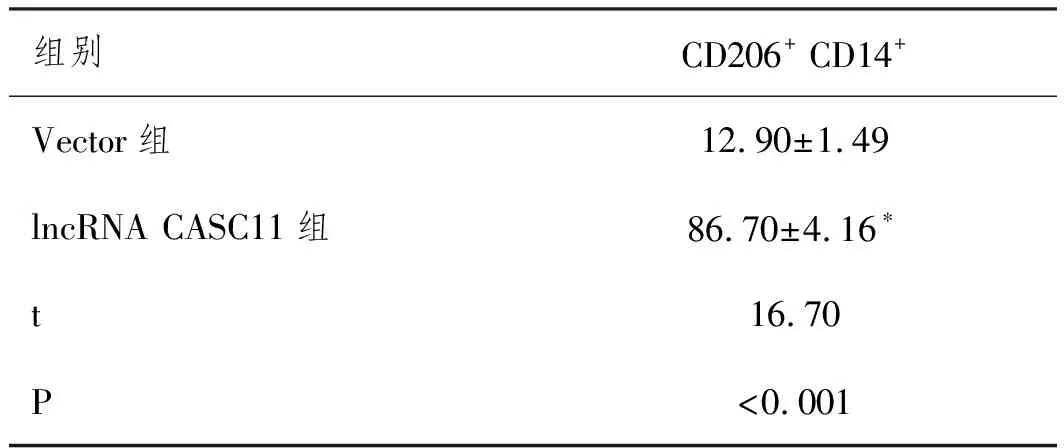
表5 各组细胞CD206+ CD14+细胞比例
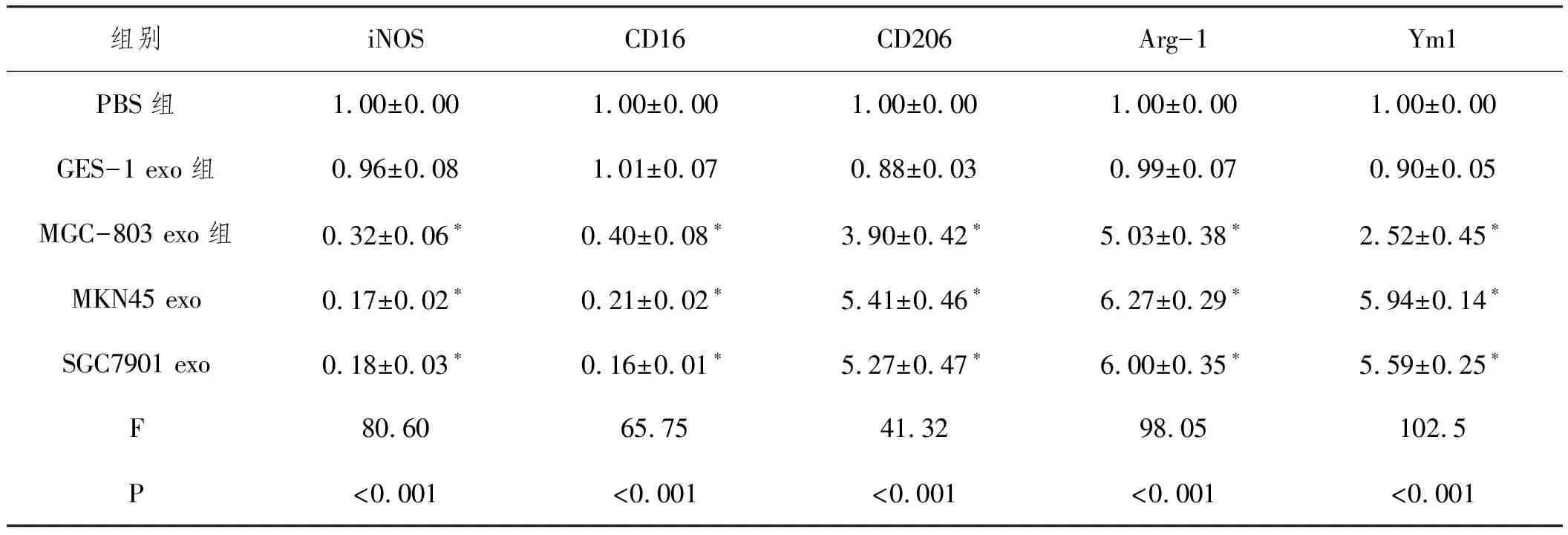
表6 各组细胞iNOS CD16 CD206 Arg-1和Ym1表达比较

表7 各组细胞TNF-α IL-1β TGF-β IL-10表达比较
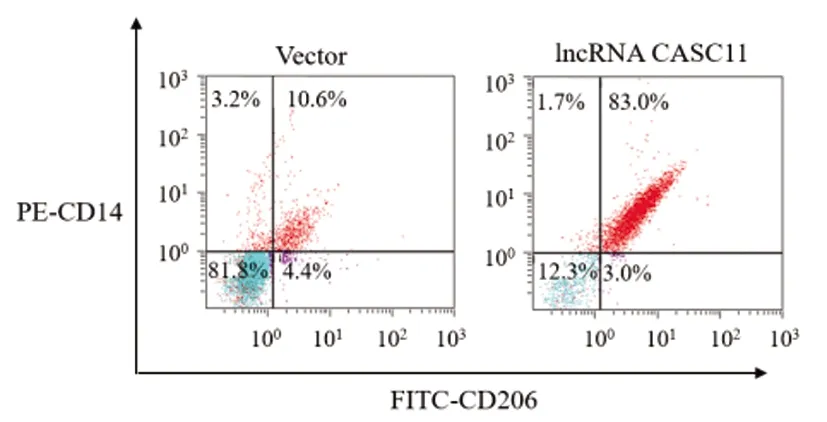
图2 流式细胞术检测lncRNA CASC11对巨噬细胞极化的影响

图3 流式细胞术检测外泌体对巨噬细胞极化的影响
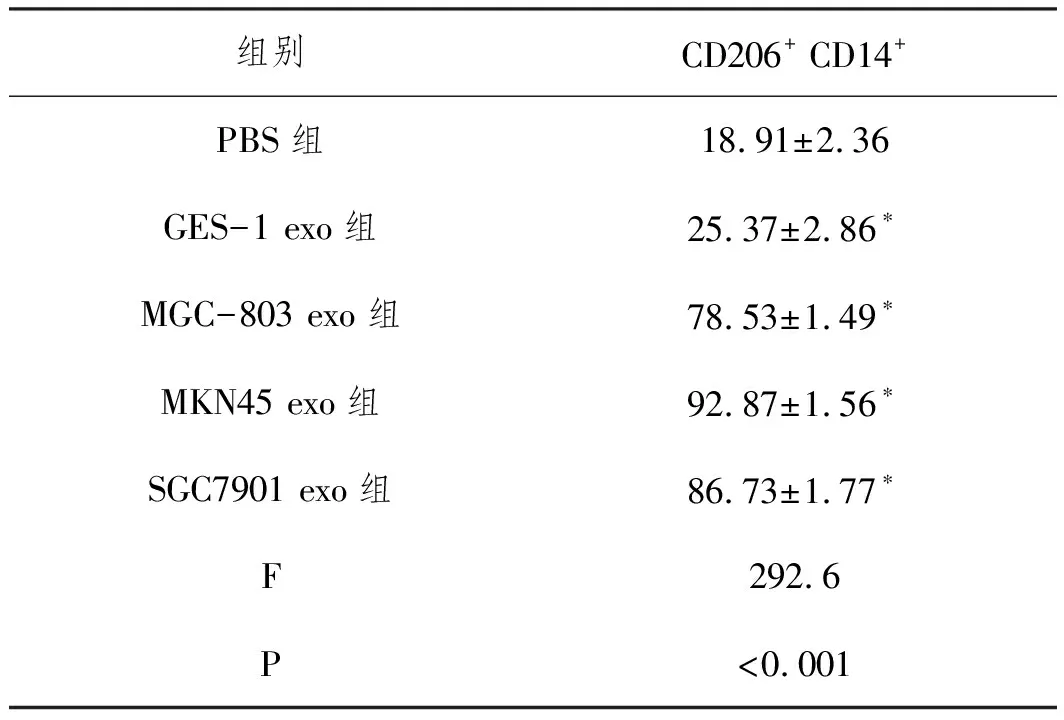
表8 各组细胞CD206+ CD14+细胞比例比较
2.5胃癌细胞外泌体运输lncRNA CASC11至巨噬细胞:相比于PBS组,MGC-803 exo、MKN45 exo和SGC7901 exo组巨噬细胞中lncRNA CASC11表达显著增加(P<0.05),而GES-1 exo组巨噬细胞中lncRNA CASC11表达无显著变化(P>0.05)。在MGC-803细胞中转染空白质粒(Vector)和转染lncRNA CASC11过表达质粒(lncRNA CASC11)后提取MGC-803细胞所分泌的外泌体(Vector exo和CASC11 exo),将Vector exo和CASC11 exo与单核巨噬细胞共孵育后,相比于Vector exo组细胞,CASC11 exo巨噬细胞中lncRNA CASC11表达显著增加(P<0.05),说明胃癌细胞外泌体可转移lncRNA CASC11至巨噬细胞(表9)。
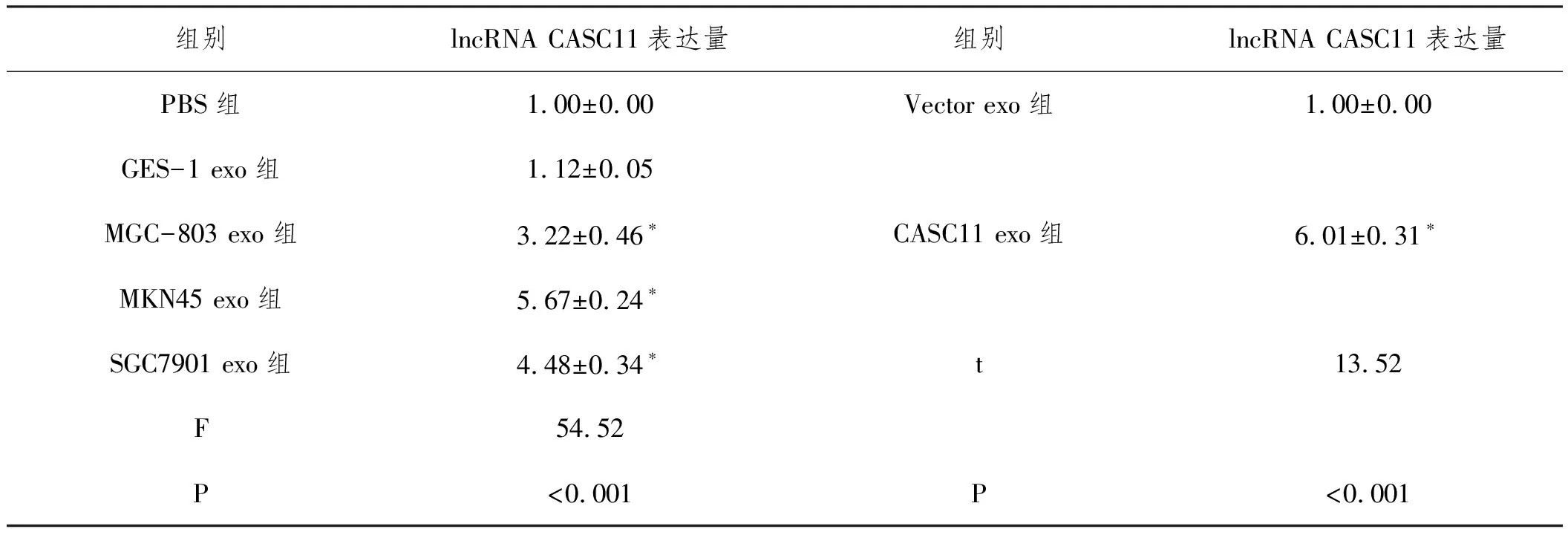
表9 各组细胞lncRNA CASC11表达量比较
2.6外泌体lncRNA CASC11诱导M2型巨噬细胞极化:将Vector exo和CASC11 exo与单核巨噬细胞共孵育后,qRT-PCR和流式细胞术检测结果(图4,表10、表11、表12)显示,相比于Vector exo组,CASC11 exo组巨噬细胞中M2型巨噬细胞标志物CD206、Arg-1和Ym1表达显著上调(P<0.05),M2型巨噬细胞特异型细胞因子TGF-β和IL-10表达显著增加(P<0.05),CD206+CD14+细胞比例显著增加(P<0.05),说明外泌体lncRNA CASC11可显著诱导M2型巨噬细胞极化。

表10 各组细胞iNOS CD16 CD206 Arg-1和Ym1表达比较

表11 各组细胞TNF-α IL-1β TGF-β IL-10表达比较

表12 各组细胞CD206+ CD14+细胞比例比较
2.7外泌体lncRNA CASC11影响TLR4/NF-κB信号通路:Western blot检测结果(图5,表13)显示,相比于PBS组,MGC-803 exo、MKN45 exo和SGC7901 exo组巨噬细胞中TLR4显著下调(P<0.01),NF-κB磷酸化水平亦显著降低(P<0.001),而GES-1 exo组巨噬细胞中TLR4表达和NF-κB磷酸化水平均无显著变化。相比于Vector exo组,CASC11 exo组巨噬细胞中TLR4显著下调(P<0.001),NF-κB磷酸化水平亦显著降低(P<0.001),说明外泌体lncRNA CASC11可显著抑制TLR4/NF-κB信号通路。
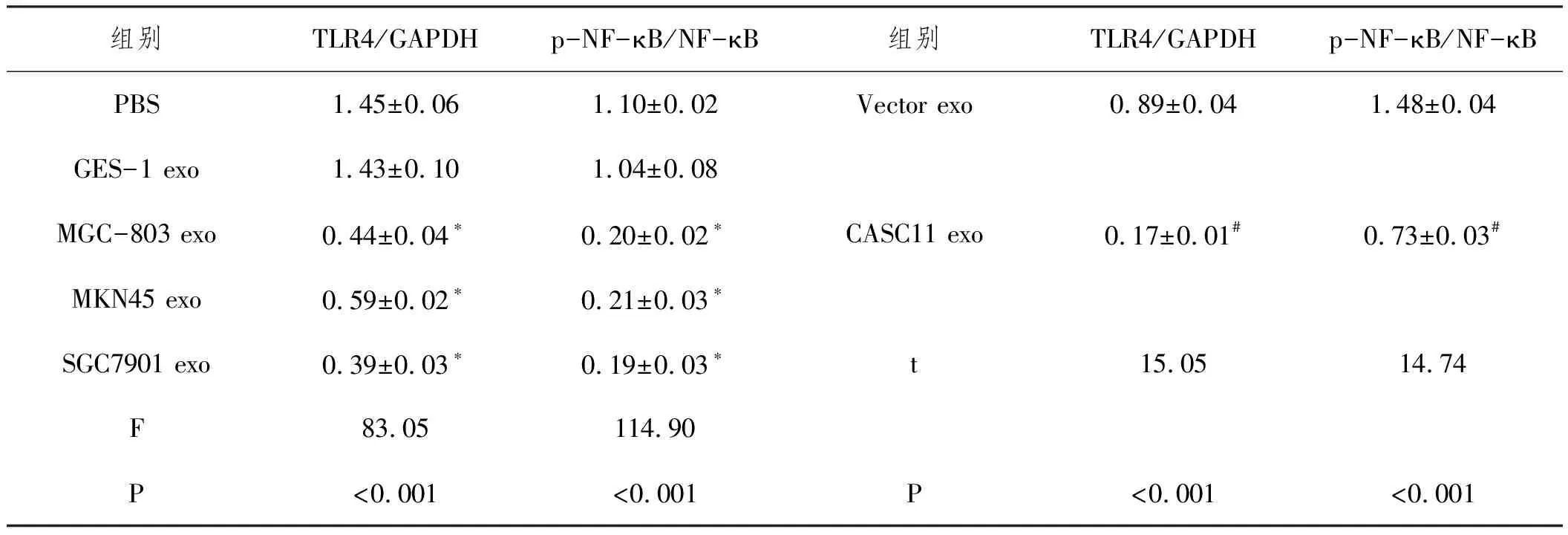
表13 各组细胞TLR4表达和NF-κB磷酸化比较
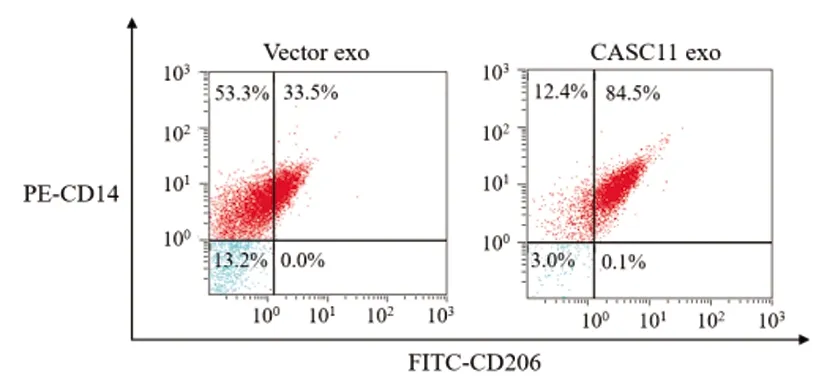
图4 流式细胞术检测CASC11 exo对巨噬细胞极化的影响
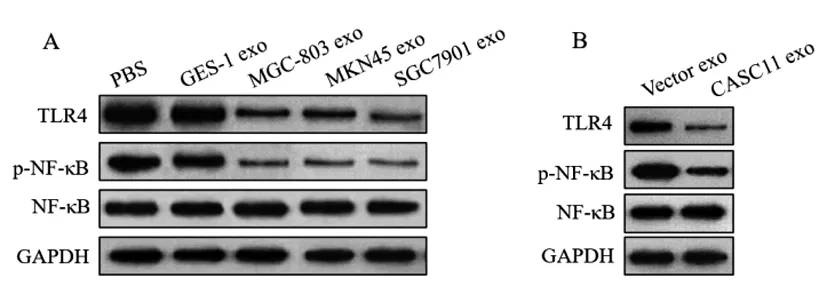
图5 Western blot检测胃癌外泌体(A)以及外泌体lncRNA CASC11(B)对TLR4表达和NF-κB磷酸化的影响
3 讨 论
肿瘤外泌体是肿瘤微环境中的重要组成部分,肿瘤母细胞将携带各种遗传物质的外泌体分泌至肿瘤微环境中而调控肿瘤相关成纤维细胞、肿瘤相关巨噬细胞或者中性粒细胞的形成而影响肿瘤的免疫逃逸,进而调控肿瘤进程[8]。胃癌细胞外泌体也可在肿瘤的发展中发挥重要的调控作用,据报道胃癌外泌体可调控上皮间质转化而促进胃癌进程,外泌体也可调控中性粒细胞向N2型极化而促进胃癌的发展[9]。巨噬细胞是肿瘤微环境中的重要免疫细胞,可分为M1和M2两种表型,其中M2型巨噬细胞与肿瘤相关成纤维细胞相似,具有促进肿瘤发展的作用,研究表明,多种肿瘤细胞外泌体可调控M2型巨噬细胞的极化,胰腺癌外泌体可调控PTEN/PI3Kγ通路而促进M2型巨噬细胞的极化,结肠癌外泌体可诱导M2型巨噬细胞的极化而促进肿瘤的转移[10]。本研究将人胃粘膜细胞GES-1和人胃癌细胞株MGC-803、SGC7901、MKN45所分泌的外泌体分别与人单核巨噬细胞共孵育,发现MGC-803、SGC7901、MKN45所分泌的外泌体可显著促进单核巨噬细胞向M2型极化,说明胃癌外泌体也具有促进巨噬细胞M2型极化的功能。
肿瘤外泌体内含多种遗传物质,包括lncRNA、miRNA、circRNA等,肿瘤细胞将这些遗传物质转运至靶器官和靶细胞而发挥调控作用,其中,外泌体lncRNA被报道具有广泛的调控作用,有望成为肿瘤治疗的新靶点[11],胃癌外泌体lncRNA亦可通过多种途径调控肿瘤进程,如外泌体转移lncRNA ZFAS1而促进胃癌的进程,血清外泌体lncRNA SLC2A12-10:1有望成为胃癌诊断的新靶点[12]。lncRNA CASC11已经被报道可在膀胱癌、宫颈癌、食管癌中高表达而调控肿瘤的发展[13],本研究发现lncRNA CASC11在胃癌细胞及其外泌体中均高表达,并且lncRNA CASC11及胃癌外泌体中的lncRNA CASC11均可促进人单核巨噬细胞向M2表型分化。说明胃癌外泌体可通过转移lncRNA CASC11而促进M2型巨噬细胞的形成。
研究表明巨噬细胞极化与TLR4/NF-κB信号通路密切相关,TLRs与配体结合后,作用于MyD88,MyD88促进下游IL-1R 相关激酶的磷酸化,进而将TRAF6募集至细胞膜,TRAF6富集TAK 复合体,进而调控IκB亚基的活性,而影响非活性巨噬细胞的 NF-κB 转录因子的活化。研究表明[14],胶质瘤外泌体可影响NF-κB通路而促进M2型巨噬细胞极化。本研究发现胃癌外泌体以及外泌体中的lncRNA CASC11均可抑制TLR4的表达和NF-κB的磷酸化,即抑制TLR4/NF-κB信号通路。
综上所述,胃癌外泌体中lncRNA CASC11可通过抑制TLR4/NF-κB信号通路而促进M2型巨噬细胞的极化,但具体的调控机制还需进一步研究。
