miRNA-106-3p、miRNA-654-5p与结直肠癌肝转移患者术后复发的关系研究
2022-01-04李杰卢佳姝
李杰,卢佳姝
结直肠癌(colorectal cancer,CRC)的发病率和病死率在恶性肿瘤中居前列。CRC早期无明显症状,发现时多数为中晚期。手术是目前临床治疗CRC的有效方式,但术后约50%的患者易发生CRC肝转移,是造成CRC患者临床治疗失败的主要原因[1]。随着医疗水平的不断提升,近年来CRC的诊断及治疗有了明显进展,但其5年生存率仍在40%左右,仍有近25%的患者死于术后远处肝转移[2-3]。故研究CRC肝转移患者术后复发的影响因素,并采取有效的预防及治疗措施仍是目前临床关注的重点问题。
目前,CRC的发病机制尚未完全明确。有研究认为,一系列基因及表观遗传学的改变引起癌细胞中重要信号通路发生变化,部分基因表达受到影响而导致CRC的发生及发展[4]。微小RNA(microRNA,miRNA)是一类非编码的单链小RNA,其转录后水平可调控多种基因表达,在细胞增殖、分化及凋亡等生理过程中发挥重要作用。既往研究证实[5-6],微小RNA-106-3p(miRNA-106-3p)、微小RNA-654-5p(miRNA-654-5p)可在血清中长期稳定存在,这种稳定存在于血清循环中的miRNA在CRC肝转移的早期诊断及疗效评估等方面显示出了巨大的应用价值,但关于其与CRC术后复发患者的关系研究尚少。血清miRNA作为新型标志物,具有取材方便、检测成本低、灵敏度高等优点,被广泛应用于人群疾病的普查。本研究选取110例CRC肝转移患者,分析其血清miRNA-106-3p、miRNA-654-5p水平与CRC肝转移患者术后复发的关系。
1 资料与方法
1.1 一般资料
选取泰州市人民医院2014年12月至2017年12月收治的110例CRC肝转移患者。纳入标准:①经CT/MRI检查证实为CRC异时性肝转移;②首次参与此类研究且术前未接受放疗、化疗等治疗;③符合姑息/根治手术指征且手术成功;④患者意识清晰且无沟通交流障碍;⑤知晓研究内容且自愿签署研究协议书。排除标准:①合并胰腺疾病或其他系统原发恶性肿瘤;②合并肠梗阻、肠瘘、肠套叠等其他肠道疾病;③合并神经系统疾病及既往病史者;④治疗依从性差或院内资料不齐全者。本组患者年龄35~71岁,平均(46.1±10.1)岁;体质量指数(20.13±5.49)kg/m2;结肠肿瘤70例,直肠肿瘤40例;肿瘤直径≥4 cm者60例,肿瘤直径<4 cm者50例;均行手术治疗,其中行姑息手术40例,行根治性手术70例。本研究获取得医院伦理委员会审查批准。
1.2 方法
1.2.1 实时定量聚合酶链反应(RT-qPCR)检测miRNA-106-3p、miRNA-654-5p表达水平 分别于术前、术后1 d抽取患者外周静脉血,置于含抗凝素的离心管中,静置15 min后,以3 000 r/min离心10 min,分离上层血清,于-80 ℃下保存备用。使用miRNA提取试剂盒(购于德国Qiagen生物公司),根据说明书操作要求提取样本RNA,总RNA样本于-80 ℃保存。采用MSPTouch纳米滴分光光度计(购于北京世联博研科技有限公司)测量RNA浓度。使用miRNA SYBR Green检测系统(购于上海拓然生物科技有限公司)进行RT-qPCR,将冻干的引物(购于德国Qiagen生物公司QuantiTect引物库)溶于10Tris-EDTA缓冲液中,将RNU6作为miRNA-106-3p、miRNA-654-5p的管家基因,用如下PCR程序检测上述提取的miRNA:1个周期(片段1),95 ℃ 15 min;2个周期(片段2),94 ℃ 15 s,55 ℃ 30 s,70 ℃ 30 s;30个周期。引物序列如下,miRNA-106-3p:正向5′-CAAATTAGACTTCTCTTGGGT-3′;反向5′-TGAAGGGGTATACGAAGGAAG-3′。miRNA-654-5p:正向5′-CCCTCCACAAAGCCCGCTTGA-3′;反向5′-CCTGCAAAGAGGCCTTTCATA-3′。RNU6:正向5′-CCTGTATCGAAGGGACCCTTA-3′;反向5′-ACTGCTGATGCTGCCATGCAA-3′。采用△△Ct法定量分析miRNA-106-3p、miRNA-654-5p表达水平,在上述试验条件下,获得目标基因RNU6的平均交叉点(Ct)值,RNU6包括试验条件、控制条件,分别对应试验值、控制值,计算试验值及控制值之间的差异,即Ct值,可得2-△△Ct值,进而得到miRNA相对表达量。
1.2.2 资料收集及随访 收集CRC肝转移患者的临床资料,如患者性别、年龄、吸烟饮酒史、原发肿瘤位置、脉管瘤栓、肿瘤分化程度、肝转移病灶分布、TNM分期、手术方式、肝转移瘤范围、肝转移瘤包膜是否完整、肝内转移病灶数目及肝内转移病灶最大直径等。随访3年,失访5例。根据以下标准对余下105例患者复发情况进行判断:经MRI、超声或其他影像学检查未发现新发病灶,且血清中癌胚抗原(carcino embryonic antigen,CEA)<5 ng/ml,糖类抗原199(carbohydrate antigen,CA19-9)<37 U/L,表明无复发迹象,归为未复发组,其余归为复发组[7]。照此标准,105例患者中30例复发(复发组),75例未复发(未复发组)。
1.3 统计学方法

2 结果
2.1 复发组与未复发组miRNA-106-3p、miRNA-654-5p表达水平比较
手术前,两组miRNA-106-3p、miRNA-654-5p表达水平差异无统计学意义(P>0.05)。手术后,两组miRNA-106-3p、miRNA-654-5p表达均上调,且复发组高于未复发组,差异有统计学意义(P<0.05),见表1。
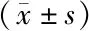
表1 复发组与未复发组miRNA-106-3p、miRNA-654-5p表达水平比较
2.2 单因素分析可能影响CRC肝转移患者术后复发的危险因素
两组性别、年龄、吸烟史、饮酒史、原发肿瘤位置及分化程度、脉管瘤栓、TNM分期、手术方式、肝转移瘤包膜是否完整、肝内转移病灶数目、肝内转移病灶最大直径比较,差异无统计学意义(P>0.05);复发组与未复发组的肝转移病灶分布、肝转移瘤范围、术后miRNA-106-3p、miRNA-654-5p表达比较,差异有统计学意义(P<0.05),见表2。
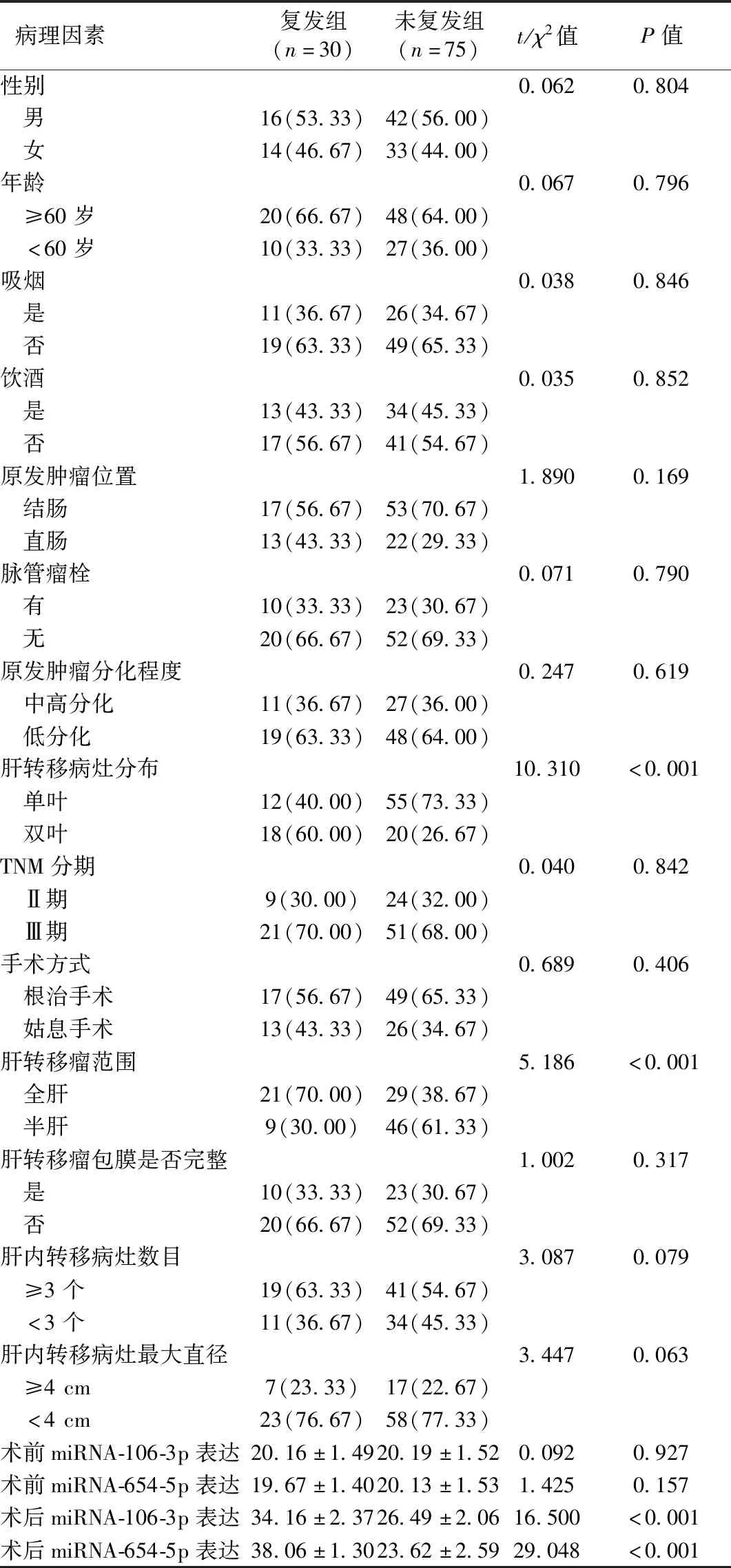
表2 单因素分析可能影响CRC肝转移患者术后复发的危险因素
2.3 Logistic回归分析影响CRC肝转移患者术后复发的危险因素
以CRC肝转移患者术后复发为因变量(复发=1,未复发=0),以表1中有统计学差异的指标为自变量[肝转移病灶分布(双叶=1,单叶=0),肝转移瘤范围(全肝=1,半肝=0),术后miRNA-106-3p表达量,术后miRNA-654-5p表达量],进行Logistic回归分析,结果显示,肝转移病灶双叶分布、肝转移瘤位于全肝、术后miRNA-106-3p、miRNA-654-5p高表达是影响CRC肝转移术后复发的危险因素,见表3。

表3 Logistic回归分析影响CRC肝转移患者术后复发的危险因素
3 讨论
肝脏是CRC转移的常见部位,肝转移是导致CRC患者死亡的最主要原因。有文献报道,约15%~20%的患者在确诊CRC时即有肝转移,约40%的CRC患者在术后易发生肝转移,CRC肝转移患者的远期预后生存情况不理想,若未经治疗,其中位生存时间仅为7个月[8-9]。目前国内外较公认的CRC肝转移治疗策略是手术治疗。1980年首次通过临床随机对照实验证实,在合适时间进行手术切除肝脏转移病灶可明显延长CRC肝转移患者的生存时间[10]。但近年来的研究显示,CRC肝转移患者术后5年生存率仅约为40%,术后复发概率约为25%~30%,术后复发是造成CRC肝转移患者生存期缩短的主要原因[11]。本研究也得出类似结论,随访3年后,CRC肝转移患者的术后复发率为28.57%(30/105),故评估CRC肝转移患者术后复发的危险因素具有十分重要的临床意义。
本研究发现,肝转移病灶双叶分布、肝转移瘤位于全肝、术后miRNA-106-3p、miRNA-654-5p高表达是影响CRC肝转移术后复发的危险因素。miRNA是一种小的非编码RNA,可通过切割靶信使RNA、抑制靶基因翻译等方式干扰靶基因表达。近年来研究发现,miRNA可通过调控细胞增殖、分化、凋亡,对肿瘤恶性表型起促进或抑制作用,与正常细胞比较,肿瘤细胞组织中miRNA存在异常表达,其在肿瘤形成及发展中起重要作用,可作为肿瘤病因学、组织分型及临床分期的分子标志物[12-13]。Ashrafizadeh等[14]通过比较胃癌患者与正常人的相关miRNA水平,发现miRNA-124在胃癌细胞中的表达水平低于正常胃黏膜上皮细胞,其表达下调可激活PI3K信号通路,促进胃癌增殖。也有研究发现,miRNA-27a及miRNA-18b可作为肝炎病毒相关肝细胞癌的潜在预测生物分子标志物,对优化肝癌临床治疗方案、改善患者远期预后均有积极意义[15]。本研究发现,在CRC肝转移患者中,与未复发组比较,复发组的miRNA-106-3p、miRNA-654-5p表达水平均上调,与Makondi等[16]研究结果一致,表明miRNA-106-3p、miRNA-654-5p表达上调可辅助判断CRC肝转移患者术后是否复发,为临床优化CRC肝转移的治疗策略提供参考。推测源于miRNA可通过结合到特定信使RNA加速癌基因翻译,从而参与基因转录后调控的过程,调节肿瘤细胞增殖、分化等生理过程[17]。Claudin(CLDN)是维持紧密连接结构及功能的重要组成部分,具有完整的膜蛋白,在维持细胞极性及信号转导中起重要作用,miRNA-106-3p可通过调节CLDN癌基因而阻止溶质、水等通过上皮细胞板间细胞旁空间,其表达上调可加速CRC细胞表达,进而增加CRC肝转移患者术后复发的风险。既往研究证实,miRNA-654-5p与人信号传导分子(SMAD)2、SMAD7有关,SMAD7是转化生长因子-β信号通路的重要组成部分,其受到抑制可使转化生长因子β受体Ⅰ表达增加[18-19]。本研究中miRNA-654-5p上调可能对转化生长因子-β途径产生负反馈调节,继而使相关癌基因表达升高,增加肝转移患者术后复发风险。
综上所述,根据术后miRNA-106-3p、miRNA-654-5p表达情况可辅助判断CRC肝转移患者术后是否出现复发,临床价值较高。但因本研究样本量有限,相关结论仍需多中心、大样本临床试验进一步论证。
