甲状腺髓样癌5例临床病理分析
2022-01-04黄勇杰李炳权罗丽花曾思红
黄勇杰,李炳权,罗丽花,曾思红
根据2017版WHO肿瘤分类[1],甲状腺癌分为乳头状癌、滤泡癌、髓样癌(medullary thyroid carcinoma,MTC)、低分化癌、未分化癌、鳞状细胞癌、混合性髓样-滤泡性癌、黏液表皮样癌及黏液性癌等多种类型。其中甲状腺髓样癌在新版分类中内容变化不大,它起源于滤泡旁细胞(C细胞),具有神经内分泌特征,约占所有甲状腺恶性肿瘤的2%~3%[1];生物学行为中度恶性,对化疗及包括碘131在内的放疗均不敏感,复发率及转移率较高,预后相对较差。MTC分为散发型和遗传型两类,占比分别约70%及30%。男女比例大致1∶1,但散发性MTC中女性发病率稍高[1-2]。本研究通过对5例散发型MTC的临床资料、组织学特点、免疫组化和特殊染色特点进行回顾性分析,并结合相关文献,加深MTC的认识和了解其新进展。
1 资料与方法
1.1 一般资料清远市人民医院2010年1月至2019年9月年发生甲状腺髓样癌5例,男性3例,女性2例,年龄范围35~58岁,平均年龄45.4岁,肿瘤最大径范围1.5~6.0 cm;左侧3例,右侧2例;均以偶然发现颈前肿物入院,病史最长者10年余,最短者半月,其中1例间有疼痛,余4例均无明显不适。血清检查发现降钙素原(PCT)升高1例(余4例未查),降钙素(CT)升高2例(余3例未查),癌胚抗原(CEA)升高3例(余2例未查)。5个病例均行手术切除肿物,切除标本送病理科。见表1。
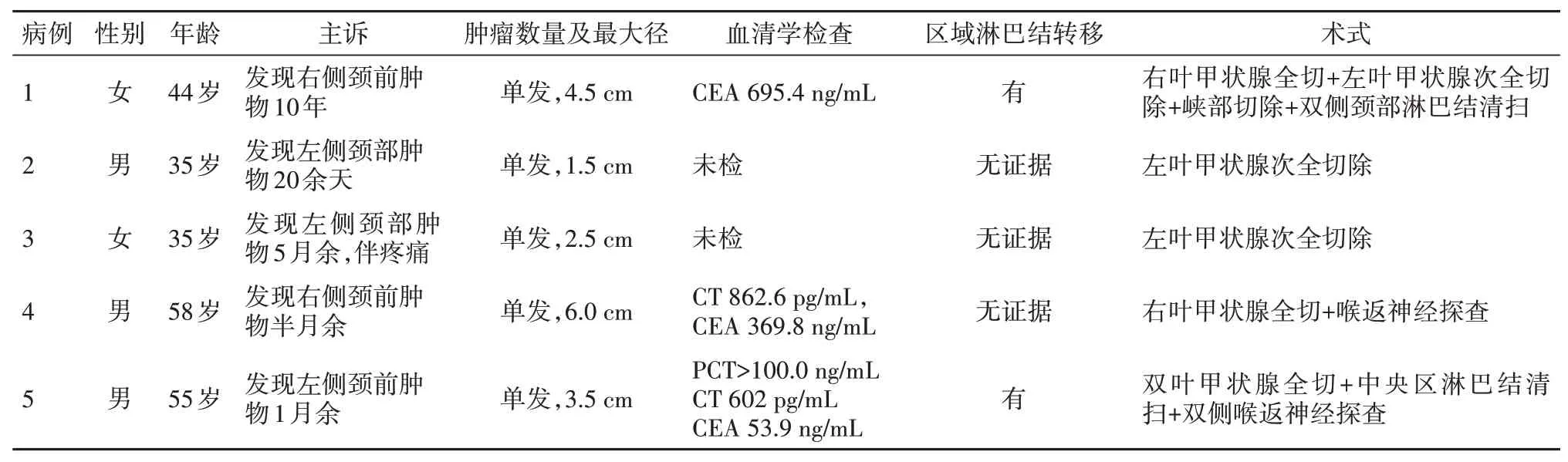
表1 甲状腺髓样癌5例临床资料
1.2 方法送检标本均用10%中性福尔马林固定,石蜡包埋,行常规HE染色,切片厚度约3 μm。免疫组化染色采用Envision两步法。免疫组化一抗嗜铬素A(CgA)、突触素(Syn)、白细胞分化抗原56(CD56)、CEA、细胞角蛋白19(CK19)、周期蛋白D1(Cyclin D1)、Ki-67、间皮细胞(MC)、信号通路蛋白100(S-100)、TG、甲状腺过氧化物酶(TPO)、甲状腺转录因子-1(TTF-1)、细胞角蛋白(CK)、降钙素(Calcitonin)、波形蛋白(Vimentin)等均购自北京中杉金桥生物技术有限公司;刚果红、甲基紫试剂盒购自珠海贝索生物技术有限公司。上述一抗均为即用型抗体,并设阴性和阳性对照。
1.3免疫组织化学(免疫组化)染色判定标准免疫组化阳性判定原则:根据各一抗抗体的着色位置不同,分别以胞质、胞膜或胞核出现棕黄色颗粒判断为阳性,否则为阴性。
2 结果
2.1 巨检甲状腺肿物最大径范围约1.5~6.0 cm,大部分无包膜,局部见少量纤维包膜,实性,边界较清晰,切面灰黄、灰红或灰褐色,质中,个别伴出血。
2.2 镜检低倍镜见肿瘤边界清晰,瘤细胞呈巢片状、器官样、小梁状或乳头状排列,间质见多量纤维组织及血管分隔,并见较多无定形粉染物(淀粉样物);高倍镜见瘤细胞质中等量、浅染,核大小较一致、深染,细胞核呈圆形或椭圆形,部分病例核梭形,可见小核仁,核分裂象少见。见图1。
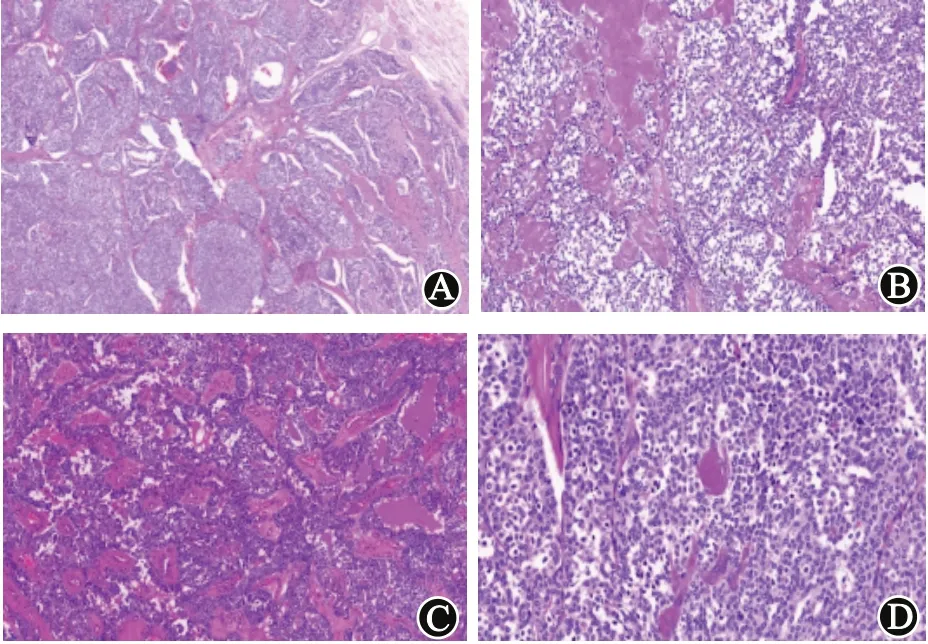
图1 甲状腺髓样癌标本镜检肿瘤细胞:A为排列成梁状,间质可见较多纤维血管分隔(HE×50);B为排列成巢团状,可见淀粉样物沉(HE×200);C为排列成乳头状结构(HE×100);D为见细胞质中等量、浅染,核大小较一致、深染,细胞核呈圆形或椭圆形,部分核梭形,可见小核仁(HE×400)。
2.3 免疫组化及特殊染色病例1,瘤细胞CEA、CgA、Syn、CK(+),TTF-1(-),Ki-67(约5%+)。病例2,瘤细胞CD56、CEA、CgA、Syn(+),TTF-1(部分弱+),Cyclin D1(约40%+),Ki-67(约2%+),CK19、MC、TG、TPO(-)。病例3,瘤细胞CD56、CEA、CgA、Syn(+),Cyclin D1(约70%+),Ki-67(约2%+),CK19、MC、S-100、TG、TPO、TTF-1(-)。病例4,瘤细胞CD56、CEA、CgA、Syn、CK(+),Calcitonin(弱+),Ki-67(约5%+),Vimentin、TG(-)。病例5,瘤细胞CD56、CEA、CgA、Syn、CK(+),Calcitonin(弱+),Ki-67(约3%+),TG、Vimentin(-)。
5个病例的淀粉样物甲基紫及刚果红染色均(+)。见图2。
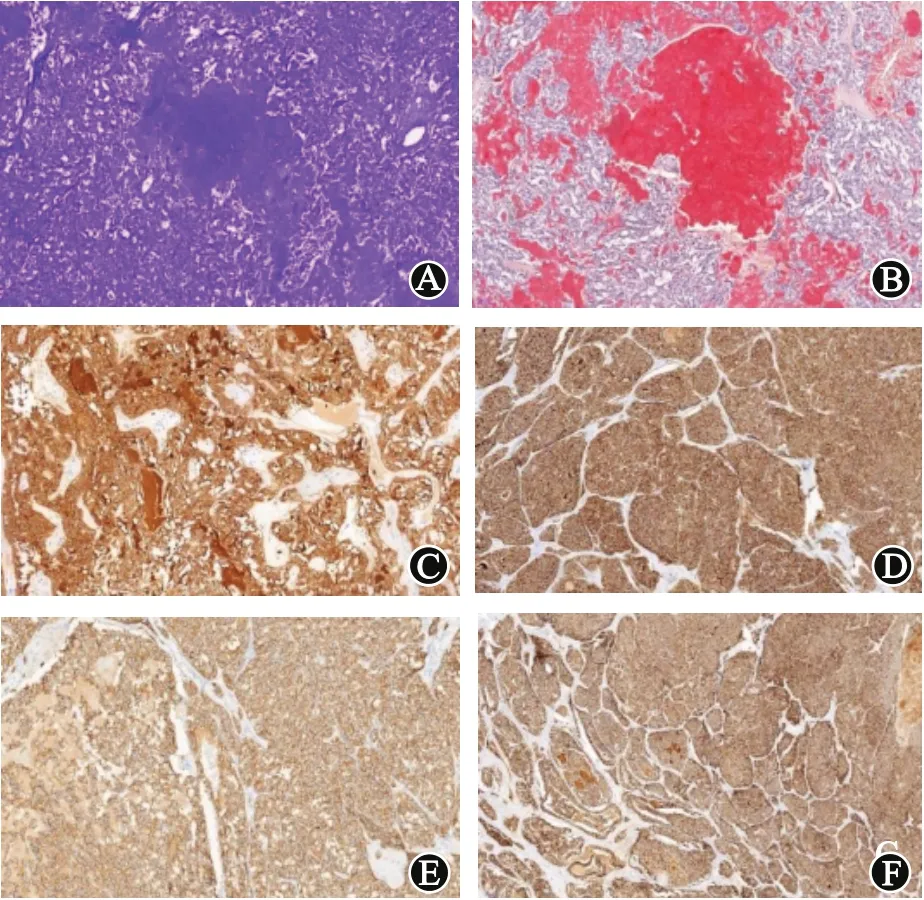
图2 甲状腺髓样癌标本免疫组化及特殊染色:A为甲基紫染色(×100);B为刚果红染色(×100),显示淀粉样物均(+);C为肿瘤细胞癌胚抗原(CEA)(×200);D为白细胞分化抗原56(CD56)(×100);E为突触素(Syn)(×200);F为嗜铬素A(CgA)(×50),均(+)
2.4 诊断及随访5个病例均诊断为甲状腺髓样癌。其中病例1右侧颈区9枚淋巴结见转移癌;病例5中央区淋巴结3枚见转移癌。病例2、3、4未送检淋巴结。
病例1术后8.5年复查甲状腺超声提示右侧叶区域见范围约6.2 cm×4.3 cm异常回声灶,右颈部V区见多个淋巴结(较大者大小约1.7 cm×0.7 cm),左叶未见明显异常;胸部增强CT提示甲状腺右侧叶区域肿块突入胸腔(最大截面约5.7 cm×3.3 cm),纵隔多发结节、肿块;双肺上叶多发结节(较大者大小约2.1 cm×1.7 cm),考虑转移瘤;降钙素原(PCT)>100 ng∕mL,CEA>1 000 ng∕mL,未再行手术治疗,仅于外院予中药处理;随访至今(术后10年),病人目前带瘤生存。病例2、3、4、5随访至今(随访时间分别为5年、5年、14个月及13个月),暂无复发迹象。
3 讨论
MTC是起源于甲状腺C细胞的神经内分泌肿瘤,属于胺前体摄取及脱羧细胞(APUD)肿瘤的一种,由Hazard[3]等在1959年首次提出。C细胞来自胚胎发育的神经嵴,可分泌降钙素。MTC可分为散发性(约占70%)和遗传性(约占30%)两类。其中后者分为多发性内分泌腺瘤2A型(MEN 2A)、多发性内分泌腺瘤2B型(MEN 2B)以及家族性甲状腺髓样癌(FMTC)[4]。散发性MTC无家族史,常表现为单侧腺体的无症状单发结节,少数多发,主要以体检发现颈部肿物就诊,部分病例有声音嘶哑、吞咽困难和淋巴结肿大等症状;因它可分泌5-HT、组胺等生物活性物质,约30%病人可出现腹泻[5]、心悸、颜面潮红、头痛等;个别病例因CEA[6-8]、降钙素或降钙素原[9-10]异常升高而发现,三者的升高对诊断MTC有一定的临床意义。确诊年龄偏大(约40~60岁),肿瘤坏死、出血和血管浸润较常见[11]。遗传性MTC是常染色体显性遗传[12],男女比例较一致,年龄多为40岁以下,儿童也可受累,临床上多为双侧多发结节。MEN2A好发于30~40岁,典型特征为甲状腺髓样癌、嗜铬细胞瘤和原发性甲状旁腺功能亢进,可同时伴发皮肤苔藓淀粉样变及先天性巨结肠[13];MEN2B发病中位年龄约23~28岁,恶性程度最高,它不发生甲状旁腺功能亢进,但伴有明显的发育障碍,包括骨骼肌肉异常(如马凡体型、漏斗胸等)、胃肠道和口腔黏膜神经瘤病等;FMTC被认为是MEN2A的一种变异亚型,仅表现为甲状腺髓样癌[14]。
MTC的诊断较困难,在快速冰冻时挑战更大,常需依赖石蜡切片结合免疫组化及特殊染色才能诊断。部分病例术前行细针吸取细胞学检查(FNAC),但敏感性仅12.5%~89.0%[15]。大体上,肿瘤最大径数厘米不等,边界较清,常缺乏包膜,切面灰白、灰黄或灰褐色;散发型MTC多累及一侧叶,常单发,质中,局部可伴有钙化,质韧或质硬。镜下瘤细胞呈巢状、梁状、腺管样、类癌样、片状或实性结构,由圆形、卵圆形、多边形、柱状、立方,部分可呈小细胞质细胞样,细胞形态大小相对一致,胞质内见分泌性颗粒、淡染,核分裂象不易见;间质可见淀粉样物沉积,略嗜伊红,多少不等,且可见较多血管分隔,部分病例见玻璃样变的胶原组织,少数可见钙化灶。按形态结构特点的不同,MTC有多种变异亚型,包括乳头或假乳头型、腺样型、巨细胞型、梭形细胞型、小细胞∕神经母细胞型、副节瘤样型等等。个别缺乏淀粉样物质、纤细的纤维血管间质和玻璃样变组织的MTC,常常易误诊为甲状腺腺瘤或瘤样病变,需借助免疫组化确诊。免疫组化上,MTC表达Calcitonin、CK、CgA、CD56、Syn、CEA等,而TG、TTF-1、PTH、MC阴性。特殊染色:淀粉样物质刚果红和甲基紫染色阳性。电镜下见胞质内有神经内分泌颗粒,直径100~400 nm,对诊断MTC有很大价值。分子遗传学上,大多数MTC存在RET基因突变。RET基因定位于人类染色体10q11.2,包含21个外显子,它编码的是酪氨酸激酶受体蛋白。突变区域最常见于外显子10、11、13、14、15和16。在散发型MTC中,40%~50%病例存在RET基因突变,以密码子M918T突变最常见。在遗传性MTC中,约88%~98%存在生殖细胞RET基因突变[13]。
MTC需与以下疾病鉴别:(1)透明变梁状肿瘤:肿瘤常呈弥漫一致的实性或梁状结构,内可见大量透明变的胶原纤维和基底样物质,后者常伴玻璃样变性,且PAS染色阳性,未见淀粉样物沉积。瘤细胞不表达Calcitonin、Syn、CgA、TG等,Ki-67(MIB-1克隆)呈特征性的膜阳性[16]。(2)副神经节瘤:由卵圆形或多边形的主细胞和其周边的支持细胞组成,瘤细胞呈器官样排列,可见纤细的纤维血管间质分隔,可表达CgA、Syn等神经内分泌标记,有时鉴别诊断相当困难。但副节瘤有S-100阳性的支持细胞存在,且Calcitonin和CEA阴性。(3)乳头状癌:癌细胞呈乳头状或滤泡状排列,核拥挤、重叠,呈毛玻璃样,可见核沟、核内假包涵体,间质可出现砂粒体,无淀粉样物质,免疫组化表达TTF-1、TG、CK19、Galectin-3,不表达Calcitonin、神经内分泌标记等。(4)滤泡癌:血管浸润和包膜侵犯是重要的诊断依据,通常无淀粉样物,免疫组化对诊断滤泡癌的作用不大,但不表达Calcitonin、CEA、神经内分泌标记等。(5)低分化及未分化癌:低分化癌细胞呈岛状、梁状或实性排列,可见坏死,无淀粉样物质沉积。未分化癌细胞常呈弥漫分布,核分裂象多见,核异型明显,坏死常见。免疫组化Tg阳性,CT阴性、CEA常弱阳性或不表达。(6)C细胞增生:C细胞常散在簇状分布,无侵犯周围组织,无促纤维组织增生反应间质。(7)小细胞肿瘤:小细胞∕神经母细胞亚型MTC,常与其他小圆细胞肿瘤混淆,如小细胞癌、恶性淋巴瘤、Ewing肉瘤∕PNET、小细胞恶性黑色素瘤等,但各自均有其独特的形态及免疫组化特点。
MTC术后生存率偏低,病死率达到甲状腺癌的13.4%[17]。散发型MTCⅠ~Ⅳ期病人的10年生存率分别为100%、93%、71%和21%[18]。肿瘤小、有包膜、边界清楚、无血管淋巴结转移、分化较好以及无促结缔组织增生性间质反应[19]是MTC预后较好的指标。因此早期发现、早期治疗相当重要。美国甲状腺协会指南推荐MTC的治疗是以手术根治为主,术式为甲状腺全切除术及颈部淋巴结清扫,而清扫范围则依据肿瘤大小、病变侵及部位、基因突变位点的不同而不一样;术后可辅以放化疗等。但目前我国很多地区对MTC诊治指南的认识尚不足,手术术式选择常不规范,需注意及时更新和普及。近年来,人们热衷于研究MTC的精准靶向治疗,针对其出现的RET基因突变(靶点在于酪氨酸激酶),临床上常用酪氨酸激酶抑制剂(TKI)ZD6474(多靶点TKI)、莫替沙尼等进行靶向治疗,是目前重点发展方向。另外,抗CEA、生长抑素类似物及血管生长抑制剂也应用于MTC的治疗,但效果有待印证。
