花生四烯酸12-脂氧化酶-12-氢基二十碳四烯酸-GPR31轴在肝脏再灌注肝缺血损伤中的作用
2022-01-04高杨张升宁李来邦冉江华
高杨,张升宁,李来邦,冉江华
随着移植科学的快速发展,器官移植已成为器质性终末期病人唯一决定性且有效的治疗手段[1]。其中,移植组织的缺血再灌注损伤(ischemia reperfusion,IR)是器官移植中不可避免的后果[2]。IR相关的组织损伤占早期移植失败的10%,是导致器官排斥和肝功能损害的主要原因[3]。不仅是器官移植手术,肝脏再灌注肝缺血损伤多发于缺血性休克及多种肝脏外科手术中,是影响肝移植和肝脏叶段切除术后肝功能的一个多因素过程[4]。肝脏组织长时间缺血会产生由活性氧簇产生、中性粒细胞活化等导致炎症、细胞凋亡和损伤过程[5]。再灌注后,会进一步加重肝脏组织细胞的代谢障碍和结构破坏。组织损伤进一步加重,甚至导致肝脏的功能衰竭,严重威胁了病人生命[6]。目前为止,还没有有效的药物干预治疗肝IR损伤,缺血预处理是唯一有希望的改善预后的策略[7]。然而,预处理的有益效果仅限于一部分年轻病人,例如能够实现长时间的血流阻断且肝脏体积较小[8]。由于肝脏缺血损伤的致病模式涉及缺血诱导的细胞损伤和再灌注引起的炎症反应的双相过程[9]。因此,对于肝脏再灌注肝缺血损伤,需要开发有直接抗炎和抗凋亡两种特性的药物,目前并未发现能够有效实现这种临床作用的有效药物[10]。因此,需要更深入的了解这种致病过程的基本机制。本研究自2019年2―6月采用肝脏再灌注肝缺血损伤小鼠模型,通过基因敲除手段阻断12-氢基二十碳四烯酸(HETE),观察其对肝脏再灌注肝缺血损伤中的改善作用。从而为花生四烯酸12-脂氧化酶(ALOX12)-12-HETE-GPR31轴在肝脏再灌注肝缺血损伤临床治疗中的临床应用提供理论依据。
1 资料与方法
1.1 小鼠模型构建8周龄雄性B6.Cg-Tg(MX1-cre)Cgn∕J小鼠(Joint Ventures Sipper BK)36只,体质量(23±3)g,购自昆明市第一人民医院动物实验室。实验中充分保证动物福利、给予动物人道关怀,动物处置也符合伦理学原则。小鼠采用随机数字表法分为空白对照组、实验对照组和实验组,每组各12只。所有小鼠禁食12 h后,采用5 mL∕kg的25%(V∕V)乌拉坦进行腹腔注射麻醉。(1)实验组:小鼠进行基于胚胎干细胞的基因打靶技术制备基因敲除手术:①订购课题BAC菌;②完成打靶载体设计和构建;③将重组载体电转到胚胎干细胞中,用G418筛选转染后的胚胎干细胞得到阳性克隆;④通过PCR和southern blot杂交技术筛选阳性克隆,得到稳定整合外源基因的胚胎干细胞;⑤将胚胎干细胞阳性克隆注射到小鼠囊胚中,并植入到假孕小鼠的子宫内;⑥获得F1阳性杂合子小鼠。进行肝血流阻断。肝血流阻断45 min后发送移走血管夹,以恢复血液供应。(2)实验对照组:进行肝血流阻断。(3)空白对照组:同样进行开腹但并不进行肝血流阻断。
1.2 实时荧光定量PCR(RT-PCR)采用Trizol抽提法提取采集小鼠组织的总RNA,然后按照反转录试剂盒(TAKARA公司)说明书合成cDNA。随后进行实时荧光定量PCR,RT-PCR方法参照TAKARA公司的SybergreenI mix试剂盒。RT-PCR反应体系为20 μL,其中2×赛柏格林(Sybergreen)预混液10 μL,校正染料0.3 μL,cDNA 1.5 μL,上下游引物各0.5 μL,加水至20 μL。采用ABI公司的7300型Real-Time PCR仪进行RT-PCR,反应条件为:94℃5 min,94℃15 s,58℃15 s,72℃15 s,共35个循环,扩增反应完成后又进行了溶解曲线的制作,确保扩增的特异性。
1.3 炎性因子水平和12-HETE积累检测采用ELISA法分别检测肝脏血清中白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNFα)三项炎性因子水平和12-HETE积累。检测均按照试剂盒检测方法进行,试剂盒均购自南京建成科技有限公司。
1.4 采用蛋白质印迹法(Western blotting)检测ALOX12-12-HETE-GPR31轴中基因编码蛋白表达水平匀浆器裂解组织,置于冰上冷却30 min后,采用离心机13 000 r∕min离心10 min,取上清。上清移至96孔板中,然后采用BCA法进行蛋白浓度的测定。采用SDS变性蛋白质电泳法检测蛋白表达水平。采用9%的聚丙烯酰胺凝胶电泳分离蛋白。三明治法正确放置凝胶和PVDF,70 V电压转移3~4 h[11]。取出后,将PVDF膜浸入封闭液中,37℃平缓摇动1 h。取出后,将PVDF膜浸入杂交袋中,袋中含5 mL相应I抗,4℃平缓摇动过夜。取出后采用TBS∕T漂洗干净,然后浸入含5 mLⅡ抗的杂交袋中,37℃平缓摇动1 h。再经TBS∕T充分漂洗后,ECL化学发光及胶片曝光对比结果。
1.5 细胞凋亡率的测定采用原位细胞凋亡检测试剂盒检测细胞凋亡情况。采用4%多聚甲醛固定1 h后,使用3%过氧化氢溶液和预冷处理的蛋白酶K处理,然后于37℃湿盒dUTP标记2 h。SABC链霉亲和素-过氧化物酶结合,DAB显色。染色后,细胞核呈棕黄色的细胞被判为凋亡细胞。凋亡指数为(凋亡细胞数∕总细胞数)×100%。
1.6 肝功能指标检测清晨用真空管取空腹静脉血,分离血清,采用日立7180全自动生化分析仪检测肝功能各项指标,试剂由上海科华生物技术有限公司提供。肝功能检查指标:丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、AST∕ALT。
1.7 统计学方法本研究采用SPSS 20.0统计软件(美国IBM公司)处理;计量资料采用±s表示,组间比较采用单因素方差分析,两组比较采用LSD-t检验;计数资料采用例(%)表示,组间比较采用χ2检验;P<0.05表示差异有统计学意义。
2 结果
2.1 各组小鼠ALOX12、12-HETE和GPR31基因编码蛋白表达量比较空白对照组小鼠再灌注后1 h、3 h和6 h的ALOX12基因表达量差异无统计学意义(P>0.05)。而实验对照组,即肝脏再灌注肝缺血损伤小鼠的ALOX12基因在不同再灌注时间的表达量高于空白对照组小鼠(P<0.05),且随着灌注时间的延长而逐渐增大(P<0.05)。ALOX12基因敲除的实验组小鼠,ALOX12基因表达量再灌注后1 h、3 h和6 h降低(P<0.05),与空白对照组基因表达量差异无统计学意义(P>0.05)。见表1、图1。

图1 各组小鼠ALOX12基因表达量(蛋白质印迹法)
表1 各组小鼠不同再灌注时间ALOX12基因表达量比较/±s
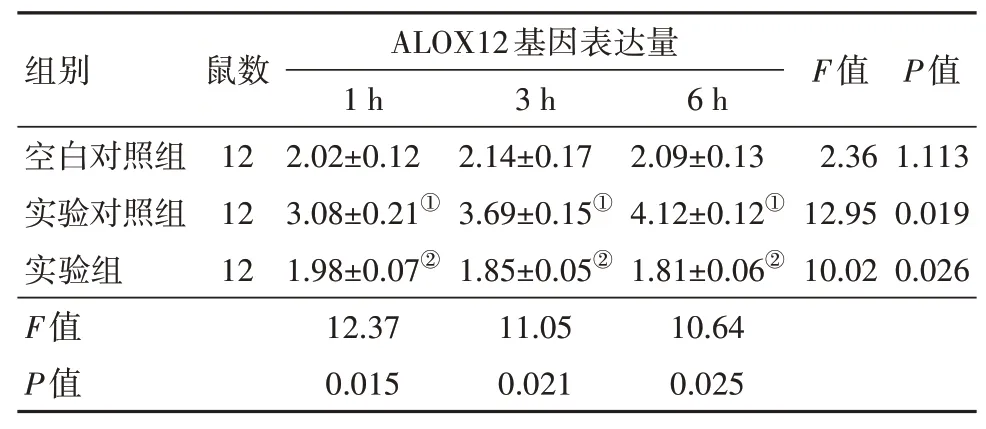
表1 各组小鼠不同再灌注时间ALOX12基因表达量比较/±s
注:①与空白对照组比较,P<0.05。②与实验对照组比较,P<0.05。
?
空白对照组小鼠再灌注后1 h、3 h和6 h的12-HETE基因表达量差异无统计学意义(P>0.05)。而实验对照组,即肝脏再灌注肝缺血损伤小鼠的12-HETE基因在不同再灌注时间的表达量高于空白对照组小鼠(P<0.05),且随着灌注时间的延长而逐渐增大(P<0.05)。ALOX12基因敲除的实验组小鼠,12-HETE基因表达量再灌注后1 h、3 h和6 h降低(P<0.05),且与空白对照组基因表达量差异无统计学意义(P>0.05)。见表2、图2。
表2 各组小鼠不同再灌注时间12-HETE基因表达量比较/±s
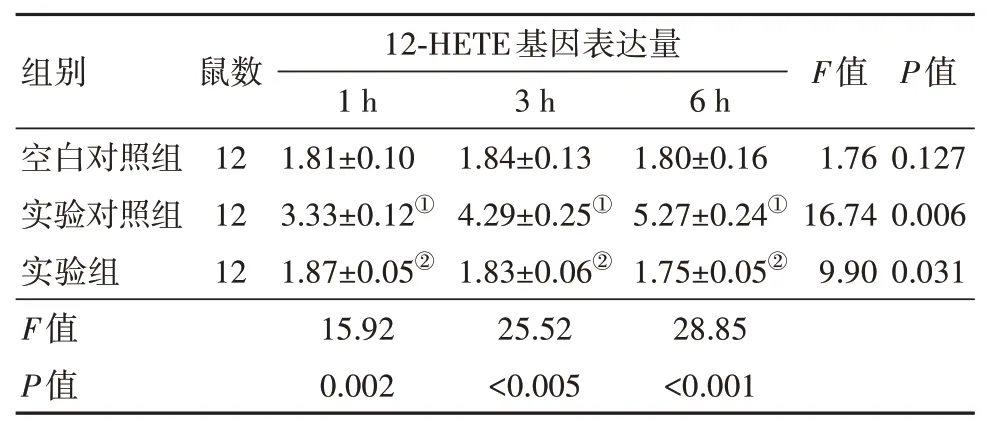
表2 各组小鼠不同再灌注时间12-HETE基因表达量比较/±s
注:①与空白对照组比较,P<0.05。②与实验对照组比较,P<0.05。
?

图2 各组小鼠12-HETE基因表达量(WB)
空白对照组小鼠再灌注后1 h、3 h和6 h的GPR31基因表达量差异无统计学意义(P>0.05)。实验对照组,即肝脏再灌注肝缺血损伤小鼠的GPR31基因在不同再灌注时间的表达量均高于空白对照组小鼠(P<0.05),且随着灌注时间的延长而逐渐增大(P<0.05)。ALOX12基因敲除的实验组小鼠,GPR31基因表达量再灌注后1 h、3 h和6 h降低(P<0.05),且与空白对照组基因表达量差异无统计学意义(P>0.05)。见表3、图3。
表3 各组小鼠不同再灌注时间GPR31基因表达量比较/±s

表3 各组小鼠不同再灌注时间GPR31基因表达量比较/±s
注:①与空白对照组比较,P<0.05。②与实验对照组比较,P<0.05。
?
2.2 各组小鼠三项炎性因子水平和12-HETE含量比较空白对照组小鼠IL-1β、IL-6和TNF-α三项炎性因子水平差异无统计学意义(P>0.05)。而实验对照组,即肝脏再灌注肝缺血损伤小鼠的IL-1β、IL-6和TNF-α三项炎性因子水平高于空白对照组小鼠(P<0.05)。ALOX12基因敲除的实验组小鼠的IL-1β、IL-6和TNF-α三项炎性因子水平降低(P<0.05),低于空白对照组,但差异无统计学意义(P>0.05)。见表4。
表4 各组小鼠肝脏细胞中白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平比较∕(ng∕L,±s)

表4 各组小鼠肝脏细胞中白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平比较∕(ng∕L,±s)
注:①与空白对照组比较,P<0.05。②与实验对照组比较,P<0.05。
?
空白对照组小鼠再灌注后1 h、3 h和6 h肝脏中12-HETE含量差异无统计学意义(P>0.05)。而实验对照组,即肝脏再灌注肝缺血损伤小鼠的肝脏中12-HETE含量高于空白对照组小鼠(P<0.05)。ALOX12基因敲除的实验组小鼠再灌注后1 h、3 h和6 h肝脏中12-HETE含量降低(P<0.05),且低于空白对照组,但差异无统计学意义(P>0.05)。见表5。
表5 各组小鼠不同再灌注时间肝脏细胞中12-HETE含量比较(∕ng∕mL,±s)

表5 各组小鼠不同再灌注时间肝脏细胞中12-HETE含量比较(∕ng∕mL,±s)
注:①与空白对照组比较,P<0.05。②与实验对照组比较,P<0.05。
?
2.3 各组小鼠肝脏组织细胞凋亡率比较空白对照组小鼠再灌注后1 h、3 h和6 h肝脏组织细胞凋亡率差异无统计学意义(P>0.05)。而实验对照组,即肝脏再灌注肝缺血损伤小鼠的肝脏中组织细胞凋亡率高于空白对照组小鼠(P<0.05)且随着再灌注时间的延长而逐渐增大(P<0.05)。ALOX12基因敲除的实验组小鼠的再灌注后1 h、3 h和6 h肝脏组织细胞凋亡率降低,高于空白对照组(P<0.05),但是两两之间差异无统计学意义(P>0.05)。见表6。
表6 各组小鼠不同再灌注时间肝脏组织细胞凋亡率比较∕(%,±s)

表6 各组小鼠不同再灌注时间肝脏组织细胞凋亡率比较∕(%,±s)
注:①与空白对照组比较,P<0.05。②与实验对照组比较,P<0.05。
?
2.4 各组小鼠肝功能指标比较实验对照组,即肝脏再灌注肝缺血损伤小鼠的ALT、AST和AST∕ALT均高于空白对照组小鼠(P<0.05)。ALOX12基因敲除的实验组小鼠的ALT、AST和AST∕ALT降低(P<0.05),高于空白对照组(P<0.05)。见表7。
表7 各组小鼠丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、AST∕ALT结果比较/±s
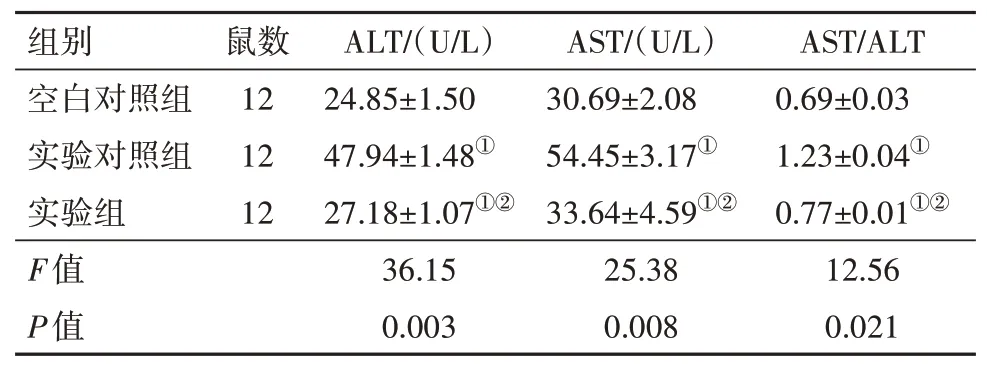
表7 各组小鼠丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、AST∕ALT结果比较/±s
注:①与空白对照组比较,P<0.05。②与实验对照组比较,P<0.05。
?
3 讨论
肝脏IR损伤是手术过程中引起肝脏损伤的重要原因,严重者可导致肝功能衰竭,极大阻碍了肝脏手术的应用和救治效果。ALOX12是脂氧合酶超家族成员之一,在有氧条件下,催化多不饱和脂肪酸底物(花生四烯酸和亚油酸等)形成HETE[12]。ALOX12基因位于染色体17p13.1,由14个外显子和13个内含子组成[13]。ALOX12基因在血小板和多种类型细胞(包括肝细胞)中高表达[14]。目前国内外对ALOX12的研究主要集中在其参与动脉粥样硬化,血栓形成及肿瘤由于其调节血小板聚集能力、细胞迁移和细胞增殖[15]。然而,在肝脏IR损伤中ALOX12的作用是未知的。GPR31是由定位在6号染色体长臂27区(6q27)的基因编码蛋白质,共含有319个氨基酸[16]。GPR31与相应受体(如12-HETE等)结合后,与G蛋白耦联后可启动细胞内第二信号分子,进而将感觉和神经内分泌等多种信号传递到细胞内[17]。
本研究发现,实验对照组即肝脏再灌注肝缺血损伤小鼠的ALOX12-12-HETE-GPR31轴中基因转录水平高于空白对照组,且随着再灌注时间的延长而逐渐增大。空白对照组和实验组小鼠,在肝血流阻断并再灌注后,随着再灌注时间延长ALOX12-12-HETE-GPR31轴中基因转录水平间差异无统计学意义,说明ALOX12基因的敲除,使得在肝脏再灌注肝缺血损伤中不能过量表达进而引起12-HETE-GPR31基因转录水平差异。另外,实验对照组小鼠肝脏中三项炎性因子(IL-1β、IL-6、TNF-α)水平、12-HETE含量、肝脏组织细胞凋亡率、ALT、AST和AST∕ALT高于空白对照组。实验组小鼠各项指标低于实验对照组,且与空白对照组差异无统计学意义。以上结果说明,ALOX12表达量的上调会促进12-HETE的积累,过量的12-HETE能够直接结合GPR31,触发炎症反应,加重肝损伤。而特异性敲除ALOX12基因,阻断12-HETE的积累能够有效抑制肝脏再灌注肝缺血损伤。这是因为,GPR31参与包括炎性反应和肿瘤在内的多种生理病理过程[17]。12-HETE是花生四烯酸(arachidonic acid,AA)的代谢产物。HETEs(5-、8-、12-、15-HETE)作为有生物活性的代谢产物,广泛影响着细胞信号的转导、细胞代谢、并在炎性反应中有重要作用[18]。
研究者发现,在缺血时,ALOX12在肝细胞中上调,促进12-HETE积累,12-HETE继而能直接结合GPR31,引发炎症反应,加剧肝损伤[19]。而在小鼠和猪的动物模型中,使用ALOX12的小分子抑制剂ML355抑制12-HETE生成,就能抑制IR诱导的肝功能障碍、炎症和细胞死亡。另外,研究者通过建立非人灵长类动物的肝脏IR模型再现了肝脏切除后的临床肝功能障碍,发现遏制12-HETE累积有效地减弱了该模型中肝IR的所有病理学特性[20]。这些研究与本研究可相互印证,据此本研究推测肝IR损伤的根本原因是在缺血阶段代谢信号网的重组,并受ALOX12-12-HETE-GPR31信号轴的调控,同时,还提供了通过抑制12-HETE来预防和治疗IR诱导的肝损伤这个极有潜力的治疗策略,有望在将来为广大需要接受肝脏手术的病人带来极大的益处。
综上所述,ALOX12-12-HETE-GPR31轴在肝脏再灌注肝缺血损伤中起着至关重要的作用,抑制其功能或阻断12-HETE的积累能够有效预防甚至治疗肝脏再灌注肝缺血损伤。
