微小RNA-195降低寡聚态β样淀粉蛋白1-42诱导大鼠肾上腺嗜铬细胞炎症反应和凋亡作用机制
2022-01-04李鑫孙茂苍崔山龙
李鑫,孙茂苍,崔山龙
阿尔茨海默病(Alzheimer disease,AD)是老年人痴呆症的最常见原因,是一种进行性神经退行性疾病,逐渐夺走病人的认知功能并最终导致死亡[1]。AD每年的新发病量逐年上升。AD神经病理学的特征在于β样淀粉蛋白(Aβ)的细胞外积累。随着疾病的进展,肉眼可见的萎缩影响新皮质的内嗅区和海马区,杏仁核和关联区域蓝斑的位置被淡化[2]。Aβ的沉积首先由漫射沉积物制成,淀粉样蛋白聚焦沉积物构成老年斑的核心[3]。在新皮质、海马、纹状体、中脑以及最后的小脑以及脑桥核(Thal相)中连续发现Aβ沉积物[4]。家族性病例表明Aβ沉积是最初的症状[5]。miRNA是短链内源性RNA,其表达异常可影响靶基因的转录和翻译进而参与人类多种疾病进展,其中包括AD[6-8]。微小RNA-195(miR-195)虽已有报道在AD中的研究,遗憾的是,其发挥作用的调控机制与ATP酶阳离子转运13A2(ATP13A2)的关系尚未有人报道。ATP13A2是遗传性青少年AD的致病基因[9],其在AD中的功能尚未有人研究。本研究在2018年3—11月开展实验,拟以Aβ1-42诱导大鼠肾上腺嗜铬细胞(PC12细胞)损伤模型为研究对象,探讨过表达miR-195、沉默ATP13A2、过表达ATP13A2对Aβ1-42诱导PC12细胞炎性因子分泌以及细胞增殖和凋亡的影响,揭示miR-195和ATP13A2的靶向关系,以期为AD治疗提供新方向。
1 材料与方法
1.1 材料PC12细胞购自美国模式培养物保藏中心;Aβ1-42购自日本和光;杜尔伯格氏伊戈尔(DMEM)培养基购自Gibco;胎牛血清购自杭州四季青;噻唑蓝(MTT)细胞增殖及细胞毒性检测试剂盒购自科联生物;二喹啉甲酸(BCA)蛋白定量试剂盒、LipofectamineTM2000、逆转录试剂盒购自大连Takara公司;双荧光素酶基因检测试剂盒、ECL发光液均购自碧云天生物技术公司;半干转膜仪购自美国BIORAD公司;PCR仪购自美国BIO-RAD公司。
1.2 方法
1.2.1细胞培养PC12细胞用DMEM培养基(含10%胎牛血清)在细胞培养箱中进行常规培养。
1.2.2细胞转染与分组将正常培养的PC12细胞标记为对照(Control)组。按照吴明等[10]的方法用25 μmol∕mL的Aβ1-42处理PC12细胞48 h,标记为Aβ组。将PC12细胞分为Aβ1-42+miR-con组、Aβ1-42+miR-195组、Aβ1-42+si-con组、Aβ1-42+ATP13A2小干扰RNA(si-ATP13A2)组、miR-con组、miR-195组、miR-195+pcDNA组、miR-195+ATP13A2过表达质粒(pcDNA-ATP13A2)组,用脂质体LipofectamineTM2000试剂盒将寡核苷酸或质粒转染至PC12细胞,转染6 h后,更换新鲜培养基培养48 h,部分组用25 μmol∕mL的Aβ1-42处理,用实时定量PCR(qRT-PCR)法检测转染效果。转染成功后,进行下一步实验。
1.2.3qRT-PCR实验检测细胞中miR-195、ATP13A2的mRNA的表达Trizol法提取细胞总RNA,并用DNaseⅠ消化以除去可能污染的DNA。逆转录合成模板链cDNA,随后制备20 μL扩增体系进行qRT-PCR,重复3次,取平均值,分析Ct值,以2-ΔΔCt法计算miR-195、ATP13A2的相对表达水平。引物信息:miR-195(正向引物ACGATGCCCACGACCAAGCC;反向引物TAGCAGCACAGAAATATTGGC);ATP13A2(正向引物5′-ATGGTGACAGGGGACAACCT-3′;反向引物5′-ACTTGAAGACGCTGAATGAAG-3′)。
1.2.4Western blotting检测细胞中ATP13A2的蛋白表达RIPA法提取蛋白后,以4∶1的比例加入蛋白上样缓冲液,混匀,沸水浴变性5 min。取60 μg蛋白进行SDS-PAGE,转移PVDF膜后,加入2.5%脱脂奶粉来阻断非特异性结合。将PVDF膜放入1∶1 000稀释一抗中4℃反应过夜,再将PVDF膜转入1∶2 000稀释的二抗中37℃反应2 h。于暗室内滴加化学发光剂显影,凝胶成像系统采集图像。以Qμantity One 4.62软件测定的目的条带和β-actin条带灰度比值表示蛋白表达。
1.2.5ELISA实验检测细胞中白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)的含量人IL-1β、TNF-α检测试剂盒用来检测细胞中IL-1β、TNF-α的含量。
1.2.6MTT实验检测细胞的增殖将1.2.2各组细胞制成调整至104个∕毫升单细胞悬液,然后接种至96孔板,每孔加MTT溶液(5 mg∕mL)20 μL,孵育4 h,终止培养,弃去上清,每孔加150 μL DMSO,振荡融解结晶,在490 nm波长下检测细胞吸光度(A)以表示细胞增殖活性。
1.2.7流式细胞术检测细胞的凋亡用500 μL的结合缓冲液悬浮1.2.2各组细胞,分别加入5 μL Annexin V-∕FITC、5 μL碘化丙啶避光反应20 min,1 h内上流式细胞仪检测。细胞凋亡率(%)以早期凋亡率和晚期凋亡率之和表示。
1.2.8双荧光素酶报告基因检测实验检测细胞中miR-195与ATP13A2的 表 达野 生 型∕突 变 型ATP13A2载体由上海吉玛公司提供。将野生型∕突变型ATP13A2载体分别与miR-195、miR-con共转染,24 h后检测荧光强度。海参荧光素酶荧光强度与萤火虫荧光素酶荧光强度的比值即反应miR-195与ATP13A2的结合力。
1.2.9统计学方法实验数据以±s表示,每组数据代表3个平行实验复孔,每个实验重复3次。采用PEMS 3.2进行分析,用Shapiro-Wilk检验分析数据正态性,用Levene检验分析方差齐性。完全随机设计的两组均数的比较采用成组设计t检验;多组均数的比较采用单因素方差分析,其中两两比较采用SNK-q法。P<0.05为差异有统计学意义。
2 结果
2.1 寡聚态Aβ1-42诱导的PC12细胞影响miR-195和ATP13A2的表达与Control组相比,Aβ1-42组PC12细胞中miR-195的表达显著降低(P<0.001),ATP13A2 mRNA和蛋白表达均显著升高(P<0.001),见表1,图1。
表1 miR-195和ATP13A2在Aβ诱导的PC12细胞中的表达∕±s

表1 miR-195和ATP13A2在Aβ诱导的PC12细胞中的表达∕±s
注:miR-195为微小RNA-195,ATP13A2为ATP酶阳离子转运13A2,Aβ为β样淀粉蛋白。
?

图1 ATP13A2在Aβ1-42诱导的PC12细胞中的表达
2.2过表达miR-195抑制寡聚态Aβ1-42诱导的PC12细胞炎性因子的分泌与Control组相比,Aβ1-42组PC12细胞中miR-195表达显著降低(t=15.79,P<0.001),IL-1β、TNF-α表达显著升高(t=15.12,P<0.001;t=21.77,P<0.001);与Aβ1-42+miR-con组相比,Aβ1-42+miR-195组PC12细胞IL-1β、TNF-α表达显著降低(t=10.88,P<0.001;t=8.22,P<0.001),miR-195表达显著升高(t=44.43,P<0.001)。见表2。
表2 miR-195过表达对Aβ诱导的PC12细胞炎性因子分泌的影响∕±s

表2 miR-195过表达对Aβ诱导的PC12细胞炎性因子分泌的影响∕±s
注:miR-195为微小RNA-195,Aβ为β样淀粉蛋白,IL-1β为白细胞介素1β,TNF-α为肿瘤坏死因子α。①与Ccontrol组比较,P<0.05。②与Aβ1-42+miR-con组比较,P<0.05。
?
2.3 过表达miR-195影响寡聚态Aβ1-42诱导的PC12细胞存活率和凋亡率与Control组相比,Aβ1-42组PC12细胞的细胞活性显著降低(t=15.70,P<0.001),细胞凋亡率显著升高(t=20.19,P<0.001);与Aβ1-42+miR-con组相比,Aβ1-42+miR-195组PC12细胞的细胞活性显著升高(t=8.41,P<0.001),细胞凋亡率显著降低(t=8.80,P<0.001)。见表3,图2。

图2 miR-195过表达对Aβ1-42诱导的PC12细胞凋亡率的影响
表3 miR-195过表达对Aβ诱导的PC12细胞存活率和凋亡率的影响∕(%,±s)

表3 miR-195过表达对Aβ诱导的PC12细胞存活率和凋亡率的影响∕(%,±s)
注:①与Control组比较,P<0.05。②与Aβ1-42+miR-con组比较,P<0.05。
?
2.4 miR-195靶向调控ATP13A2miRcode数据库预测显示miR-195与ATP13A2 3′UTR存在互补核苷酸序列,见图3A;野生型ATP13A2和miR-195共转染组细胞的相对荧光活性显著低于野生型ATP13A2和miR-NC共转染组(t=10.61,P<0.001),突变型ATP13A2和miR-195共转染组细胞的相对荧光活性与突变型ATP13A2和miR-NC共转染组比较差异无统计学意义(t=1.26,P=0.216),见表4;miR-195组细胞中ATP13A2蛋白水平(0.18±0.03)显著低于miR-NC组(0.39±0.04),t=9.78,P<0.001,anti-miR-195组细胞中ATP13A蛋白水平(0.70±0.07)显著高于anti-miR-NC组(0.42±0.03),t=13.04,P<0.001。四组比较,F=197.89,P<0.001,见图3B。

图3 miR-195靶向ATP13A2:A为miR-195与ATP13A2的3’UTR之间存在互补的核苷酸序列;B为miR-195负向调控ATP13A2的蛋白表达
表4 双荧光素酶报告实验∕±s

表4 双荧光素酶报告实验∕±s
?
2.5 沉默ATP13A2影响寡聚态Aβ1-42诱导的PC12细胞炎性因子分泌以及细胞存活和凋亡相较于Control组,Aβ1-42组PC12细胞中ATP13A2蛋白水平显著升高(t=10.64,P<0.001),IL-1β、TNF-α的含量显著升高(t=17.03,P<0.001;t=20.119,P<0.001),细胞活性显著降低(t=15.27,P<0.001),细胞凋亡率显著升高(t=21.34,P<0.001);与Aβ1-42+si-con组相比,Aβ1-42+si-ATP13A2组PC12细胞中ATP13A2蛋白表达显著降低(t=7.39,P<0.001),IL-1β、TNF-α的含量显著降低(t=11.42,P<0.001;t=10.22,P<0.001),细胞活性显著升高(t=8.07,P<0.001),细胞凋亡率显著降低(t=7.01,P<0.001)。见图4,表5。
表5 抑制ATP13A2影响寡聚态Aβ诱导的PC12细胞炎性因子的分泌、细胞存活和细胞凋亡∕±s

表5 抑制ATP13A2影响寡聚态Aβ诱导的PC12细胞炎性因子的分泌、细胞存活和细胞凋亡∕±s
注:Aβ为β样淀粉蛋白,IL-1β为白细胞介素1β,TNF-α为肿瘤坏死因子α。①与Control组比较,P<0.05。②与Aβ1-42+si-con组比较,P<0.05。
?

图4 抑制ATP13A2的寡聚态Aβ1-42诱导的PC12细胞
2.6 过表达miR-195和过表达ATP13A2对寡聚态Aβ1-42诱导的PC12细胞炎性因子的分泌和细胞凋亡的影响相较于Aβ1-42+miR-con组,Aβ1-42+miR-195组PC12细胞中ATP13A2蛋白水平显著降低(t=11.26,P<0.001),IL-1β、TNF-α的含量显著降低(t=14.66,P<0.001;t=9.676,P<0.001),细胞活性显著升高(t=9.44,P<0.001),细胞凋亡率显著降低(t=21.34,P<0.001);与Aβ1-42+miR-195+pcDNA组相比,Aβ1-42+miR-195+pcDNA-ATP13A2组PC12细胞中ATP13A2蛋白表达显著升高(t=6.43,P<0.001),IL-1β、TNF-α的含量显著升高(t=7.22,P<0.001;t=6.271,P<0.001),细胞活性显著降低(t=6.37,P<0.001),细胞凋亡率显著升高(t=7.01,P<0.001)。见表6,图5。
表6 过表达miR-195和过表达ATP13A2对寡聚态Aβ诱导的PC12细胞炎性因子的分泌、细胞存活和细胞凋亡的影响∕±s
表6 过表达miR-195和过表达ATP13A2对寡聚态Aβ诱导的PC12细胞炎性因子的分泌、细胞存活和细胞凋亡的影响∕±s
注:Aβ为β样淀粉蛋白,IL-1β为白细胞介素1β,TNF-α为肿瘤坏死因子α。①与Aβ1-42+miR-con组比较,P<0.05。②与Aβ1-42+miR-195+pcDNA组比较,P<0.05。
?
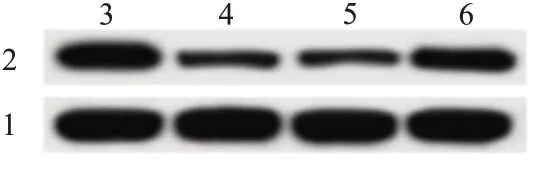
图5 过表达miR-195和过表达ATP13A2的寡聚态Aβ1-42诱导的PC12细胞中ATP13A2的表达
3 讨论
miRNA在人类的多种疾病中均具有重要作用,其中包括阿尔茨海默病。鲍晨曦等[11]发现,miR-195是精神分裂症病人中差异表达的miRNA之一,我们推测miR-195可能与精神损伤的发病具有一定的相关性。Zhu等[12]在研究中报道,miR-195可降低了β-分泌酶(BACE1)的表达水平,并且miR-195的抑制可导致BACE1蛋白水平的增加,此外,在N2a∕APP中过表达miR-195降低了Aβ的水平,而miR-195的抑制导致Aβ的增加,揭示了miR-195可通过抑制BACE1的翻译来下调Aβ的水平,提示miR-195可能为阿尔茨海默病提供治疗策略,推测miR-195在阿尔茨海默病中低表达。瞿准等[13]在创伤性脑损伤的研究中报道,miR-195的表达异常升高,抑制miR-195的表达改善脑损伤病人神经功能,这为靶向miRNA治疗临床创伤性脑损伤提供了理论依据。本研究通过qRT-PCR法检测到Aβ1-42诱导的PC12细胞损伤中miR-195表达水平明显降低,这与Zhu等[12]的研究结果相一致;此外,过表达miR-195可抑制Aβ1-42诱导的PC12细胞中IL-1β、TNF-α的表达,说明过表达miR-195对阿尔茨海默病具有抗炎的功能,除此之外,细胞存活率明显升高,细胞凋亡率明显降低,揭示过表达miR-195对阿尔茨海默病细胞具有促进增殖,抗凋亡作用,提示miR-195在阿尔茨海默病治疗中的潜在价值;深入研究发现miR-195靶向负调控ATP13A2表达,这为miR-195在阿尔茨海默病中的机制探索提供参考。
由于生物医疗技术的不断发展,越来越多的研究者报道,遗传性因素在PD的产生和发展中的重要作用。目前研究中与PD相关的较热门的基因有ATP13A2、Parkin、LRRK2、PARK16等。大量研究报道,ATP13A2在帕金森病的发生发展中具有重要作用[14-17]。但ATP13A2在阿尔茨海默病中的作用及调控机制报道鲜少。据报道,ATP13A2可作为miR-199a的靶基因参与6-OHDA诱导的PC12细胞的氧化应激过程[18]。miR-4306靶向ATP13A2参与了锰暴露引起的神经退行性变的调控[19]。本研究通过qRT-PCR法、Western blotting法检测Aβ1-42诱导的PC12细胞中ATP13A2的表达发现,ATP13A2的表达水平明显地升高,这与张百平等[18]的实验结果相一致;进一步通过ELISA法、MTT法及流式细胞术检测沉默ATP13A2的Aβ1-42诱导的PC12细胞发现,沉默ATP13A2可下调Aβ1-42诱导的PC12细胞中IL-1β、TNF-α的含量和细胞凋亡,促进增殖,揭示沉默ATP13A2具有与过表达miR-195相同的保护Aβ 1-42诱导的PC12细胞损伤的作用,这是国内外首次发现ATP13A2不仅对帕金森病的进展具有重要作用,其对阿尔茨海默病的炎症、增殖、凋亡过程均具有重要作用。深入研究发现,过表达ATP13A2可逆转miR-195对Aβ1-42诱导的PC12细胞炎性因子分泌、增殖、凋亡的影响,这说明ATP13A2不仅受miR-195的靶向调控,还可逆向反作用miR-195对Aβ1-42诱导的PC12细胞的保护作用,为miR-195在神经退行性疾病中的靶向治疗提供参考依据。
综上所述,miR-195靶向ATP13A2可抑制Aβ1-42诱导的PC12细胞的炎症反应和凋亡。miR-195和ATP13A2可能是治疗阿尔茨海默病的新靶点。
