白藜芦醇对青光眼大鼠视神经损伤的保护作用及其机制
2021-12-31焦云娟马高恩李艳华李晓鹏
贺 琳,焦云娟,马高恩,李艳华,李晓鹏
•KEYWORDS:resveratrol; glaucoma; optic nerve injury; phosphatidylinositol 3 kinase; protein kinase B
0引言
青光眼是继白内障之后的第二大致盲性眼病,以视神经乳头凹陷性萎缩和视野特征性缺损性缩小为主要表现,不仅影响患者的视力健康和生活质量,也造成了一定的社会负担[1]。多项研究表明,视网膜神经节细胞(retinal ganglion cells,RGC)凋亡和神经轴突的退变是青光眼的主要病变特点[2-4],因此减少或抑制RGC凋亡与轴突的退变成为青光眼治疗的研究热点。传统青光眼的治疗方式为手术或药物降压,但部分患者在眼压正常后仍存在继发性视神经损伤。白藜芦醇是一种非黄酮类多酚化合物,具有抗炎、抗肿瘤、抗氧化、抗细胞凋亡、神经保护等多种作用。既往研究证实,白藜芦醇可减轻青光眼视网膜的氧化应激损伤,但未具体阐述对RGC凋亡的影响及相关调控机制[5]。故此,本研究通过建立青光眼大鼠模型,分析白藜芦醇对青光眼大鼠视神经损伤的保护作用以及对凋亡相关信号通路磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)及其相关因子的影响。
1材料和方法
1.1材料
1.1.1实验动物健康无眼疾SPF级SD大鼠,8周龄,60只,雌雄各半,体质量180~220g,购自河北医科大学动物实验中心,许可证号SCXK(冀)2018-003。自由进食饮水,适应性饲养1wk。饲养环境室温23℃~25℃,湿度45%~55%,12h明/暗交替光照。本研究经实验动物伦理委员会批准(批准号:2018-085)。
1.1.2主要仪器及试剂白藜芦醇(美国Sigma公司),荧光金(美国Biotium公司),0.25%氯霉素眼液(山东省人民药业有限公司,国药准字H20063685),0.5%盐酸丙美卡因眼液(比利时爱尔康医药公司,批准文号H20090082),超纯RNA提取试剂盒、逆转录试剂盒、BCA蛋白定量分析试剂盒(广州迈博生物科技有限公司),兔抗大鼠PI3K、磷酸化(phosphorylation,p)-PI3K、Akt、p-Akt、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)多克隆抗体(北京Jackson公司);7500实时荧光定量PCR系统(美国Applied Biosystems公司),全段酶标仪(美国BioTek公司)。
1.2方法
1.2.1荧光金染料逆行标记追踪RGC取60只大鼠,0.3%戊巴比妥钠腹腔注射麻醉大鼠,固定于脑立体定位仪上,以Paxinos图谱为标准,定位器调整至零后,后移6.0mm,在两侧旁开中线1.5mm处对称点,制作大小约1mm的骨孔,撕开骨孔处硬脑膜,Bregma点为零点后移4.3、6.3mm的骨孔内,分别旁开4.4、1.4mm,于背侧膝状核和上丘内分别以玻璃微管缓慢注入3%荧光金0.5μL,注射深度分别为4.5、3.5mm,于5min内注射完毕,针头留置10min。对侧背外侧膝状核和上丘操作同上,术毕分层缝合筋膜和皮肤,大鼠分笼饲养,自由饮食、饮水,保持垫料干燥。
1.2.2青光眼大鼠模型制备60只大鼠行荧光金染料逆行标记追踪RGC 4d后以0.25%氯霉素眼液滴注右眼,1滴/次,2次/天,连续3d。荧光金染料逆行标记追踪RGC 7d后,随机取40只大鼠,采用烧灼巩膜表面静脉法均选取右眼制作青光眼模型[6]:建模当天大鼠称重,仰卧于手术台后固定,以0.3%戊巴比妥钠腹腔注射,并以0.5%盐酸丙美卡因眼液滴注术眼3次,常规消毒铺巾,暴露右眼。在眼科显微镜下,距角巩膜缘12∶00方向剪开上方球结膜,约1mm,钝性分离球结膜及筋膜,暴露巩膜静脉,分离3支上巩膜静脉,以手术烧灼器轻轻烙闭,以近角膜端血管扩张充盈,远角膜端血管血流消失为宜。后整复术眼球结膜及筋膜,涂抹金霉素软膏,术后第2d以0.25%氯霉素眼液滴眼,1滴/次,2次/天,连续7d。左眼不做处理。余20只大鼠除未烧灼上巩膜静脉外,其余步骤相同。
1.2.3分组及干预取建模成功(烧灼巩膜表面静脉术后7d检测眼压大于21mmHg或术眼眼压高于非手术眼5mmHg视为建模成功)大鼠随机分为4组,每组10只,分别为模型组、低剂量组、中剂量组和高剂量组,20只未烧灼上巩膜静脉大鼠随机分为对照组(10只)和实验对照组(10只)。根据预实验结果确定白藜芦醇浓度,低、中、高剂量组分别以白藜芦醇10、20、40mg/kg腹腔注射(10mL/kg),药物注射剂量按照《实验动物与动物实验方法学》[7]人与大鼠体表面积的药物等效剂量换算,注射间隔依据白藜芦醇给药后药代动力学参数[8],1次/天,连续8d。模型组、对照组在相同时间注射等量生理盐水,实验对照组则给予白藜芦醇10mg/kg腹腔注射。
1.2.4眼压测量末次给药后2h,以毛巾包裹大鼠并固定于手术台,0.5%盐酸丙美卡因眼液滴眼表面麻醉,将眼压计笔头垂直接触大鼠右侧角膜正中,测量大鼠右侧眼压,连续测量3次,计算平均值。
1.2.5视网膜铺片与RGC计数眼压测量后,以颈椎脱臼法迅速处死大鼠,显微剪剪开大鼠球结膜,分离结膜和巩膜,断开眼外肌,取出眼球钝性分离视神经约5mm,取1/2以4%多聚甲醛固定2h,显微镜下去除眼前节,分离视网膜,将视网膜平铺于载玻片,自然干燥后以75%缓冲甘油封片,于3h内在荧光显微镜下观察。以距视乳沟2mm的上、下、左、右各4个视野各留1张照片,Image-Pro Plus图像分析系统计数被标记的RGC,计算RGC标识率,RGC标识率(%)=每只大鼠右眼RGC/左眼RGC×100%。
1.2.6视网膜组织相关mRNA相对表达量剩余视网膜保存于-80℃冰箱,用时取出以超纯RNA提取试剂盒提出总RNA,逆转录试剂盒逆转录合成cDNA。qRT-PCR法检测相关基因表达情况,配制20μL PCR反应体系,反应条件:95℃ 10min,95℃ 15s,58℃ 50s,58℃ 50s,45个循环,β-actin为内参基因,2-△△Ct法计算目的基因相对表达量。所有样本重复检测3次,取平均值。引物序列见表1。
1.2.7视网膜组织相关蛋白相对表达量取-80℃保存的视网膜组织,裂解提取蛋白,BCA蛋白质检测进行蛋白定量,35μg样本蛋白混合等体积上样,电泳后转移至PVDF膜,封闭液封闭,室温孵育2h,加入PI3K(1∶800)、Akt(1∶500)、bFGF(1∶500)、BDNF(1∶800)一抗,4℃过夜,TBST洗膜3次,每次10min,加入二抗(1∶10 000),室温孵育45min,加入底物显色,LabWorks软件分析蛋白条带灰度值,以目的条带与内参条带β-actin比值表示目的蛋白的表达水平,计算p-PI3K/PI3K、p-Akt/Akt蛋白比值及bFGF、p-BDNF蛋白相对表达量。
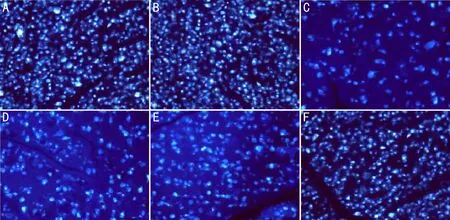
图1 荧光金逆行标记神经节细胞存活情况(×200) A:对照组;B:实验对照组;C:模型组;D:低剂量组;E:中剂量组;F:高剂量组。

表1 引物序列

2结果
2.1各组大鼠眼压比较末次给药后2h,各组大鼠眼压比较,差异有统计学意义(P<0.01);与对照组及实验对照组比较,模型组、低剂量组、中剂量组、高剂量组眼压更高(均P<0.05);与模型组比较,低剂量组、中剂量组、高剂量组眼压更低(均P<0.05);与低剂量组比较,中剂量组与高剂量组眼压更低(均P<0.05);与中剂量组比较,高剂量组眼压更低(P<0.05);对照组与实验对照组眼压比较,差异无统计学意义(P>0.05),见表2。
2.2各组大鼠RGC存活情况比较各组大鼠的RGC标识率比较,差异有统计学意义(P<0.01);与对照组及实验对照组比较,模型组、低剂量组、中剂量组、高剂量组RGC标识率更低(均P<0.05);与模型组比较,低剂量组、中剂量组、高剂量组RGC标识率更高(均P<0.05);与低剂量组比较,中剂量组、高剂量组RGC标识率更高(均P<0.05),与中低剂量组比较,高剂量组RGC标识率更高(P<0.05);对照组与实验对照组RGC标识率比较,差异无统计学意义(P>0.05),见图1,表2。
2.3各组大鼠视网膜组织相关mRNA相对表达量比较各组大鼠视网膜PI3K、Akt mRNA相对表达量比较,差异均无统计学意义(P>0.05)。各组大鼠视网膜bFGF、BDNF mRNA相对表达量比较,差异均有统计学意义(P<0.01);与对照组及实验对照组比较,模型组、低剂量组、中剂量组、高剂量组bFGF、BDNF mRNA相对表达量更低(均P<0.05);与模型组比较,低剂量组、中剂量组、高剂量组bFGF、BDNF mRNA相对表达量更高(均P<0.05);与低剂量组比较,中剂量组、高剂量组bFGF、BDNF mRNA相对表达量更高(均P<0.05);与中剂量组比较,高剂量组bFGF、BDNF mRNA相对表达量更高(均P<0.05),见表3。
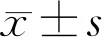
表2 各组大鼠眼压和RGC存活情况
2.4各组大鼠视网膜组织相关蛋白相对表达量比较各组大鼠视网膜p-PI3K/PI3K、p-Akt/Akt蛋白比值及bFGF、BDNF蛋白相对表达量比较,差异均有统计学意义(P<0.01);与对照组及实验对照组比较,模型组、低剂量组、中剂量组、高剂量组p-PI3K/PI3K、p-Akt/Akt蛋白比值及bFGF、BDNF蛋白相对表达量更低(均P<0.05);与模型组比较,低剂量组、中剂量组、高剂量组p-PI3K/PI3K、p-Akt/Akt蛋白比值及bFGF、BDNF蛋白相对表达量更高(均P<0.05);与低剂量组比较,中剂量组、高剂量组p-PI3K/PI3K、p-Akt/Akt蛋白比值及bFGF、BDNF蛋白相对表达量更高(均P<0.05);与中剂量组比较,高剂量组p-PI3K/PI3K、p-Akt/Akt蛋白比值及bFGF、BDNF蛋白相对表达量更高(均P<0.05),见图2,表4。
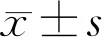
表3 各组大鼠视网膜组织相关mRNA相对表达量
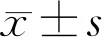
表4 各组大鼠视网膜组织相关蛋白相对表达量

图2 各组大鼠视网膜组织相关蛋白检测结果。
3讨论
眼压升高是导致青光眼的主要危险因素,可引起RGC凋亡,视功能损害,视野变窄,最终导致不可逆的视觉功能丧失[9]。目前临床对于青光眼的治疗多采用降低眼压的措施,虽可获得一定的效果,但不足以防治RGC损伤和凋亡。RGC的损伤、凋亡与氧化应激、生长因子、凋亡因子水平失衡等多种因素有关。研究证实,调节相关因子可抑制RGC凋亡,改善视神经功能[10],但尚未出现疗效确切稳定的视神经保护药物抑制RGC损伤,防止视力进一步下降。因此,寻求一种有效的RGC保护药物,对于青光眼的治疗具有重要意义。
白藜芦醇是葡萄、蓝莓、蔓越莓等植物在受刺激时产生的抗毒素,为非黄酮类多酚化合物,具有抗氧化、抗炎、抗癌、免疫调节、抗菌及保护心血管的作用。研究发现,白藜芦醇能逆转癌细胞的多重耐药,增加癌细胞对标准化疗药物的敏感性,发挥抗癌作用[11]。陈欢等[12]研究证实,白藜芦醇能减轻氧化应激造成的神经细胞凋亡,发挥神经保护作用。庞博等[13]认为,白藜芦醇可减轻丙泊酚所致大鼠神经元损伤。以上研究说明,白藜芦醇具有神经功能保护作用。本研究结果中,与模型组比较,低剂量组、中剂量组、高剂量组大鼠眼压更低,RGC标识率更高;与低剂量组比较,中剂量组与高剂量组眼压更低,RGC标识率更高;与中剂量组比较,高剂量组眼压更低,RGC标识率更高,提示白藜芦醇能降低青光眼大鼠眼压,抑制RGC凋亡,与既往研究观点一致。
细胞凋亡涉及DNA片段的断裂与蛋白的表达,此过程受细胞内信号转导通路的影响。PI3K/Akt信号通路是细胞存活的重要信号通路,对于维持细胞生长和存活、诱导细胞凋亡、促进血管新生具有重要作用[14]。PI3K为T淋巴细胞内重要的信号转导因子,能经催化底物磷酸脂酰肌醇被磷酸化激活,将活化的信号传入细胞内[15]。Akt不仅是PI3K的下游靶蛋白,还是细胞存活信号通路的枢纽酶,可传递生长因子等细胞外刺激信号,在细胞受到外界因子刺激时,Akt被磷酸化激活后进入细胞核,通过多种途径磷酸化其下游蛋白,发挥抗凋亡作用[16]。磷酸化的Akt能激活下游Fas死亡受体通路,将细胞外死亡信号传递至细胞内,启动细胞凋亡程序[17]。赖文芳等[18]研究证实,通过提高PI3K、Akt蛋白的表达可减轻脑卒中大鼠神经细胞凋亡。bFGF、BDNF是神经营养因子,能促进神经细胞与其轴突的生长,增加突触的可塑性和神经发生,通过增加视网膜内bFGF、BDNF水平,提高RGC存活率[19-20]。研究证实,提高大鼠海马CA1区BDNF和bFGF的蛋白表达水平能促进神经元的恢复[21]。本研究结果中,与模型组比较,低剂量组、中剂量组、高剂量组视网膜p-PI3K/PI3K、p-Akt/Akt蛋白比值及bFGF、BDNF蛋白相对表达量更高;与低剂量组比较,中剂量组与高剂量组视网膜p-PI3K/PI3K、p-Akt/Akt蛋白比值及bFGF、BDNF蛋白相对表达量更高;与中剂量组比较,高剂量组视网膜p-PI3K/PI3K、p-Akt/Akt蛋白比值及bFGF、BDNF蛋白相对表达量更高。以上分析与结果说明,白藜芦醇能降低青光眼大鼠眼内压,抑制RGC凋亡,其机制可能与上调PI3K、Akt蛋白磷酸化与bFGF、BDNF基因及蛋白的表达有关。
综上所述,白藜芦醇能抑制青光眼大鼠RGC的凋亡,减轻视神经损伤,其机制可能与上调PI3K/Akt信号通路中相关蛋白的磷酸化及视神经保护作用因子基因与蛋白的表达有关。在今后青光眼治疗相关药物研发中,可将白藜芦醇纳入选择标准。
