阿昔洛韦对体外培养人眼Tenon囊成纤维细胞增殖迁移的影响
2021-12-31吴靖怡吴志航李淑婷
吴靖怡,吴志航,李淑婷,刘 瑶
•KEYWORDS:acyclovir; HTFs; cell proliferation; migration; apoptosis
0引言
青光眼是全球公认的视力丧失和失明主要原因之一。青光眼的主要治疗方法是通过局部应用降眼压药物、激光治疗或手术降低眼压。青光眼的手术方法多种多样。但是,小梁切除术是公认的青光眼的一线外科手术方法[1]。小梁切除术的远期成功率较低的主要原因是术后滤过泡瘢痕的形成阻碍房水外引流[2-3]。目前术中使用抗代谢药物如5-氟尿嘧啶(5-FU)和丝裂霉素-C(MMC)能够部分减轻术后滤过泡的瘢痕愈合[4]。但是,5-FU和MMC的使用增加了滤过泡形成不良、滤过过畅、角膜缘干细胞功能的衰竭以及眼内炎等药物相关并发症的发生率[4-5]。多种抗病毒药物已被报道通过不同机制直接参与细胞抑制和细胞毒性活动[6-7]。阿昔洛韦(ACV)是临床常用抗病毒药物,但是目前阿昔洛韦对人眼Tenon囊成纤维细胞(HTFs)的作用尚无相关研究。本研究应用ACV作用于体外培养HTFs,旨在探索ACV对成纤维细胞增殖和迁移影响,为减少青光眼术后滤过泡瘢痕化,提高青光眼滤过术的成功率提供新的思路。
1材料和方法
1.1材料本研究经苏州大学附属第三医院伦理委员会审查通过并获得患者及其家属的知情同意。取玻璃体切除手术患者的Tenon囊组织,剪碎,加入0.25%胶原酶Ⅳ(美国Gibco公司),孵育2h;离心,加入胰蛋白酶(美国Gibco公司),孵育30min;200目滤网过滤,离心,加入培养基[含20%胎牛血清(美国Gibco公司),含1%双抗(美国Gibco公司)的DMEM-F12(美国Gibco公司)];待细胞生长至培养皿80%时即可传代。传代后使用含10%胎牛血清,1%双抗的DMEM-F12的培养基进行培养。取第3代细胞使用免疫荧光法进行细胞鉴定(免疫荧光显微镜及照相系统,德国Leica),免疫荧光一抗采用1∶300小鼠抗人单克隆抗体波形蛋白(美国Genetex),二抗采用1∶500山羊抗小鼠单克隆抗体(IgG)(美国Proteintech)。取3至5代细胞进行实验。
1.2方法
1.2.1 CCK8检测收集HTFs制成细胞悬液,接种于96孔板中;细胞贴壁后换无血清DMEM-F12培养24h;随机分为ACV处理组,空白组以及标准组;ACV处理组加入ACV终浓度分别为0.45、1.125、2.25、3.375、4.5mmol/L的无血清培养基,空白组加入无血清培养基培养,标准组为无成纤维细胞孔加入无血清DMEM-F12培养基,培养72h;加入CCK8试剂,孵育4h;酶标仪(美国宝特公司)测定490nm处的吸光度(A490)。计算出不同浓度阿昔洛韦对HTFs的抑制率,抑制率=(实验组A490值-标准组A490值)/(对照组A490值-标准组A490值)×100%。
1.2.2划痕实验收集HTFs制成细胞悬液,接种于6孔板中,待细胞长至90%时,换无血清培养基培养24h;100μL枪尖划痕;随机分为ACV处理组和空白组。ACV处理组加入ACV终浓度分别为2.25、4.5mmol/L的无血清培养基,空白组加入无血清培养基培养。0、72h取样,拍照(相差显微镜,日本Olympus公司)。采用Image-J软件计算细胞划痕距。计算细胞迁移率,细胞迁移率(%)=(T0h宽度-T72h宽度)/T0h宽度×100%。
1.2.3流式细胞仪检测收集4.5mmol/L ACV处理24h后HTFs和空白组细胞制成细胞悬液,分成两部分,一部分加入YF488-Annexin V和PI工作液(Annexin V-FITC细胞凋亡检测试剂盒, 美国EVERBRIGHT),避光孵育15min,测定细胞凋亡(流式细胞仪,美国BD),计算细胞凋亡率。另一部分细胞加入预冷75%乙醇,置于-4℃固定过夜。后加入碘化丙啶染色液(细胞周期检测试剂盒,美国EVERBRIGHT),避光孵育15min,测定细胞周期(流式细胞仪,美国BD)。
统计学分析:采用Graphpad Prism 8统计学软件进行统计学分析,连续变量采用均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2结果
2.1细胞免疫荧光鉴定酶消化法取原代HTFs,培养4~5d可见细胞贴壁,胞体呈梭型或不规则三角形,中央有卵圆形核,生长良好,符合HTFs形态;采用免疫荧光进行细胞鉴定培养的细胞为HTFs,免疫荧光显微镜下可见培养的细胞胞质中波形蛋白表达呈阳性,胞质内呈绿色染色,见图1。
2.2 ACV对HTFs增殖的影响CCK8检测显示,不同浓度ACV作用于HTFs的A490值,差异有统计学意义(F=54.8,P<0.0001)。与空白组对比,ACV浓度为0.45mmol/L时,差异无统计学意义(t=0.4604,P=0.6551);当ACV浓度为1.125、2.25、3.375、4.5mmol/L时,差异有统计学意义(t=3.946,P=0.0027;t=4.660,P=0.0009;t=8.057,P<0.0001;t=12.95,P<0.0001),见表1。ACV浓度为1.125mmol/L与2.25、3.375、4.5mmol/L组间差异有统计学意义(P=0.004、=0.005、<0.0001、<0.0001)。结果显示当ACV浓度达到1.125mmol/L时,开始对HTFs有抑制作用,并呈浓度依赖性。
2.3 ACV对HTFs迁移活性的影响划痕实验结果显示,不同浓度ACV作用于HTFs的细胞迁移率,差异有统计学意义(F=15.23,P=0.0074),见表1。2.25、4.5mmol/L ACV组细胞迁移率与空白组比较差异有统计学意义(t=2.303,P=0.005;t=5.019,P=0.0074)。ACV浓度为2.25mmol/L与4.5mmol/L组间差异有统计学意义(t=3.495,P=0.025),见图2、3。结果显示ACV对HTFs的迁移活性有抑制作用,并且随着ACV浓度的增加,抑制作用增强。
2.4 ACV对HTFs凋亡和细胞周期的影响经流式细胞仪检测,空白组细胞凋亡率(2.29%±0.24%)与4.5mmol/L ACV处理组(7.35%±0.64%)比较差异有统计学意义(t=10.33,P=0.0005),见图4。结果显示4.5mmol/L ACV作用HTFs 24h后,HTFs细胞凋亡增加。经流式细胞仪检测,空白组(G0/G1期59.97%±2.13%;S期23.64%±1.89%)与ACV处理组(G0/G1期74.8%±1.27%;S期8.77%±0.93%)比较差异有统计学意义(t=8.434,P=0.0011;t=9.953,P=0.0006),见图5。结果显示4.5mmol/L ACV作用HTFs 24h后,G0/G1期峰值升高,S期峰值下降,HTFs细胞周期阻滞于G0/G1期。
3讨论
滤过泡瘢痕的生成主要由HTFs的异常增殖、以及其向肌成纤维细胞的转化,分泌胶原和促纤维化因子的能力增强及细胞外基质的合成增多等引起[8]。目前术中使用抗代谢物减轻术后滤过泡的瘢痕的生成。但是,抗代谢物的使用增加了药物相关并发症的发生率[4-5]。因此,发现更安全有效的瘢痕抑制剂对提高青光眼滤过手术的远期成功率有深刻意义。
目前,多项研究发现抗病毒药物可通过抑制细胞增生和促进其凋亡参与细胞抑制。如西多福韦可以促进未感染病毒的间皮瘤细胞内促凋亡蛋白p53、caspase-3等的升高,生存蛋白Bcl-x的降低[9];利巴韦林可通过减少eIF4E靶点的mRNA输出和蛋白表达从而抑制乳腺癌细胞的增殖[10]。已有研究证实抗病毒药物IFNγ对HTFs的增殖具有明显的抑制作用。IFNα-2b能够通过减少HTFs中TGF-β1、TGF-β2的表达,从而减少Ⅰ型胶原蛋白及纤维连接蛋白的表达,参与抑制HTFs的增殖[11-12]。ACV是一种合成鸟苷类似物,作为传统抗病毒药物,阿昔洛韦滴眼液在眼科局部应用有长期临床经验,安全性高,耐受性良好[13-14]。Benedetti等[15]发现ACV可以抑制白血病细胞的活性并诱导其凋亡,并且用ACV预处理白血病细胞,可以增强细胞对5-FU的敏感性。但目前ACV对HTFs的作用尚无相关研究。
ACV微溶于水,在水中的溶解性为3.3~5.7mmol/L,随着温度的改变而改变[16-17]。本实验中观察到,当ACV浓度高于4.5mmol/L时,溶液有沉淀析出。因此,本实验采用ACV最大浓度为4.5mmol/L。首先,本实验通过CCK8证实ACV抑制HTFs增殖。选择不同浓度ACV作用于HTFs,CCK8检测结果显示ACV对HTFs有抑制作用,并且随着ACV浓度的增长,对HTFs的抑制作用逐渐增强。在后续的细胞凋亡和细胞周期检测中,采用本实验中ACV的最高药物浓度4.5mmol/L。流式细胞仪检测结果显示,ACV处理后,HTFs细胞周期G0/G1期的峰值增高,S期下降,细胞周期阻滞于G0/G1期,并且细胞凋亡率明显升高。提示ACV可能通过阻滞细胞周期,抑制HTFs的增殖,促进细胞凋亡。划痕实验结果显示ACV对HTFs向周边的迁移具有明显的抑制作用。成纤维细胞可通过迁徙、增殖、分泌胶原等生物学行为参与创面修复过程[18]。因此通过减弱成纤维细胞迁移运动,进一步减少其增殖,可以减轻瘢痕的生成。有研究发现,小鼠腹腔注射ACV后,肾脏组织的VEGF及其受体以及成纤维细胞生长因子(FGF)表达水平降低[19]。提示ACV可以抑制VEGF及其受体的生成。VEGF被认为是血管内皮细胞生长最常见的刺激因子[20]。有研究发现VEGF及其受体在HTFs中呈高表达,VEGF可直接促进HTFs的增生和迁移[21]。Park等[22]研究表明,VEGF诱导TGF-β1蛋白的产生,并且呈剂量依赖性。TGF-β被认为是青光眼滤过术后瘢痕形成的关键因子。由此推测ACV可能通过抑制VEGF从而降低TGF-β1的水平,进而抑制HTFs的增殖,诱导其凋亡,与干扰素类似。
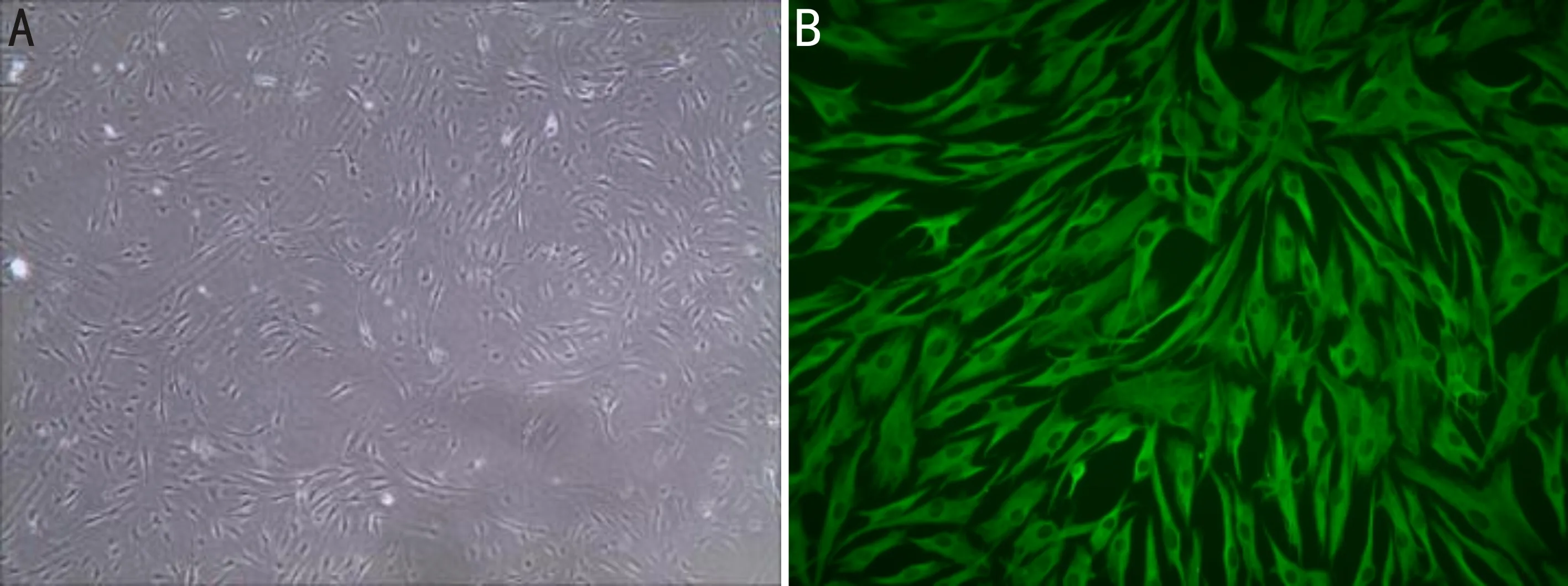
图1 细胞免疫荧光鉴定结果 A:原代人Tenon囊成纤维细胞(×40);B:HTFs免疫荧光鉴定(×400)。

图2 不同浓度ACV作用抑制HTFs的细胞迁移(×400)。
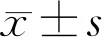
表1 不同浓度阿昔洛韦作用后对HTFs的抑制作用和迁移活性的影响

图3 不同浓度ACV作用72h对HTFs迁移率的影响。

图4 4.5mmol/L ACV诱导HTFs凋亡结果 A:空白对照组;B:4.5mmol/L ACV处理组。

图5 4.5mmol/L ACV阻滞HTFs细胞周期结果 A:空白对照组;B:4.5mmol/L ACV处理组。
综上所述,通过本实验可以得出如下初步结论:ACV可以通过诱导HTFs细胞周期阻滞,抑制HTFs的增殖,从而诱导其凋亡,并且能通过削弱HTFs的迁移能力抑制HTFs向周边侵袭和转移。这一研究结果有望应用于青光眼术后抑制滤过泡瘢痕化,为提高青光眼滤过术长期成功率提供新思路。本实验未进一步深入探讨ACV阻滞细胞周期的作用机制,其确切的信号通路有待进一步研究。并且ACV能否提高5-FU对于青光眼术后成纤维细胞的敏感性,有望在后续实验中进一步深入探讨。
