喙尾琵琶甲乙醇提取物对环磷酰胺致小鼠卵巢早衰的保护作用
2021-12-30王钦 司华新 伏蓉 孔彩华 刘克娜 隋世燕
王钦 司华新 伏蓉 孔彩华 刘克娜 隋世燕



【摘要】目的 研究喙尾琵琶甲乙醇提取物(BRFAE)对环磷酰胺诱导的卵巢早衰小鼠的保护作用,初步探索沉默信息调节因子1 /肿瘤相关蛋白53 (SIRT1/p53)信号通路在此过程中的作用。方法 将40只无特定病原体级雌性KM小鼠随机分为对照组、模型组和BRFAE低剂量和高剂量组。模型组和BRFAE低、高剂量组予腹腔注射环磷酰胺160 mg/kg,对照组则注射等体积的生理盐水,次日对照组和模型组予生理盐水灌胃,BRFAE低、高剂量组分别予BRFAE 100、200 mg/kg灌胃,连续14 d。干预结束后采集小鼠血液检测小鼠血浆丙二醛、一氧化氮和超氧化物歧化酶(SOD)水平,摘取卵巢稱重并制作HE切片进行卵泡计数,同时检测卵巢组织中SIRT1和p53 mRNA及蛋白表达。结果 低、高剂量的BRFAE均能改善环磷酰胺导致的卵巢增重和卵巢指数降低(P均<0.01),增加原始、初级卵泡和各级卵泡总数并减少闭锁卵泡的数量(P均< 0.05),其卵巢体积增大、黄体纤维化和血管减少,一氧化氮和丙二醛的水平降低,SOD活力升高(P均< 0.01),且高剂量BRFAE各项指标改善效果比低剂量BRFAE更为明显(P均<0.05)。免疫组织化学染色显示,与对照组相比,模型组SIRT1蛋白表达减弱(P < 0.01),而p53蛋白表达增强(P < 0.01),经BRFAE治疗后SIRT1蛋白表达增强(P < 0.01),而p53蛋白表达减弱(P < 0.01)。SIRT1和p53的qPCR检测结果与免疫组织化学染色结果基本一致。结论 BRFAE能够通过抗氧化作用抑制环磷酰胺所致的小鼠卵巢早衰,SIRT1/p53信号通路可能参与了其抗卵巢早衰作用。
【关键词】喙尾琵琶甲乙醇提取物;SIRT1/p53通路;KM小鼠;卵巢早衰
Protective effect of Blaps Rynchopetera Fairmaire alcohol extract on cyclophosphamide-induced premature ovarian failure in mice Wang Qin, Si Huaxin, Fu Rong, Kong Caihua, Liu Kena, Sui Shiyan. School of Public Health, Dali University, Dali 671000, China
Corresponding author, Sui Shiyan, E-mail: sysui569@163.com
【Abstract】Objective To evaluate the effect of Blaps Rynchopetera Fairmaire alcohol extract (BRFAE) on cyclophosphamide (CP)-induced premature ovarian failure in mouse models and investigate the role of SIRT1/p53 signaling pathway in this process. Methods Forty SPF female KM mice were randomly divided into the control, model, low- and high-dose BRFAE groups. Mice in the model, low- and high-dose BRFAE groups were given with CP at a dose of 160 mg/kg, and those in the control group were given with normal saline. On the next day, mice in the control and model groups were intragastrically administered with normal saline, and those in the low- and high-dose BRFAE groups were intragastrically administered with BRFAE (100 mg/kg and 200 mg/kg) for 14 consecutive d. After intragastric administration, mouse plasma samples were taken to detect the levels of malondialdehyde (MDA), nitric oxide (NO) and superoxide dismutase (SOD). The ovarian tissues were collected, weighed and prepared for HE staining. The quantity of follicles was counted. The expression levels of SIRT1 and p53 mRNA and proteins in the ovarian tissues were also determined. Results Administration of low- and high-dose BRFAE significantly improved the CP-induced increase in ovarian weight and the reduction of ovarian index (all P < 0.01), significantly increased the total quantity of primitive, primary and all stages of follicles, and significantly reduced the quantity of atretic follicles (all P < 0.05). In both low- and high-dose BRFAE groups, the ovarian volume was significantly increased, the corpus luteum fibrosis and blood vessels were significantly decreased, the NO and MDA levels were significantly declined, and the activity of SOD enzyme was significantly elevated (all P < 0.001). The improvement effect of high-dose BRFAE was more pronounced compared with that of low-dose BRFAE (all P <
0.05). The results of immunohistochemistry showed that compared with the control group, the expression level of SIRT1 protein in the model group was significantly down-regulated (P < 0.01), whereas that of p53 protein was significantly up-regulated (P < 0.01). After BRFAE treatment, the expression level of SIRT1 was significantly up-regulated (P < 0.01), whereas that of p53 was significantly down-regulated (P < 0.01). The expression levels of SIRT1 and p53 mRNA detected by q-PCR were basically consistent with the results of immunohistochemistry. Conclusion BRFAE inhibits CP-induced premature ovarian failure in mice through its antioxidant effect, and the SIRT1/p53 signaling pathway may be involved in its anti-premature ovarian failure effect.
【Key words】Blaps Rynchopetera Fairmaire alcohol extract; SIRT1/p53 signaling pathway;
KM mouse; Premature ovarian failure
卵巢早衰指婦女40岁之前由于某些原因引起的卵巢功能衰竭,其表现有闭经、不育、雌激素缺乏,以及促性腺激素水平升高[1]。据统计,近几年来卵巢早衰的发病率在1%~3%[2]。无论哪种原因导致的卵巢早衰,在前期均会产生颗粒细胞的凋亡[3]。氧化应激即抗氧化系统的平衡被破坏[4]。女性衰老、肥胖等因素可引起女性卵巢氧化应激,进而诱导其卵巢颗粒细胞的凋亡,导致卵巢早
衰[5-7]。因此,寻找一种能够减轻人卵巢氧化应激引起的颗粒细胞凋亡进而抑制卵巢早衰的抗氧化物质对改善卵巢功能有重要意义。喙尾琵琶甲(BRF)是一种携带臭味的昆虫,大多分布在云南滇中、滇东高原,俗称打屁虫,其活性成分含量颇丰,药用价值较高[8]。肖怀[9]研究发现BRF具有显著的抗氧化活性成分。前期研究发现BRF流浸膏能够改善亚硝酸盐所致雄性小鼠生殖损伤,保护机制与抗氧化密切相关,但是其分子机制还不清楚,笔者尚未见报道BRF与卵巢早衰相关的机制研究。沉默信息调节因子1(SIRT1)是一种组蛋白去乙酰化酶[10]。SIRT1可以通过使肿瘤相关蛋白53 (p53)去乙酰化,降低其表达进而抑制细胞衰老反应[11]。但是,BRFAE是否通过影响SIRT1/p53通路抑制小鼠卵巢早衰有待进一步研究。为此,本研究探讨BRF乙醇提取物(BRFAE)对环磷酰胺诱导的卵巢早衰小鼠的保护作用,并观察SIRT1/p53信号通路在此过程中的作用,现报告如下。
材料与方法
一、实验动物
SPF级雌性KM小鼠,6周龄,体质量22~25 g,根据预实验结果确定样本量为40只,购自湖南斯莱克景达实验动物有限公司[小鼠生产许可证号:SCXK(湘)2019-004,大理大学实验动物使用许可证号:SYXK(滇)2018-0002]。实验动物处死和组织取样按照《实验动物福利伦理审查指南GB/T 35892-2018》进行。
二、试 剂
BRFAE由成年BRF鲜虫或干虫(批号202102 21-7)粉碎后加95%的乙醇冷浸提取4次后去脂,-20℃冷冻备用。环磷酰胺购自江苏恒瑞医药,丙二醛、一氧化氮、超氧化物歧化酶(SOD)、BCA蛋白浓度测定试剂盒和一抗稀释液购自碧云天生物,SIRT1和p53兔多抗(稀释比例均为1∶50)及兔二抗(稀释比例均为1∶500)购自美国Bioworld Technology,TRIzol试剂购自美国Life Technologies,实时定量PCR(q-PCR)试剂盒购自上海普洛麦格生物,含SYBR Green DNA聚合酶的PCR试剂盒购自北京天根生化科技,10%水合氯醛麻醉剂和10%中性甲醛固定液购自北京雷根生物技术,肝素钠购自北京索莱宝。引物由苏州金唯智生物公司合成。
三、方 法
1.造模及给药
小鼠适应性饲养1周后,随机分为4组:对照组、模型组、BRFAE低剂量和BRFAE高剂量组(治疗组),每组各10只。实验开始时,模型组和BRFAE组予腹腔注射环磷酰胺160 mg/kg,对照组则注射等体积的生理盐水。第2日对照组和模型组小鼠予生理盐水灌胃,治疗组予BRFAE灌胃,低、高剂量分别为100 mg/kg和200 mg/kg[12]。连续灌胃14 d,每日记录小鼠日常行为(包括毛发、情绪、进食、饮水、二便及应激等)。
2. 血清氧化、抗氧化指标检测
实验结束后,小鼠禁食24 h,腹腔注射水合氯醛麻醉后眼球采血(肝素钠抗凝),1000×g离心10 min,吸取上清,根据试剂盒说明书测定血清中SOD、一氧化氮和丙二醛的水平。
3. 卵泡计数和免疫组织化学染色(IHC)
颈部脱臼处死小鼠后,摘取小鼠双侧卵巢用于计算卵巢指数(双侧卵巢质量/体质量,mg/g),每组选取5个卵巢进行固定,每个卵巢制作成5个层面,HE染色后双人盲法阅片,分别计数原始卵泡、初级卵泡、次级卵泡、窦卵泡和成熟卵泡的数目,最后计数各级卵泡的总数和闭锁卵泡数;其余卵巢组织置于-80℃冰箱冻存备用。使用SIRT1和p53抗体进行IHC染色,显微镜下观察并统计阳性结果(特定区域内的棕黄色被视为阳性)。按说明书应用Image-Pro Plus 6.0计算阳性组织的校正累积光密度值,并以此为蛋白相对表达量[13]。
4. q-PCR
使用TRIzol试剂提取卵巢组织的总RNA,并用2 μg 总RNA进行了逆转录。PCR反应体系:2.5 µL cDNA,1.5 µL目的RNA或内参RNA上下游引物,8 µL RNase-free ddH2O,0.5 µL 50倍稀释的ROX 参比染料,12.5 µL含SYBR Green的DNA聚合酶,共25 µL。PCR反应条件为:95 ℃预变性15 min;95 ℃变性10 s,60 ℃退火和延伸32 s,共40个循环[14]。使用2-ΔΔCt法分析PCR结果[15]。SIRT1引物序列为上游5’-CCAGACCTCCCAGACCCTCAAG-3’,下游5’-G
TGACACAGAGACGGCTGGAAC-3’,产物长度
120 bp;p53引物序列为上游5’-GGAAGCCGCCG
AAGAAGATGAG-3’,下游5’-GCTATCATTGCTCT
CCGTGTCCTC-3’,产物长度82 bp;内参GAPDH引物序列为上游5’-AGGTTGTCTCCTGCGACTTCA-
3’,下游5’-TGGTCCAGGGTTTCTTACTCC-3’,产物长度184 bp。
四、统计学处理
使用SPSS 21.0处理数据。定量资料以表示,多组比较行单因素方差分析,两两比较采用LSD-t法。P < 0.05为差异有统计学意义。
结 果
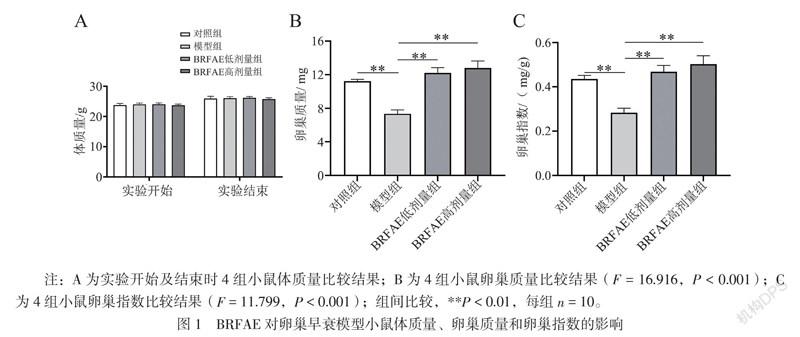
一、BRFAE对卵巢早衰模型小鼠体质量、卵巢质量和卵巢指數的影响
实验开始和实验结束时4组小鼠的体质量比较差异均无统计学意义(F值分别为0.106、0.129,P均> 0.05)。与对照组相比,模型组小鼠的卵巢质量和卵巢指数均减少(P均< 0.01);与模型组相比,2个治疗组小鼠的卵巢质量和卵巢指数均增加(P均< 0.01),且2个治疗组之间及其与对照组比较差异均无统计学意义(P均> 0.05),见图1。
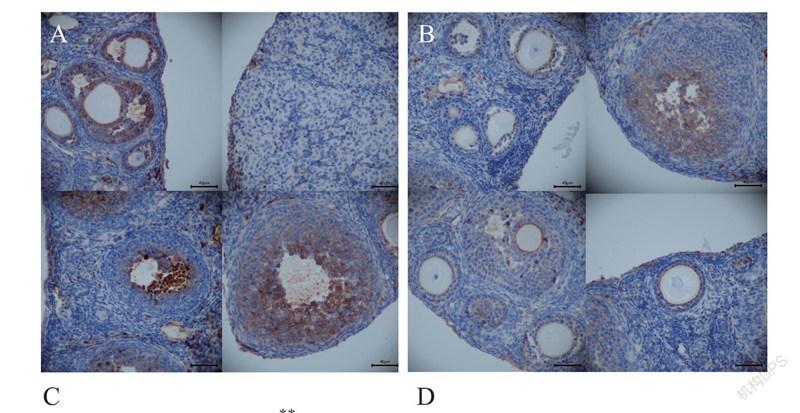
二、BRFAE对卵巢早衰模型小鼠卵巢形态改变和卵泡数量的影响
与对照组相比,模型组小鼠卵巢体积减小、形态不规则,且黄体纤维化严重、血管较少、各级卵泡明显较少,经低、高剂量BRFAE治疗后,小鼠卵巢均有不同程度的恢复,其原始卵泡和各级卵泡总数均有所增加(P均< 0.01),高剂量的BRFAE还能增加初级卵泡的数目(P < 0.05)。从卵巢大小而言,BRFAE高剂量组的恢复比低剂量组更为显著。模型组的原始卵泡数、初级卵泡数和各级卵泡总数均低于对照组,而闭锁卵泡数多于对照组(P < 0.01),见图2、3。
三、BRFAE对卵巢早衰模型小鼠血清脂质氧化指标和抗氧化指标的影响
与对照组相比,模型组小鼠血清中一氧化氮和丙二醛水平升高(P均< 0.01),而SOD活力降低(P < 0.01)。经低、高剂量的BRFAE治疗后,2个治疗组的一氧化氮和丙二醛水平均降低(P均<
0.01),而SOD活力升高(P均< 0.01),且高剂量组降低丙二醛的效果优于低剂量组(P < 0.01),见图4。
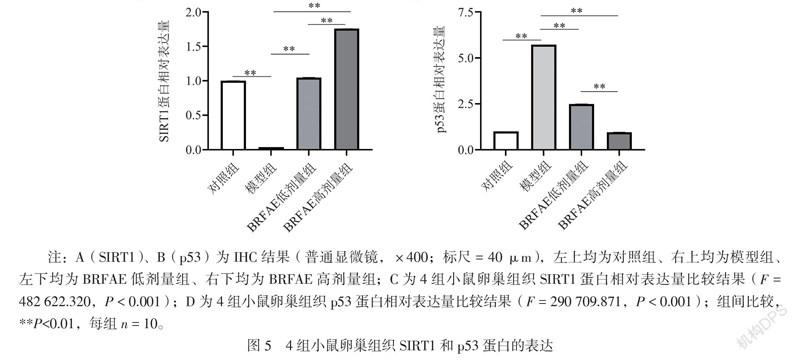
四、BRFAE对卵巢早衰模型小鼠卵巢组织SIRT1和p53蛋白表达的影响
与对照组相比,模型组小鼠卵巢SIRT1蛋白表达下调且卵巢被环磷酰胺破坏严重未见各级卵泡形态,而经BRFAE治疗后,SIRT1蛋白表达上调,并且强于模型组。与BRFAE低剂量组比较,高剂量组的SIRT1蛋白表达增强更显著。与对照组相比,模型组p53蛋白表达显著上调,而BRFAE治疗后,2个治疗组的p53蛋白表达均低于模型组,高剂量组的p53表达下调效果比低剂量组更显著(P < 0.01),且与对照组比较差异无统计学意义(P > 0.05),见图5。
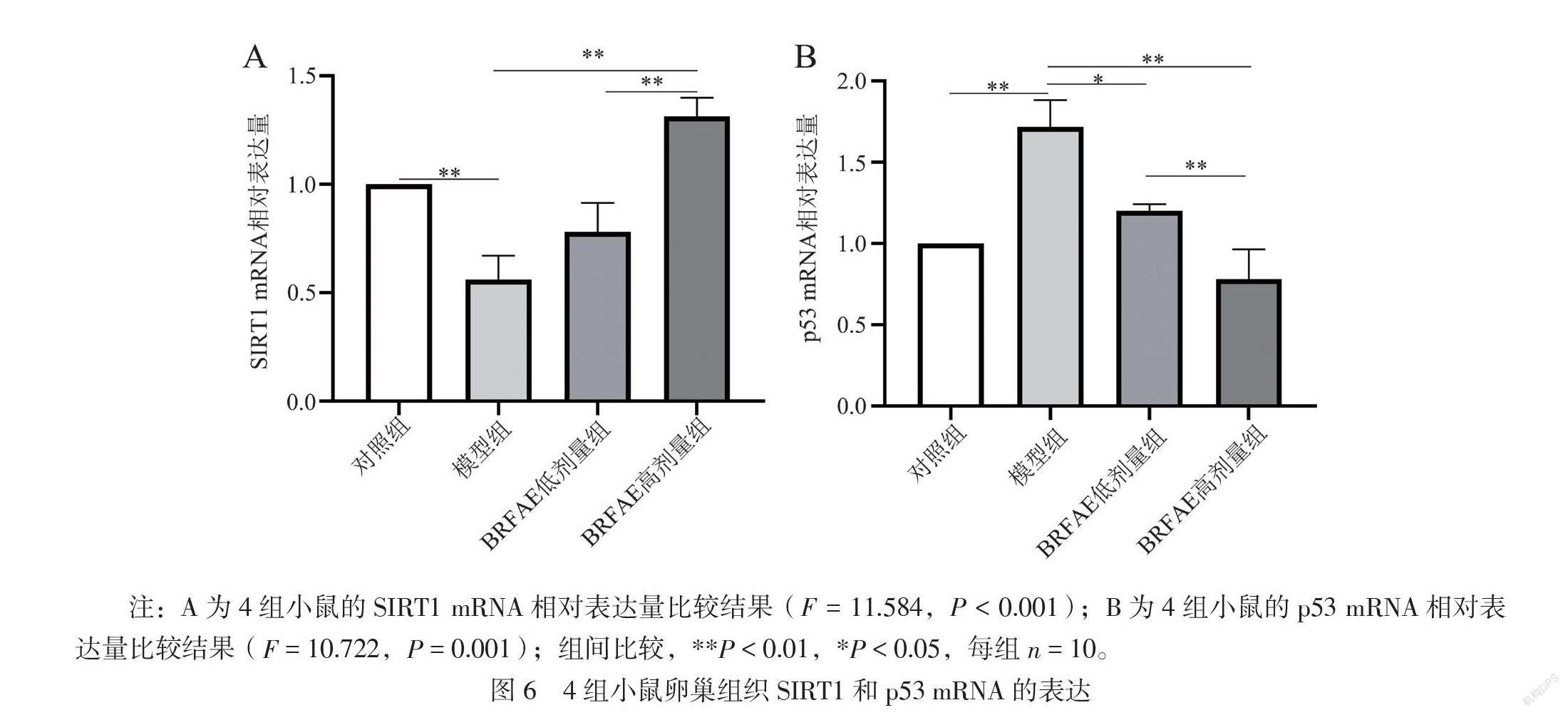
五、BRFAE对卵巢早衰模型小鼠卵巢组织SIRT1和p53 mRNA表达的影响
4组小鼠卵巢组织SIRT1和p53的mRNA表达与各自蛋白表达结果基本一致。与对照组相比,模型组SIRT1 mRNA相对表达量下调(P < 0.01),而经BRFAE治疗后,2个治疗组的SIRT1 mRNA相对表达量均高于模型组(P均< 0.01),高剂量组高于低剂量组和对照组(P均< 0.01)。与对照组相比,模型组p53 mRNA相对表达量上调(P <
0.01),而经BRFAE治疗后,2个治疗组的p53 mRNA相对表达量均低于模型组(P均< 0.01),且高剂量组低于低剂量组,2组与对照组比较差异均无统计学意义(P均> 0.05),见图6。
讨 论
由于体外细胞实验存在一些限制,如动物激素水平无法测量、动物行为状态无法观察等,因此我们建立卵巢早衰动物模型进一步探讨抗氧化物质BRFAE抵抗小鼠卵巢早衰的作用及其机制。有报道,患者在使用环磷酰胺后会出现卵巢储备功能下降相关的不良反应,部分患者甚至出现卵巢早衰,因此环磷酰胺常被用于动物卵巢早衰模型的建立 [1, 12, 16] 。本研究中,模型组与对照组相比,卵巢质量和卵巢指数降低、卵巢体积变小且形态不规则、黄体纤维化严重、血管减少、各级健康卵泡数目明显较少而闭锁卵泡数明显增加,与谷毅鹏等[17]的研究结果一致。
一氧化氮、丙二醛和SOD常用于评价机体内氧化或抗氧化应激水平[18]。本研究显示,BRFAE能降低小鼠血清中一氧化氮和丙二醛水平且可提高小鼠血清SOD活力,表明天然物质BRFAE具有显著的抵抗环磷酰胺致小鼠氧化损伤的能力。
SIRT1所介导的一些信号通路在延缓卵巢衰老方面发挥着重要作用[19]。SIRT1的下游基因p53能够促进颗粒细胞凋亡,进而诱导卵巢衰老[20]。有研究者报道,在环磷酰胺所致大鼠氧化应激的状态下,卵巢颗粒细胞凋亡增加,SIRT1的表达下调而p53的表达则上调,白藜芦醇处理后可以抑制此表现[21]。这与本研究BRFAE的治疗效果相一致,模型组SIRT1蛋白低表达而p53蛋白高表达,而经BRFAE治疗后,SIRT1蛋白表达上调而p53蛋白表达下调。mRNA结果与蛋白结果基本一致,高剂量组作用比低剂量组更为明显。
综上所述,BRFAE能够通过抗氧化作用抑制环磷酰胺所致的小鼠卵巢早衰,SIRT1/p53信号通路可能参与了其抗卵巢早衰作用。BRFAE抑制环磷酰胺所致的小鼠卵巢早衰量效关系尚需日后进一步研究明确。
参 考 文 献
[1] 谢艾岑, 廖雄宇, 何展文. 儿童重症肌无力合并卵巢早衰及粒细胞减少症一例并文献复习. 新医学, 2020, 51(12): 947-952.
[2] 郗红燕,张杨,赵小萱,冯晓玲.卵巢早衰病理机制最新研究进展.辽宁中医药大学学报,2019,21(12):103-106.
[3] 刘慧萍,曾柳庭,张国民,杨凯麟.颗粒细胞与卵母细胞自噬对卵泡发育和闭锁的调控.中华生殖与避孕杂志,2017,37(1):67-74.
[4] Weng Q, Liu Z, Li B, Liu K, Wu W, Liu H. Oxidative stress induces mouse follicular granulosa cells apoptosis via JNK/FoxO1 pathway. PLoS One, 2016, 11(12):e0167869.
[5] Liu Z Q, Shen M, Wu W J, Li B J, Weng Q N, Li M, Liu H L. Expression of PUMA in follicular granulosa cells regulated by FoxO1 activation during oxidative stress. Reprod Sci, 2015, 22(6):696-705.
[6] Tiwari M, Prasad S, Tripathi A, Pandey A N, Ali I, Singh A K, Shrivastav T G, Chaube S K. Apoptosis in mammalian oocytes: a review. Apoptosis, 2015, 20(8):1019-1025.
[7] 周咏,许丽,肖月,窦晓卫,李晶.雷帕霉素对肥胖小鼠卵巢功能的影响.南京医科大学学报(自然科学版),2020,40(9):1245-1251.
[8] 代欣桃,李文锐,闻焜,杨志斌.喙尾琵琶甲营养成分分析与评价.食品工业,2020,41(6):337-339.
[9] 肖怀. 云南彝族药用昆虫喙尾琵琶甲物质基础及抗肿瘤相关活性研究. 昆明: 云南大学, 2018: 59, 127.
[10] Du K, Fang X, Li Z. Ferulic acid suppresses interleukin-1β-induced degeneration of chondrocytes isolated from patients with osteoarthritis through the SIRT1/AMPK/PGC-1α signaling pathway. Immun Inflamm Dis, 2021, 9(3):710-720.
[11] 高亮亮,肖建如.p53基因在小鼠衰老中的调控作用研究.基因组学与应用生物学,2018,37(6):2663-2667.
[12] Huang B, Ding C, Zou Q, Wang W, Li H. Cyclophosphamide regulates N6-Methyladenosine and m6A RNA enzyme levels in human granulosa cells and in ovaries of a premature ovarian aging mouse model. Front Endocrinol (Lausanne), 2019, 10:415.
[13] 何轶然,张治芬,王芳,吴红艳,贾涔琳,魏双双,黄坚,卓广超.SIRT1、FoxO3a在DHEA诱导多囊卵巢综合征模型大鼠卵巢组织中的表达及意义.浙江医学, 2018, 40(5):429-432.
[14] Wang Q, Kong C, Liu K, Fu R, Si H, Sui S. Protective effects of small peptides from Periplaneta americana on cyclophosphamide-induced oxidative stress in rat ovaries. Indian J Pharm Edu Res, 2021, 55(3):782-792.
[15] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT Method. Methods, 2001, 25(4):402-408.
[16] Li J, Long H, Cong Y, Gao H, Lyu Q, Yu S, Kuang Y. Quercetin prevents primordial follicle loss via suppression of PI3K/Akt/Foxo3a pathway activation in cyclophosphamide-treated mice. Reprod Biol Endocrinol, 2021, 19(1):63.
[17] 谷毅鹏,张云波,刘华忠,乐小炎,陶叶杏,肖为,罗萍.乌贼墨多糖对环磷酰胺致小鼠卵巢损伤的保护作用.食品工业科技, 2014, 35(17):358-361.
[18] 隋世燕,葛亚男,徐取尉,苏晶晶.美洲大蠊提取物对大鼠血液和卵巢抗氧化指标的影响.黑龙江畜牧兽医,2017,63(7):32-35,41.
[19] 房晓欢,杜明,李飒,李俊杰,王志刚.Sirtuins对雌性动物生殖的影响研究进展.畜牧兽医学报,2019,50(12):2379-2386.
[20] Chen C, Zhou M, Ge Y, Wang X. SIRT1 and aging related signaling pathways. Mech Ageing Dev, 2020, 187:111215.
[21] Nie Z, Zhang L, Chen W, Zhang Y, Wang W, Hua R, Zhang T, Zhao C, Gong M, Wu H. The protective effects of resveratrol pretreatment in cyclophosphamide-induced rat ovarian injury: an vivo study. Gynecol Endocrinol, 2021, 37(10):914-919.
(收稿日期:2021-04-30)
(本文編辑:林燕薇)
