枸橼酸奥芬那君缓释片的制备及体外释放研究
2021-12-30邵梦侠胡华胜余泓王蓉玲熊依铭金牮江苏海洋大学药学院江苏连云港005江苏谛奇医药科技有限公司江苏徐州006
邵梦侠,胡华胜,余泓,王蓉玲,熊依铭,金牮*(.江苏海洋大学药学院,江苏 连云港 005;.江苏谛奇医药科技有限公司,江苏 徐州 006)
奥芬那君是一种中枢作用(脑干)化合物,是抗组胺药苯海拉明的同系物,具有较弱的抗组胺和局部麻醉作用[1-2],多以盐酸盐和枸橼酸盐的形式应用于临床。目前,奥芬那君枸橼酸盐主要用于缓解骨骼肌痉挛引起的疼痛,其治疗作用方式尚未明确,可能与其镇痛特性有关[3-4]。
枸橼酸奥芬那君是一种白色或近乎于白色的结晶粉末,略溶于水,微溶于乙醇。枸橼酸奥芬那君缓释片原研制剂由德国3M公司开发,规格为100 mg,商品名为Norflex。Norflex口服后,2 h达到最大血浆浓度,生物利用度约为81%,消除半衰期为14 h。
目前全球共有5个枸橼酸奥芬那君缓释片仿制产品在售,中国尚无枸橼酸奥芬那君缓释片原研进口或仿制产品上市,其在国内有很大的研究价值。此外,国内外也无关于该品缓释片的工艺研究及体外评价方面的文献报道。一般来说,药物的体外溶出情况可有效反映其在体内的吸收情况,对判断药物的体内生物利用度和生物等效性(BE)具有一定的意义。将仿制药和原研药的释放曲线进行对比,若两者在多个pH释放介质中的相似因子f2值均大于50,则表明两者相似;f2值越趋近于100,表明两者相似度越高,仿制药的BE试验成功率也会越高[5-7]。
因此,本研究使用体外释放曲线和相似因子评价法评估自制枸橼酸奥芬那君缓释片与原研缓释片体外释放行为的一致性,以期为BE试验提供数据支持。
1 仪器与试药
1.1 仪器
高效液相色谱仪,包括LC-20AD高压恒流泵和SPD-20A紫外检测器(日本岛津株氏会社);ZRS-8GD智能溶出实验仪、YD-35型片剂硬度测试仪(天津天大天发科技有限公司);Mettler XSE105型电子分析天平、FE28-Standard pH计(梅特勒-托利多仪器有限公司);FA2004电子天平(上海上平仪器有限公司);DP30A单冲压片机(北京国药龙立科技有限公司)。
1.2 试药
枸橼酸奥芬那君原料药(湖北信康医药化工有限公司,批号:20200623,含量:100.04%);原 研 药 品Norflex(德 国3M公 司,批 号:04150007288423,规格:100 mg);乙基纤维素(EC,美国亚什兰集团,N100,批号:45399;N50,批号:NPE-0041);乳糖(德国DFE化工有限公司,批号:1011BD0);硬脂酸镁(安徽山河药用辅料股份有限公司,批号:20191008);阿拉伯胶(上海泰坦科技股份有限公司,批号:P1651500);胶态二氧化硅(德固赛化学有限公司,批号:157091516);无水乙醇(上海泰坦科技股份有限公司,批号:P1702475);冰醋酸、醋酸钠、盐酸、氢氧化钠、磷酸二氢铵均为分析纯;乙腈、磷酸为色谱纯;水为纯化水。
2 方法与结果
2.1 色谱条件
色 谱 柱:InertSustainTMC18色 谱 柱(150 mm×4.6 mm,5 μm);柱温:40℃;检测波长:225 nm;流动相:乙腈-5.8 g·L-1磷酸二氢铵水溶液(磷酸调节至pH 3.0)=30∶70;流速:2.0 mL·min-1;进样量:20 μL。
2.2 释放度测定法
参考美国药典(USP)40版收录的枸橼酸奥芬那君缓释片释放度测定方法[8],分别以900 mL的pH 1.0盐酸溶液(以下简称pH 1.0)、pH 4.5醋酸盐溶液(以下简称pH 4.5)、pH 6.8磷酸盐溶液(以下简称pH 6.8)、水作为释放介质,温度为(37±0.5)℃,转速为50 r·min-1。于1、2、4、6、12 h取样5.0 mL,并立即补进5.0 mL的释放介质。取样经0.45 μm微孔滤膜滤过,HPLC法测定续滤液中枸橼酸奥芬那君的含量,计算枸橼酸奥芬那君缓释片在不同时间的平均累积释放度。
2.3 相似因子f2评价法
采用非模型依赖的相似因子f2评价自研制剂与原研制剂体外释放行为的相似性[9]。相似因子f2的计算公式如下:
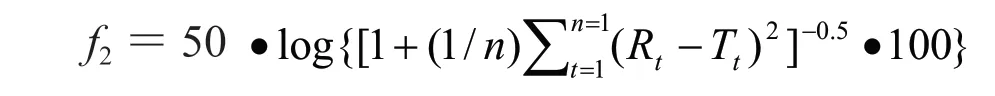
式中:n为取样时间点个数,Rt为原研制剂在t时刻的释放度值,Tt为自研制剂在t时刻的释放度值,若f2大于50,则两制剂体外溶出相似,若f2小于50,则两制剂体外溶出不相似。自研或原研制剂的药物累积释放度在85%以上的取样点不多于1个。
2.4 枸橼酸奥芬那君缓释片制备
2.4.1 制备方法 称取处方量的原料药、乳糖、EC、阿拉伯胶、硬脂酸镁,备用;将EC和无水乙醇按照1∶3.5的比例混合制备黏合剂,备用;将原料药、乳糖、阿拉伯胶过40目筛,加入黏合剂制湿粒;于60℃条件下干燥3 h,20目筛整粒;加入硬脂酸镁作为润滑剂,混合均匀;压片,即得。本品每片约含主药枸橼酸奥芬那君100 mg,片重约为300 mg。
2.4.2 处方筛选 基于与原研处方辅料组成保持一致的原理,通过预试验对填充剂、黏合剂等进行初步考察,确定了处方1(溶出行为与原研制剂一致,可保持12 h内片剂外观完整不崩散),处方组成见表1。
2.4.3 EC用量考察 缓释材料的用量是决定药物释放速度的重要因素,故以处方1为基础,以相似因子及溶出行为为评价指标,进一步考察EC的用量。选用 EC N100作为缓释骨架材料,制备4个处方(见表1,处方1~处方4),考察其他组分不变时,EC不同用量对药物释放的影响。按“2.2”项下方法测定释放度,释放介质为水,并计算自研制剂与Norflex释放行为的相似因子f2。结果见表2。
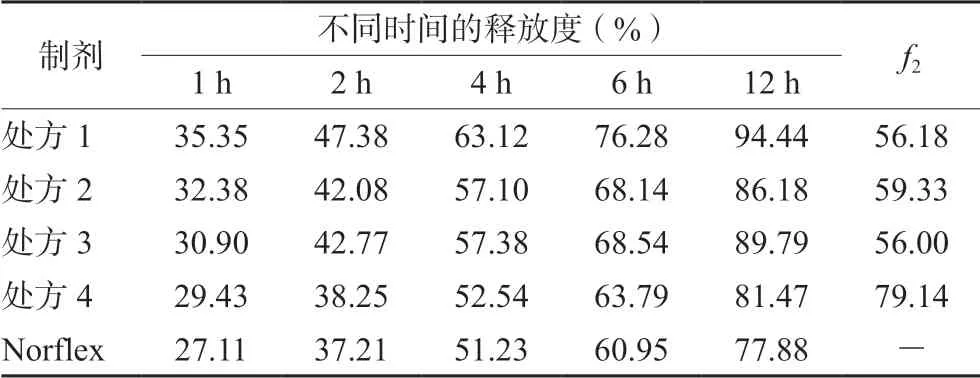
表2 不同处方在水中的释放度(n=6) Tab 2 Release of different prescriptions in water (n=6)
结果显示,处方4的f2值最大,为79.14,表明处方4制备的缓释片与Norflex的释药行为最相似。因此,将EC的用量定为24 mg。
2.4.4 EC黏度考察 不同EC黏度会影响药物的释放机制,考察EC N50(处方5)、EC N100(处方4)两种黏度对药物释放的影响,处方组成见表1。因为不同黏度的EC在酸性溶液中的稳定性不同,故同时测定其在水和pH 1.0介质中的释放度,并计算自研制剂与Norflex释放行为的相似因子f2。结果见表3。
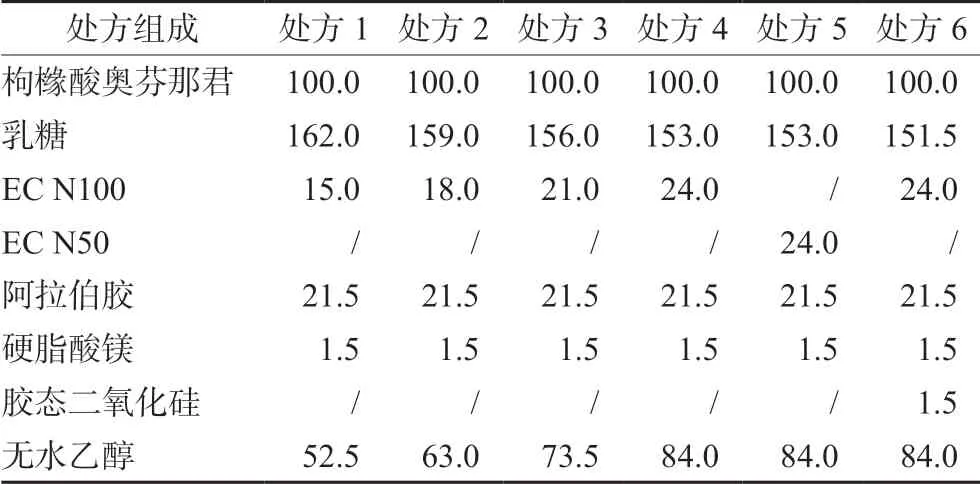
表1 枸橼酸奥芬那君缓释片的单剂量处方组成(mg) Tab 1 Single-dose prescription composition of orphenadrine citrate sustained-release tablet (mg)
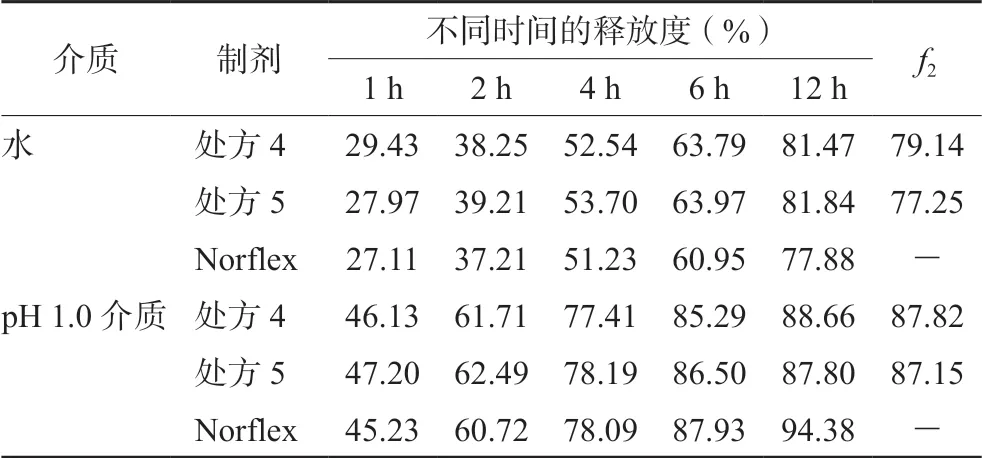
表3 处方4和处方5在水和pH 1.0介质中的释放度(n=6) Tab 3 Release of prescription 4 and prescription 5 in water and pH 1.0 medium (n=6)
结果表明,处方4、处方5在水和pH 1.0介质中的f2值均大于70,但是在药物释放过程中观察到处方5制备的缓释片在pH 1.0介质中于6 h后均崩散,与Norflex(缓释片完整)不一致。EC作为缓释骨架的释药机制是溶液穿透骨架,将药物溶解,药物随之从骨架的孔隙中扩散出来,骨架控制药物的释放[10]。然而,不同黏度的 EC生成骨架的稳固程度不同,一般黏度越高,骨架越稳固。处方5中使用的EC N50黏度较小,在酸性介质中无法长时间保持骨架完整而崩解,因此无法有效控制药物的释放;处方4中使用的EC N100黏度较大,能够在酸性溶液中长时间形成稳固的骨架,保持片剂完整,因此拟定EC黏度为N100。
2.4.5 助流剂考察 由于二氧化硅亲水,具有一定的促进崩解和溶出的作用可作为助流剂[11],因此制备处方6,考察胶态二氧化硅对药物释放的影响。按“2.2”项下方法进行释放度测定,释放介质为水,并计算自研制剂与Norflex释放行为的相似因子f2。结果见表4。
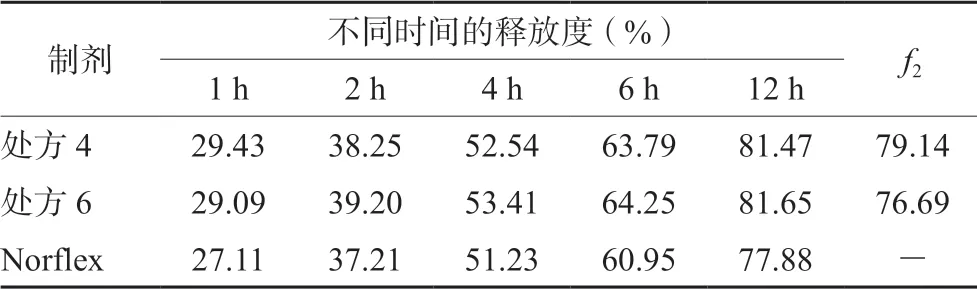
表4 处方4和处方6在水介质中的释放度(n=6) Tab 4 Release of prescription 4 and prescription 6 in aqueous medium (n=6)
结果显示,处方4、处方6的f2值差异较小,表明加入1.5 mg的胶态二氧化硅对枸橼酸奥芬那君的释放无显著性影响;又因本品中原料药占比较大,所以为了工业化生产中能够保证物料流动的顺畅性,最终选择处方中加入1.5 mg胶态二氧化硅。
2.4.6 最优化处方 根据上述对EC用量、黏度及助流剂的筛选,最终得到最优处方(见表5)。
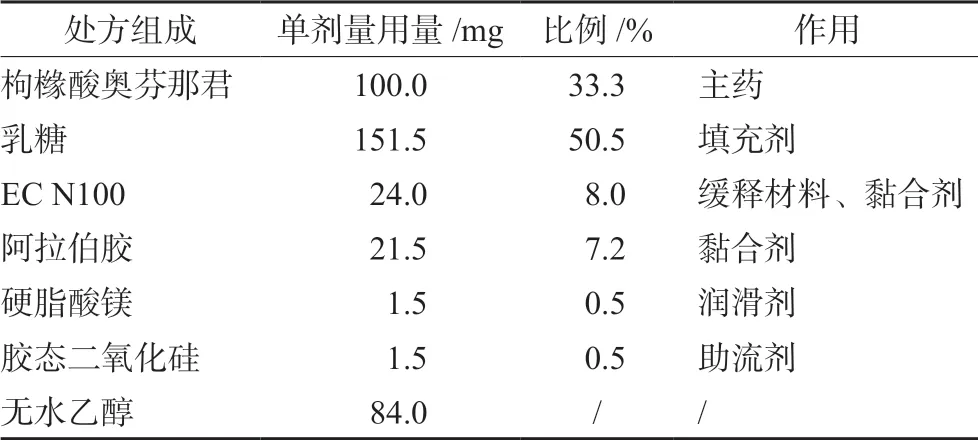
表5 枸橼酸奥芬那君缓释片最优处方 Tab 5 Optimal prescription of orphenadrine citrate sustainedrelease tablets
2.5 质量属性比较研究
按照2020年版《中国药典》品种项下质量标准对自研制剂和Norflex进行检验,结果见表6。

表6 不同缓释片的质量属性 Tab 6 Quality attributes of different sustained-release tablets
结果表明,两种制剂的关键质量属性具有一致性。自研制剂与原研制剂的外观性状、物理属性一致;自研制剂最大单杂和总杂均不大于原研制剂;自研制剂与原研制剂的含量差异在±2%之内。《以药动学参数为终点指标的化学药物仿制药人体生物等效性研究技术指导原则》建议,口服固体制剂进行BE研究时,受试制剂与参比制剂的含量差异不应超过±5%,否则会导致BE结果出现大的偏差。本研究控制自研制剂与参比制剂(原研制剂)含量差异在±2%,能更好地体现出释放曲线数据的准确性,以指导后期的BE评价。
2.6 释放曲线比较研究
取自研制剂和Norflex各6片,按“2.2”项下方法测定释放度,其在水和pH 1.0、pH 4.5、pH 6.8与Norflex的f2分别为76.69、84.17、88.47、91.05,结果见图1~4。
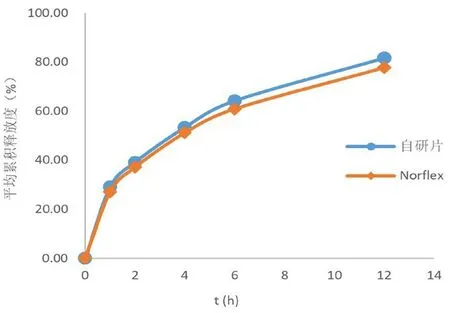
图1 不同缓释片在水中的释放曲线Fig 1 Release profile of different sustained-release tablets in water
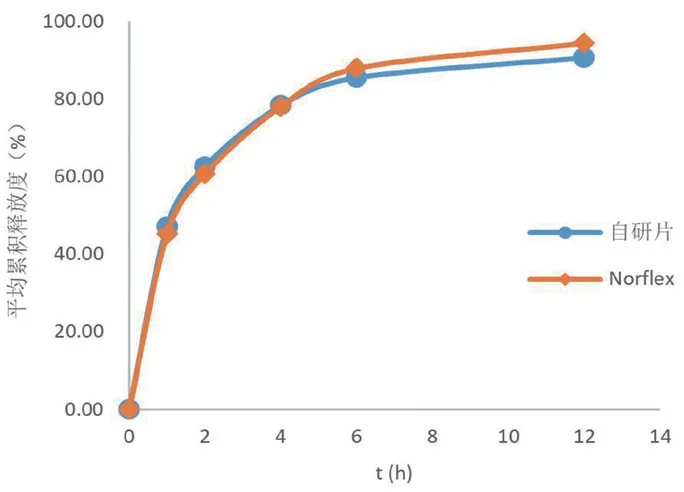
图2 不同缓释片在pH 1.0介质中的释放曲线Fig 2 Release profile of different sustained-release tablets in pH 1.0 medium
结果显示,自研制剂和Norflex在0~12 h内均保持片剂外观完整、不崩散,在水、pH 1.0、pH 4.5和pH 6.8介质中的溶出行为相似,以两种制剂在水介质中的溶出行为为示例(如图5所示),表明本产品与Norflex的制备工艺基本一致;另外,自研制剂和Norflex在水、pH 1.0、pH 4.5和pH 6.8介质中的释放曲线基本重合,表明两种制剂在4种介质中的释放行为相似。
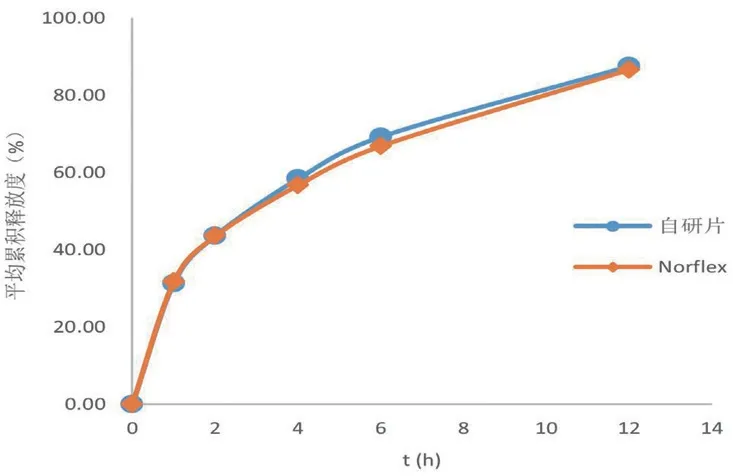
图3 不同缓释片在pH 4.5介质中的释放曲线Fig 3 Release profile of different sustained-release tablets in pH 4.5 medium
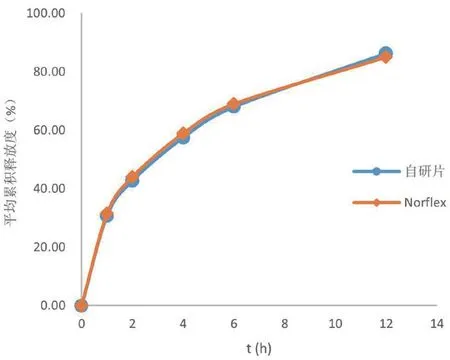
图4 不同缓释片在pH 6.8介质中的释放曲线Fig 4 Release profile of different sustained-release tablets in pH 6.8 medium

图5 不同缓释片在水介质中的溶出现象Fig 5 Dissolution appearance of different sustained-release tablets in aqueous medium
2.7 释药机制研究
采用模型拟合来判断自研制剂与原研制剂的释放机制是否相同,以此判断两者释放行为的相似性,从而为BE试验提供参考。根据优化后的处方,将自研制剂和原研制剂的释放度按零级、一级、Higuchi和Ritger-Peppas模型进行拟合,根据R2判断其拟合程度,R2越大,拟合效果越好[12-13]。拟合结果如表7所示。
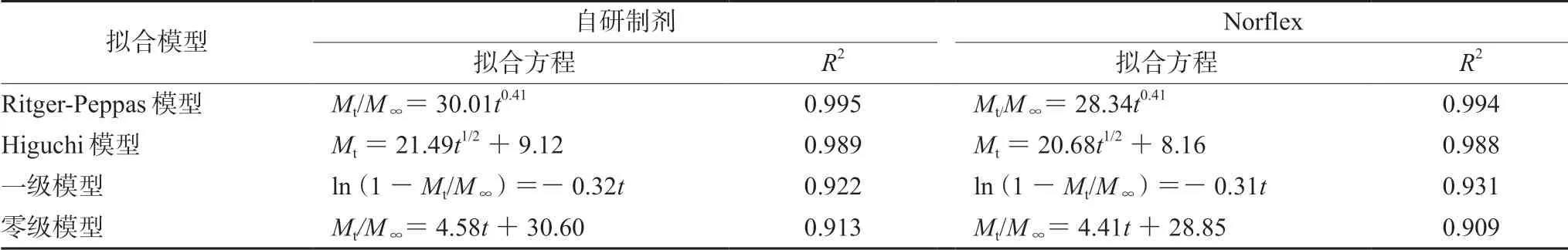
表7 不同缓释片在水中释放模型拟合 Tab 7 Fitting the release model of different sustained-release tablets in water
由表7可以看出,自研制剂与原研制剂释放动力学方程均符合Higuchi方程,Ritger-Peppas拟合方程的释放系数n值均小于0.43,说明自研制剂与原研制剂都是以fick扩散为主[14],释药机制相同。
3 讨论
EC是将纤维素链中的部分羟基用乙氧基取代的纤维素衍生物,其具有无毒、水不溶、多黏度等特性,在药物制剂中常被用作缓控释制剂的骨架材料;同时,EC可溶于乙醇制成黏合剂,作为水溶性药物缓控释制剂的黏合剂。EC是既不溶解也不溶蚀的材料,其在骨架片中的释药机制是液体穿过骨架孔隙,将药物溶解然后从骨架的孔隙中扩散出来,药物在释放的全过程中,EC骨架保持完整,几乎不会发生任何改变。EC所制备的骨架片释药动力学方程一般符合Higuchi方程。本文对枸橼酸奥芬那君缓释片关键辅料EC的用量及黏度进行了筛选。不同黏度的EC制得的缓释骨架牢固度不同;低黏度的EC制备的缓释骨架牢固度低于高黏度的EC。EC用量是决定药物释放速度的关键因素,当EC的用量足够形成缓释骨架时,随着EC用量的增加,孔隙率逐渐减小,药物释放速度逐渐减慢。
通过对自研制剂和原研制剂的关键质量属性进行考察,发现两种制剂的关键质量属性具有一致性。通过对自研制剂进行体外评价,发现自研制剂与原研制剂在pH 1.0、pH 4.5、pH 6.8和水介质中溶出行为一致,释放曲线基本重合,相似因子f2值均大于70;结合Ritger-Peppas拟合方程的释放系数n值均小于0.43,确定自研制剂和原研制剂的释放机制均以fick扩散为主,说明自研制剂与原研制剂在这4种释放介质中具有相似的释药行为,这将为本品在人体内的BE试验提供依据。
