1例PD-1抑制剂致多内分泌腺综合征的不良反应分析
2021-12-30谈仪炯方芳刘芳王育璠上海交通大学附属第一人民医院临床药学科上海00080上海交通大学附属第一人民医院内分泌代谢科上海00080
谈仪炯,方芳,刘芳*,王育璠*(.上海交通大学附属第一人民医院临床药学科,上海 00080;.上海交通大学附属第一人民医院内分泌代谢科,上海 00080)
程序性死亡受体1(PD-1)抑制剂是一种免疫检查点抑制剂(immune checkpoint inhibitor,ICI)。随着临床研究的深入,PD-1抑制剂的运用越来越广泛,目前已经在黑素瘤、肾细胞癌、非小细胞肺癌、头颈部癌、尿路上皮癌、霍奇金淋巴瘤等多种肿瘤中显示了良好的疗效。然而这类药物在调控免疫应答杀伤肿瘤的同时也会使免疫细胞过度活化,导致皮肤、胃肠、肝脏、内分泌等多个系统受累[1-2],引起免疫相关不良反应(immune-related adverse events,irAEs)。目前,国内PD-1抑制剂致多内分泌腺综合征的不良反应报道较少,本文通过对1例应用 PD-1 抑制剂后出现1型糖尿病和甲状腺功能减退的病例进行分析讨论,提高临床对该类不良反应的认识,保证患者用药安全。
1 病例资料
患者,男,68岁,2017年3月体检发现左锁骨上淋巴结,病理提示转移分化差的癌可能。其后多次PET-CT提示右肺中叶、下叶肺门区肿块伴葡萄糖代谢增高,全身多发转移性淋巴结。分别 于2019年5月17日、6月7日、7月7日、7月31日、8月23日、9月26日、11月26日行信迪利单抗200 mg(厂家:信达生物制药有限公司,批号:P1908015)联合白蛋白型紫杉醇300 mg治疗(共计7次),治疗期间未出现明显不良反应。患者分别于2020年8月2日、9月15日、10月29日、12月22日及2021年1月12日行信迪利单抗200 mg(批号:P2006018)联合安罗替尼10 mg治疗。患者诉2020年11月30日出现口干症状,12月1日至门诊就诊,查糖化血红蛋白(HbA1c)5.7%,微量法空腹血糖(FBG)5.46 mmol·L-1。血清游离三碘甲腺原氨酸(FT3)1.27 pmol·L-1,血清游离甲状腺素(FT4)4.12 pmol·L-1,血清促甲状腺激素(TSH)61.5 uIU·mL-1。促甲状腺激素受体抗体(TRAb)、甲状腺球蛋白抗体(TGAb)、甲状腺过氧化物酶抗体(TPOAb)均阴性。予左甲状腺素片75 μg qd替代治疗。2021年1月15日,患者口干症状明显加重,伴有多饮多尿,查FBG 17.7 mmol·L-1↑,考虑为药物引起的自身免疫反应,暂停信迪利单抗及安罗替尼治疗。2月2日门诊查FBG 17.2 mmol·L-1↑,予德谷胰岛素14 U皮下注射控制血糖,2月3日改为德谷胰岛素早18 U-晚12 U皮下注射,为求进一步治疗,2月4日收住内分泌科病房,入院随机血糖为9.2 mmol·L-1。患者既往患有高脂血症20余年,口服非诺贝特降脂治疗,近两年停用,未予复查。确认家族肿瘤史,父亲因直肠癌去世,母亲因淋巴癌去世。
体格检查:体温36.4℃,心率80次·min-1,呼吸18次·min-1,血压146/99 mmHg(1 mmHg=0.133 kPa)。身高162 cm,体质量55 kg,体质指数21 kg·m-2。神志清楚,回答切题,全身皮肤黏膜未见异常,无肝掌,全身浅表淋巴结无肿大。余未见明显异常。
入院后(2月4日)行实验室及影像学检查,血常规:白细胞数 3.31×109·L-1↓,中性粒细胞 2.25×109·L-1,血 红 蛋 白 122.0 g·L-1↓,血小板总数 153×109·L-1。甲状腺功能:FT3 3.88 pmol·L-1↓,FT4 11.21 pmol·L-1↓,TSH 39.04 uIU·mL-1,TRAb、TGAb、TPOAb均 阴 性。性激素:促黄体生成素(LH)12.78 IU·L-1↑,促卵泡生成激素(FSH)23.48 IU·L-1↑,孕酮0.85 ng·mL-1,雌二醇23.46 pg·mL-1,血清泌乳素4.21 ng·mL-1,睾酮411.52 ng·dL-1。馒头餐试验结果见表1。HbA1c 8.8%↑,胰岛细胞抗体(ICA)41.5 IU·mL-1↑(参考范围0~20 IU·mL-1),胰岛素自身抗体(IAA)及谷氨酸脱羧酶抗体(GADA)均阴性。尿白蛋白/尿肌酐83.82 μg·mg-1↑。肾上腺功能正常,余未见明显异常。

表1 馒头餐试验
诊疗经过:入院后完善相关检查,结合病史及胰岛细胞功能及胰岛相关抗体,考虑诊断为其他类型糖尿病。入院后更换治疗方案为阿卡波糖100 mg tid口服联合门冬胰岛素4U-3U-3U三餐前皮下注射、德谷胰岛素12 U睡前皮下注射。空腹血糖波动在5.4~8 mmol·L-1,餐后血糖波动在6.8~10 mmol·L-1。入院后完善糖尿病并发症检查,患者24 h尿生化提示微量蛋白尿,24 h尿蛋白总量0.38 g,血肌酐正常,结合患者眼底正常,考虑糖尿病为PD-1抑制剂引起可能大。患者数月前出现甲状腺功能减退,入院时每日服用左甲状腺素片75 μg,本次入院TSH 39.04 uIU·mL-1↑,加量至125 μg qd替代治疗。出院后3月5日复查FT3 4.93 pmol·L-1,FT4 13.64 pmol·L-1,TSH 5.77 uIU·mL-1,甲状腺功能基本恢复正常,血糖控制平稳,继续予阿卡波糖100 mg tid联合胰岛素皮下强化治疗。
2 讨论
2.1 不良反应相关性分析
PD-1抑制剂引起的irAEs可能累及多个内分泌系统,包括甲状腺、肾上腺、垂体及胰腺内分泌等。其中累及甲状腺系统的最为常见[3-4]。本病例中患者在使用信迪利单抗数个疗程后(半年左右)多个内分泌腺受到影响,主要表现为严重的甲状腺功能减退和血糖的异常升高。使用诺氏评估量表对药品不良反应关联性进行评价,评分为7分,关联性为很可能有关,具体评分见表2。
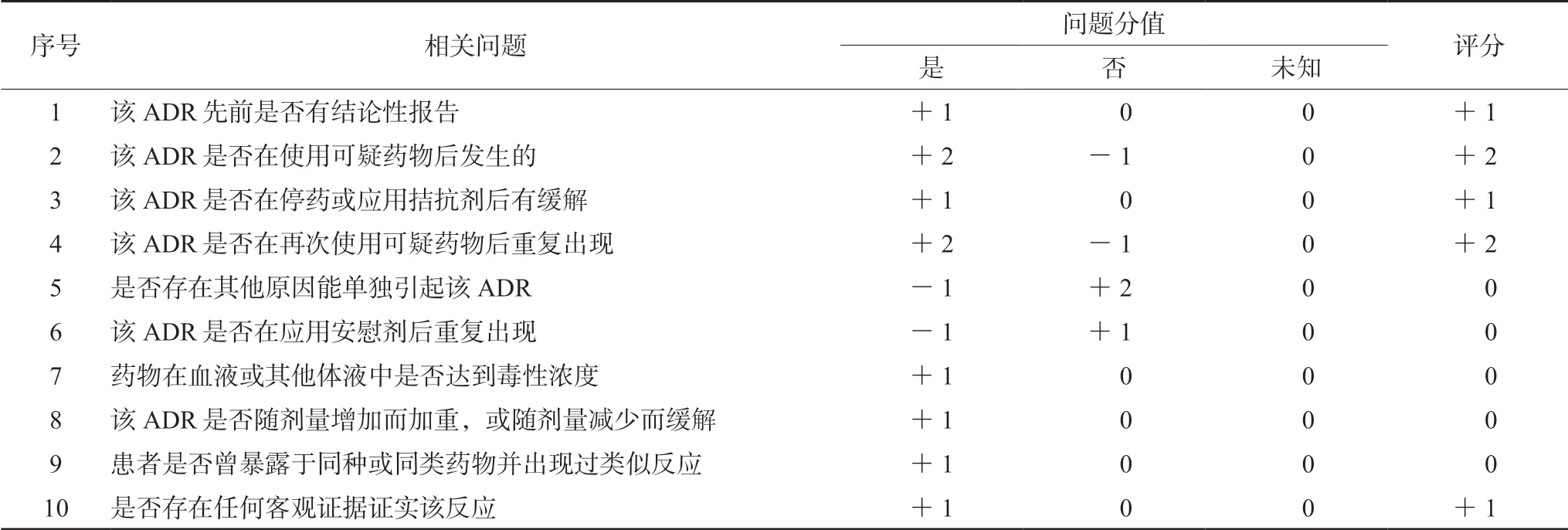
表2 诺氏药品不良反应评估量表
2.2 PD-1抑制剂引起的甲状腺疾病
本例患者在使用PD-1抑制剂后出现了严重的甲状腺功能减退,最终使用每日125 μg左甲状腺素片替代治疗。接受免疫治疗后的患者易发生甲状腺功能的异常,包括甲状腺功能亢进、甲状腺功能减退以及甲状腺炎[5-6]。相关文献报道,这些疾病的发生可能与药物对甲状腺的破坏有关[7]。程序性死亡受体-配体1(1PD-L1)除了在肿瘤细胞表面高表达外,在甲状腺等其他组织中也有一定的表达,PD-L1的存在抑制了T细胞的过度表达,起到了免疫抑制的重要作用。PD-1抑制剂在治疗肿瘤的同时,甲状腺等正常外周组织的 PD-1/PD-L1 信号通路同样被阻断,此时的T细胞过度表达导致了免疫失衡,从而出现irAEs[8]。
2.3 PD-1抑制剂引起的1型糖尿病
本例患者在使用PD-1抑制剂半年后出现了明显的口干症状,当时查HbA1c 5.7%。一个半月后口干症状明显加重,伴有多饮多尿,复查空腹血糖为17.7 mmol·L-1,而住院后的馒头餐试验结果提示,患者的胰岛功能基本衰竭,结合ICA抗体阳性,考虑为PD-1抑制剂引起的1型糖尿病。PD-1抑制剂导致的1型糖尿病与胰岛自身抗体的关系并不明确。有文献报道约半数病例存在胰岛自身抗体[9],与抗体阴性者相比胰岛自身抗体阳性者发病时间更短,出现糖尿病酮症酸中毒的比例更高[10]。
PD-1抑制剂相关1型糖尿病发病机制尚不明确。有研究报道某些HLA基因型如HLA-DQ2和HLA-DQ8与1型糖尿病易感性增加有关[11]。同经典的1型糖尿病一样,PD-1抑制剂引起的1型糖尿病不能逆转,需要胰岛素皮下强化治疗,若血糖高引起酮症酸中毒,则需要小剂量胰岛素静脉滴注,及时纠正电解质紊乱。
2.4 PD-1抑制剂致多内分泌腺综合征临床处理及启示
PD-1抑制剂引起的irAEs 较独特,主要是对自身组织产生免疫损伤,通常治疗中度或重度irAEs需要中断PD-1抑制剂治疗,并使用糖皮质激素进行免疫抑制[12]。但内分泌系统相关的irAEs,如甲状腺疾病和1型糖尿病一般不需要使用。糖皮质激素为升糖激素,刺激肝糖原异生,抑制外周组织对葡萄糖的摄取和利用,增加肝糖原合成,对胰高糖素、肾上腺素、生长激素的升糖效应有“允许”和“协同”作用。因此对于PD-1抑制剂引起的1型糖尿病,使用糖皮质激素反而会使血糖升高,病情加重。本病例中,患者使用PD-1抑制剂后导致了甲状腺功能减退和1型糖尿病,考虑为药物引起的多内分泌腺综合征。临床在使用免疫检查点抑制剂时应注意以下几点:① 药物导致一种内分泌腺体损伤时,应考虑其他腺体累及的可能,及时评估其他内分泌腺体;② 使用过程中注意监测血糖和评估甲状腺功能,必要时对肾上腺功能、性腺功能进行评估;③ 关注患者的临床症状,出现口干、多饮、恶心、乏力、纳差等不良反应时应予重视,分析原因并给予及时处理。
3 小结
PD-1抑制剂由于疗效良好和不良反应少受到了临床医师和患者的青睐,但在使用过程中部分患者也会出现一些irAEs,建议在治疗过程中常规监测血糖及甲状腺功能。尽管PD-1抑制剂导致的1型糖尿病相对少见,但是其进展迅速、病情凶险。若不及时就医或延误诊治可能危及患者生命。而甲状腺功能的监测有利于识别PD-1抑制剂引起的甲状腺疾病,尽早进行干预。
