红毛七中一个新的羽扇豆烷型三萜皂苷
2021-12-30刘渝汤海峰王玉梅陆云阳张倩刘杨毕琳琳空军军医大学第一附属医院采购中心西安71003空军军医大学药学系中药与天然药物学教研室西安71003陕西中医药大学药学院陕西咸阳71046
刘渝,汤海峰,王玉梅,陆云阳,张倩,刘杨,毕琳琳(1.空军军医大学第一附属医院采购中心,西安 71003;.空军军医大学药学系中药与天然药物学教研室,西安 71003;3.陕西中医药大学药学院,陕西 咸阳 71046)
红毛七为小檗科(Berberidaceae)红毛七属植物类叶牡丹Caulophyllum robustumMaxim.[Leontice robustumDiels]的根及根茎,因其须根多而细呈紫红色,故得此名,又名金丝七、搜山猫、红毛细辛、火焰叉、通天窍、葳严仙、海椒七、鸡骨升麻等。类叶牡丹主要分布于我国东北地区及陕西、湖北等地,药材作为陕西七药(太白七药)之一,具有活血散瘀、祛风止痛、降血压、止血、解草乌中毒功效,主治月经不调、经期小腹疼痛、关节炎、高血压等症[1-2]。红毛七主要含有三萜皂苷、生物碱以及甾醇等成分,已从中分离鉴定了上百个化合物,其中三萜皂苷类50余个,所涉及的10余种苷元均属于齐墩果烷型。现代药理研究表明红毛七提取物及其皂苷、生物碱等成分具有抗炎镇痛、抗菌、抗氧化、抗肿瘤、抗心肌缺血等作用[3-4]。对红毛七的研究报道甚多,但仍不断有新的化学成分被发现,本课题组预实验提示陕西产地红毛七与东北等其他产地的药材在化学成分上可能存在一定差异。基于课题组前期对陕产红毛七化学成分的初步研究[5-6],为进一步明确其药效物质基础,从而为红毛七的开发利用提供理论依据,本文继续对其70%乙醇提取物的正丁醇萃取部位进行化学成分研究,共分离得到5个三萜皂苷1~5(见图1),其中,化合物1为新化合物,且首次在红毛七属植物中发现羽扇豆烷型三萜皂苷,化合物5为首次从该属植物中分离得到。
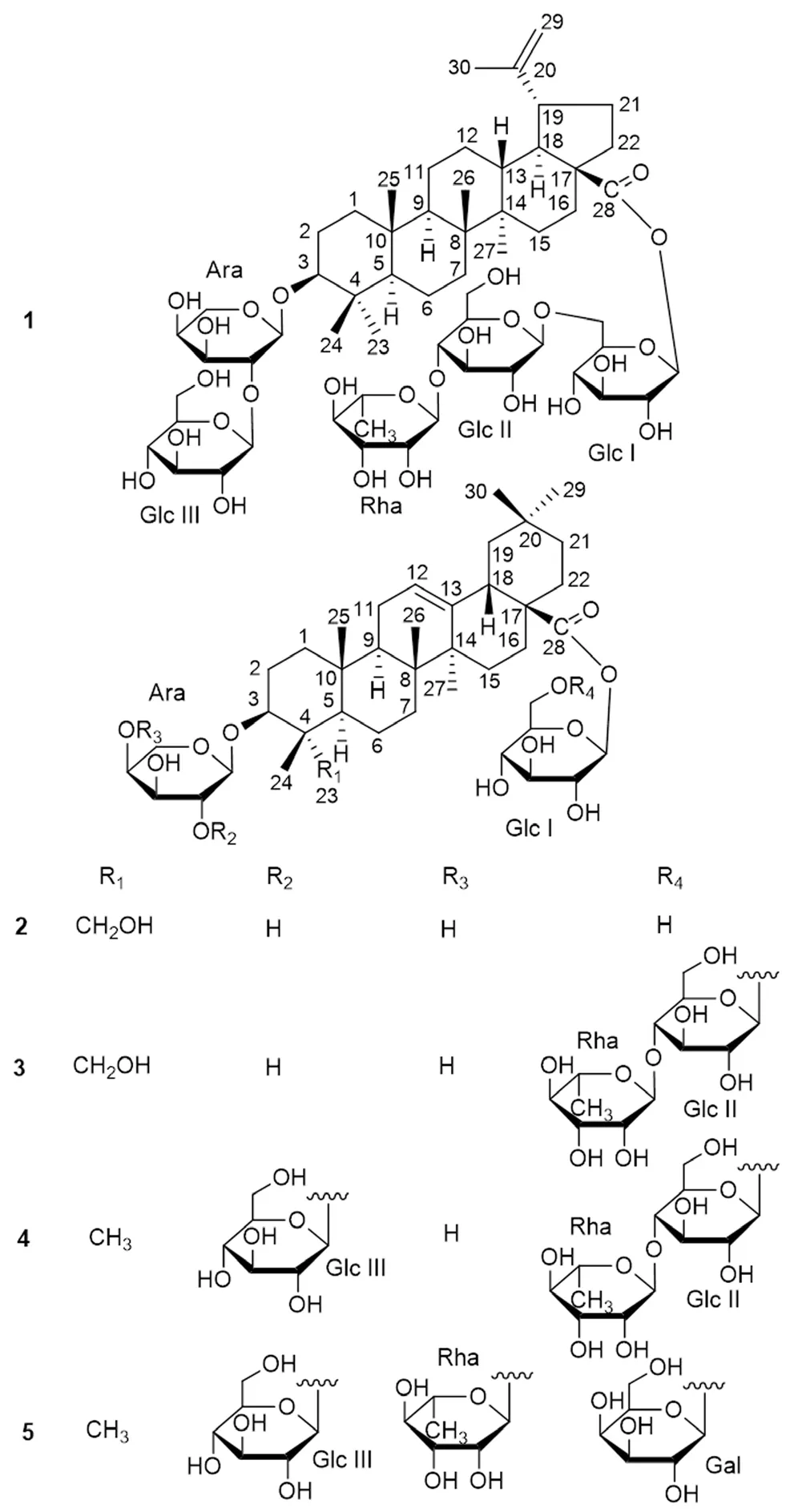
图1 皂苷1~5的结构式Fig 1 Structure of saponins 1~5
1 材料
PL343 旋光仪(Perkin-Elmer公司);Quatrro Micro质谱仪(Micromass公司);Bruker AVANCE 500 型核磁共振波谱仪(Bruker公司);戴安P680高效液相色谱仪(P680系列单泵、UV-VS 检测器、CHROMELON工作站)[配YMC-Pack R&D ODS-A半制备色谱柱(20 mm×250 mm,5 μm)];Agilent GC-6820气相色谱仪[配HP-5 弹性石英毛细管柱(30 m×0.32 mm,0.25 μm),氢火焰离子化检测器];ODS C18柱(Merck公司);Sephadex LH-20凝胶(GE公司);柱色谱硅胶(100~200目、200~300目)、薄层色谱用硅胶H、预制硅胶板G(青岛海洋化工厂);RP-18高效薄层预制板(Merck公司)。色谱纯甲醇(天津科密欧公司);氘代试剂(Merck公司);对照品L-阿拉伯糖、D-半乳糖、L-鼠李糖和D-葡萄糖(Sigma公司);显色剂(20%硫酸/乙醇溶液);其他试剂均为分析纯。
药材于2014年8月采自陕西省太白山,经空军军医大学药学系中药与天然药物学教研室汤海峰教授鉴定为类叶牡丹(Caulophyllum robustumMaxim.)的根及根茎,药材标本(No.20140918)保存于该教研室标本室。
2 提取与分离
取干燥粉碎的药材5 kg用70%乙醇回流提取3次,每次2 h,减压回收溶剂得浸膏413.2 g。将浸膏加水5 L分散后用等体积石油醚萃取2次,再用等体积正丁醇萃取3次,减压回收正丁醇层得浸膏202.6 g。取正丁醇浸膏130 g用硅胶柱色谱分离,用V三氯甲烷:V甲醇:V水(50∶1∶0~63∶35∶0.5)梯度洗脱,合并得到7个部分(Fr.1~Fr.7)。Fr.1(5.11 g)经Sephadex LH-20凝胶柱色谱(洗脱剂为甲醇)除去杂质,再经ODS C18柱 色 谱,V甲醇:V水(3∶7~10∶0)梯度洗脱,得到化合物2(19.8 mg)。Fr.6(14.77 g)经Sephadex LH-20凝胶柱色谱(洗脱剂为V三氯甲烷:V甲醇=1∶1)除去杂质,再经ODS C18柱色谱分离,V甲醇:V水(1∶1~7∶3)梯度洗脱,合并得到3个组分(Fr.6-1~Fr.6-3)。Fr.6-2(440 mg)经过半制备HPLC分离纯化(流速8 mL·min-1,检测波长206 nm),65%甲醇洗脱得到化合物4(157.9 mg,tR=6.5 min)。Fr.6-3(700 mg)经半制备HPLC反复分离纯化(流速3 mL·min-1,检测波长206 nm),70%甲醇洗脱得到化合物1(11.9 mg,tR=32.9 min)、化合物3(28.3 mg,tR=22.4 min)和化合物5(169.8 mg,tR=40.6 min)。
3 结构鉴定
化合物1:白色无定形粉末,[α]D22-23.2°(c0.1,MeOH),Liebermann-Burchard和Molish反应均呈阳性,提示该化合物可能为皂苷类。IR(KBr)νmaxcm-1:3400(OH),2930(CH),1725(C=O)。ESI-MS显示其准分子离子峰为m/z1243 [M+Na]+(正离子模式)和1219 [MH]-(负离子模式);从HR-ESI-MS的准分子离子峰m/z1219.6081 [M-H]-(C59H95O26,计算值为1219.6112),结合NMR数据,可推断出其分子式为C59H96O26。化合物1的1D NMR数据显示δH0.86(H3-24),0.90(H3-26),0.98(H3-25),1.02(H3-27),1.06(H3-23)和1.71(H3-30)处的6个甲基单峰信号,δH4.63和4.76处的2个宽单峰烯质子信号以及δC151.9(C-20)和110.6(C-29)处的一对特征的烯碳信号,以及δC176.4(C-28)处的酯羰基碳信号,表明化合物1的苷元具有羽扇豆-20(29)-烯-28-酸的骨架。δH3.15(dd,J=12.0,4.5 Hz)处的连氧次甲基信号归属为H-3,NOESY谱中H-3和H-5(δH0.76,br d,J=11.5 Hz)的NOE相关表明H-3为α构型。通过2D NMR(1H-1H COSY、TOCSY、HSQC、HMBC和NOESY)分析归属了苷元部分的碳氢信号,见表1。与白桦酸的核磁数据(CDCl3或C5D5N)[7-9]对照,排除溶剂不同(CD3OD)的影响,结果基本一致,从而确定化合物1的苷元为3β-羟基-羽扇豆-20(29)-烯-28-酸,即白桦酸(桦木酸)。化合物1的C-28和C-3的化学位移值分别比白桦酸[7]位移了-4.1和+12.4,表明其为3和28位连糖的双糖链皂苷。化合物1用2 mol·L-1三氟乙酸水解,按文献方法[8,10]将所得单糖制备三甲基硅醚化L-半胱氨酸衍生物,以标准糖衍生物作对照,进行GC分析,表明化合物1的糖基为D-葡萄糖(Glc)、L-鼠李糖(Rha)和L-阿拉伯糖(Ara),组成比为3∶1∶1。在1H-NMR谱中显示5个糖基的端基氢信号δH4.52(d,J=6.0 Hz,Ara),4.60(d,J=7.5 Hz,GlcⅢ),5.49(d,J=8.5 Hz,Glc Ⅰ),4.40(d,J=8.0 Hz,GlcⅡ)和4.86(s,Rha),在HMQC谱 中 分 别与相应的糖端基碳信号相关(δC105.5,104.9,95.4,104.7和103.1)。由GlcⅠ、GlcⅡ和GlcⅢ的端基氢偶合常数可知3个葡萄糖形成的苷键均为β构型;在NOESY谱中阿拉伯糖的H-1和H-3、H-1和H-5存在NOE相关(4C1式),可推知其形成的苷键为α构型,尽管其端基氢偶合常数(6.0 Hz)小于甲基-α-L-吡喃阿拉伯糖苷(8.0 Hz),这可解释为4C1和1C4式的快速构象平衡[11];鼠李糖的端基氢信号为单峰,根据其C-5的化学位移值(δC70.8)可知其形成的苷键为α构型[12]。通过对2D NMR解析,归属了5个糖基的碳氢信号(见表1)。通过HMBC和NOESY分析可确定糖基的连接位置和连接顺序(见图2)。在HMBC谱中,Ara H-1与苷元C-3存在远程相关峰,说明Ara连接于苷元C-3位;Glc Ⅲ H-1与Ara C-2的远程相关表明Glc Ⅲ连接于Ara的C-2位;同样,Glc Ⅰ H-1/C-28、GlcⅡ H-1/GlcⅠ C-6和Rha H-1/Glc Ⅱ C-4的远程相关信号可以确定28位糖链的结构。NOESY谱的相关信号进一步验证了上述糖链结构。综上所述,确定化合物 1 的结构为3-O-β-D-吡喃葡萄糖-(1→2)-α-L-吡喃阿拉伯糖-白桦酸-28-O-α-L-吡喃鼠李糖-(1→4)-β-D-吡喃葡萄糖-(1→6)-β-D-吡喃葡萄糖苷,经SciFinder检索为新化合物。

表1 化合物1的1H-NMR (500 MHz)和13C-NMR (125 MHz)数据(in CD3OD) Tab 1 1H-NMR (500 MHz) and 13C-NMR (125 MHz) data of compound 1 in CD3OD

图2 化合物1重要的HMBC和NOESY相关Fig 2 Key HMBC and NOESY correlations of compound 1
化合物2:白色无定形粉末,Liebermann-Burchard和Molish反应均呈阳性。ESI-MS显示其准分子离子峰为m/z789 [M+Na]+(正离子模式)和765 [M-H]-(负离子模式),提示其相对分子质量为766,结合NMR数据推断其分子式为C41H66O13。在化合物2的1H-NMR谱高场区δH0.90,0.90,0.94,0.98,1.15和1.20处可见归属于苷元部分的6个甲基单峰信号,在δH5.45处可见一个烯氢宽单峰信号;此外,还可观察到δH3.12(dd,J=13.5,4.0 Hz,H-3)和3.28(dd,J=11.5,4.5 Hz,H-18)等信号。在化合物2的13C-NMR谱中,可见一对烯碳信号分别位于δC123.5和144.1,一个酯糖基碳信号δC177.0,一个氧取代亚甲基碳信号δC65.0和一个氧取代次甲基碳信号δC82.4。这些是齐墩果烷型三萜常春藤皂苷元的特征信号,而且在苷元的3位和28位均与糖基成苷。化合物2苷元部分的碳谱信号(见表2)与文献报道一致[5],从而确认了苷元的结构。按与化合物1相同的方法,对化合物2进行酸水解及衍生,经GC分析表明其糖基为L-Ara和D-Glc(1∶1)。NMR谱中显示两个糖的端基氢和端基碳信号[δH6.24(d,J=7.9 Hz,GlcⅠ H-1),4.99(d,J=7.0 Hz,Ara H-1);δC96.3(GlcⅠ C-1),107.2(Ara C-1)],根据苷化位移规律,可推断阿拉伯糖与苷元的3位连接,葡萄糖与苷元的28位羧基成酯苷。因此,确定化合物2的结构为3-O-α-L-吡喃阿拉伯糖-常春藤皂苷元-28-O-β-D-吡喃葡萄糖苷,即已知化合物HN-saponin F,波谱数据与文献报道一致[13]。
化合物3:白色无定形粉末,Liebermann-Burchard和Molish反应均呈阳性。ESI-MS显示其准分子离子峰为m/z1097 [M+Na]+(正离子模式)和1073 [M-H]-(负离子模式),提示其相对分子质量为1074,结合NMR数据推断其分子式为C53H86O22。通过与化合物2对照,发现两者苷元部分的碳谱数据一致,确定化合物3的苷元亦为常春藤皂苷元,且在苷元3位和28位均与糖连接成苷。化合物3的13C-NMR谱中,比化合物2多出一组六碳糖信号和一组甲基五碳糖信号,因苷元3位阿拉伯糖的碳化学位移无变化,这两个糖应该属于苷元28位的糖链。按与化合物1相同的方法,对化合物3进行酸水解及衍生,经GC分析表明其糖基为D-Glc、L-Ara和L-Rha(2∶1∶1)。通过2D NMR分析归属了化合物3的所有碳氢信号,重要的1H-NMR(500 MHz,C5D5N)信号如下:δH0.85,0.86,0.93,0.97,1.11,1.16(each 3H,s),1.71(3H,d,J=6.1 Hz,Rha H-6),3.06(dd,J=13.5,4.0 Hz,H-3),3.14(1H,dd,J=3.5,13.5 Hz,H-18),4.92(1H,d,J=7.3 Hz,Ara H-1),4.94(1H,d,J=8.0 Hz,Glc Ⅱ H-1),5.38(1H,br s,H-12),6.23(1H,d,J=8.2 Hz,GlcⅠ H-1),6.39(1H,s,Rha H-1);13C-NMR数据见表2。根据HMBC谱分析确定了28位糖链的结构,与化合物1的28位糖链相同。通过与文献报道对照[14],确定化合物3的结构为3-O-α-L-吡喃阿拉伯糖-常春藤皂苷元-28-O-α-L-吡喃鼠李糖-(1→4)-β-D-吡喃葡萄糖-(1→6)-β-D-吡喃葡萄糖苷,即已知化合物红毛七皂苷D,两者波谱数据一致。
化合物4:白色无定形粉末,Liebermann-Burchard和Molish反应均呈阳性。ESI-MS显示其准分子离子峰为m/z1243 [M+Na]+(正离子模式)和1219 [M-H]-(负离子模式),提示其相对分子质量为1220,结合NMR数据推断其分子式为C59H96O26。通过与化合物3对照,发现化合物4的13C-NMR谱中少了一个连氧亚甲基碳信号,多了一个甲基碳信号δC29.4(C-23),并因此造成邻近碳的化学位移变化(C-3、C-4、C-5、C-24等),表明化合物4的苷元为齐墩果酸,且同样为双糖链皂苷;经与以齐墩果酸为苷元的皂苷的波谱数据对照[9],可确认化合物4的苷元结构。化合物4的13C-NMR谱中,比化合物3多出一组六碳糖信号,根据Ara C-2的化学位移变化(δC82.3),提示该糖基连接于Ara的C-2位。按与化合物1相同的方法,对化合物4进行酸水解及衍生,经GC分析表明其糖基为D-Glc、L-Ara和L-Rha(3∶1∶1)。通过2D NMR分析归属了化合物4的所有碳氢信号,重要的1H-NMR(500 MHz,C5D5N)信号如下:δH0.88,0.89,0.90,1.02,1.05,1.10,1.22,1.23(each 3H,s),1.70(3H,d,J=6.2 Hz,Rha H-6),3.19(1H,overlapped,H-3),3.19(1H,overlapped,H-18),4.91(1H,d,J=5.7 Hz,Ara H-1),4.96(1H,d,J=7.8 Hz,Glc Ⅱ H-1),5.18(1H,d,J=8.0 Hz,Glc Ⅲ H-1),5.36(1H,br s,H-12),6.23(1H,d,J=8.2 Hz,GlcⅠ H-1),6.28(1H,s,Rha H-1);13C-NMR数据见表2。根据HMBC谱分析确定了3位和28位糖链的结构,与化合物1的糖链相同。因此,确定了化合物4的结构,即已知化合物3-O-β-D-吡喃葡萄糖-(1→2)-α-L-吡喃阿拉伯糖-齐墩果酸-28-O-α-L-吡喃鼠李糖-(1→4)-β-D-吡喃葡萄糖-(1→6)-β-D-吡喃葡萄糖苷,波谱数据与文献报道一致[15]。
化合物5:白色无定形粉末,Liebermann-Burchard和Molish反应均呈阳性。ESI-MS显示其准分子离子峰为m/z1243 [M+Na]+(正离子模式)和1219 [M-H]-(负离子模式),提示其相对分子质量为1220,结合NMR数据推断其分子式为C59H96O26,与化合物4相同。通过与化合物4对照,发现两者苷元部分的碳谱数据一致,确定化合物5的苷元亦为齐墩果酸,且同样为双糖链皂苷。按与化合物1相同的方法,对化合物5进行酸水解及衍生,经GC分析表明其糖基为D-Glc、L-Ara、L-Rha和D-半乳糖(D-Gal),组成比为2∶1∶1∶1。通过2D NMR分析归属了化合物5的所有碳氢信号,重要的1H-NMR(500 MHz,C5D5N-D2O=3∶1)信号如下:δH0.81,0.83,0.84,0.99,1.03,1.16,1.19(each 3H,s),1.64(3H,d,J=6.1 Hz,Rha H-6),3.09(1H,br d,J=13.1 Hz,H-18),3.18(1H,dd,J=11.2,5.0 Hz,H-3),4.88(1H,d,J=6.2 Hz,Ara H-1),4.92(1H,d,J=7.6 Hz,Gal H-1),5.12(1H,d,J=7.8 Hz,Glc Ⅲ H-1),5.37(1H,br s,H-12),5.68(1H,s,Rha H-1),6.14(1H,d,J=8.2 Hz,GlcⅠ H-1);13C-NMR数据见表2。根据HMBC谱分析,可确定苷元3位和28位的糖链分别为Rha(1→4)[Glc(1→2)]Ara-和Gal(1→6)Glc-。通过与文献报道对照[16],确定化合物5的结构为3-O-β-D-吡喃葡萄糖-(1→2)-[α-L-吡喃鼠李糖-(1→4)]-α-L-吡喃阿拉伯糖-齐墩果酸-28-O-β-D-吡喃半乳糖-(1→6)-β-D-吡喃葡萄糖苷,即已知化合物arboreaside D,两者波谱数据一致。化合物5为首次从红毛七属植物中得到。

表2 化合物2~5的13C-NMR数据(125 MHz,2~4 in C5D5N,5 in C5D5N-D2O=3∶1) Tab 2 13C-NMR data of compounds 2~5 (125 MHz,2~4 in C5D5N,5 in C5D5N-D2O=3∶1)

续表2
4 结果与讨论
类叶牡丹在全国分布较为广泛,其中,陕产红毛七作为重要的陕西七药(太白七药)之一,在陕西民间应用甚广,但有关其皂苷成分的报道并不多(进行皂苷成分研究的药材多来自黑龙江)。本课题组前期研究表明,陕产红毛七总皂苷有良好的抑制肿瘤细胞增殖的作用。为了从中发现抗肿瘤活性化合物,本研究对其皂苷类成分进行了较为系统的分离鉴定,共报道5个皂苷成分,包括4个已知化合物(其中1个为首次从红毛七属植物中发现)和1个新化合物。新化合物为羽扇豆烷型三萜皂苷,而目前从红毛七中发现的50余个三萜皂苷其苷元均为齐墩果烷型,这是否可证明不同产地的红毛七存在成分的差异,值得进一步探讨。在研究中发现,陕产红毛七含有种类丰富的皂苷成分,可能还存在一些新化合物,将进一步对其进行更深入的化学和药理活性研究,为其开发和利用提供科学依据。
