CEUS联合定量分析技术用于鉴别甲状腺良恶性结节的价值
2021-12-30江振雄张娟娟陈晓杰
江振雄 张娟娟 陈晓杰
甲状腺结节是发生在甲状腺内的肿块,结节有良性和恶性分类,可通过手术切除结节治疗,但恶性肿瘤可有淋巴结转移,在早期通过检查确诊结节的良恶性程度是关键。临床常规应用超声检查甲状腺结节,利用超声成像技术显示结节内部形象,但常规超声图像不同性质结节的表现差异的特异性低,对于诊断甲状腺结节良恶性质的准确度较低[1]。超声造影(CEUS)属于增强影像学检查的一种,检查无辐射,费用相对较低,且造影剂的安全性高,临床多用于肝脏、乳腺的良恶性肿瘤诊断,其通过外周静脉注入超声造影剂后,再利用超声观察结节的影像表现,可第一时间对病灶性质进行判断,且可以连续观察,并应用时间-强度曲线(TIC)观察不同结节的参数[2],可能会有助于诊断良恶性结节的性质,提高诊断价值。故本研究将分析CEUS联合定量分析技术应用在甲状腺良恶性结节中的诊断价值,现将结果报道如下。
1 资料与方法
1.1 一般资料
选择2019年10月-2020年12月于本院行超声检查的100例甲状腺结节患者(共计136个结节,其中病理检查结果:良性96例,恶性40例)。纳入标准:(1)患者颈前不适感,甲状腺肿大或扪及肿块;(2)无甲状腺癌变;(3)未合并其他恶性肿瘤。排除标准:(1)结节>5 cm;(2)甲亢或甲减;(3)甲状腺炎。本试验设计已通过本院伦理学委员会审核,研究符合《赫尔辛基宣言》,患者签订知情同意书。其中男68例,女32例,年龄48~62岁,平均(55.20±4.73)岁;结节直径0.5~4.5 cm,平均(2.65±0.45)cm。
1.2 方法
常规超声检查:应用西门子SNOLINE二维超声扫查甲状腺,观察病灶的位置、外形、大小等,以及与相邻周围组织关系,观察病灶内血流情况。
患者取仰卧位,应用超声诊断仪(迈瑞Resona7)进行超声检查,超声检查前先肉眼观察和触诊颈部甲状腺情况,建立静脉通道,应用声维诺六氟化硫微泡(意大利Bracco公司)造影剂,将声维诺加入5 ml的生理盐水混合均匀,经静脉团注1.5~2.0 ml的造影剂混悬液,进行CEUS检查,采用实时成像技术,机械指数:0.04~0.06,探头频率:5~9 MHz。图像尽可能显示出结节全貌及周围组织,保持探头不动,在检查时嘱咐患者平静呼吸,尽量避免吞咽动作,实时储存动态造影的全过程图像,后续进行图像处理分析。
随后分析CEUS的增强模式,以不均匀低强度为甲状腺恶性结节的诊断标准,同时分析良恶性结节的时间-强度曲线,与周围组织做对比,提取造影剂开始增强时间(AT)、峰值强度(PI)、曲线下面积(AUC)、峰值时间(TTP)参数,并进行对比。
超声结果由两名5年以上的超声主治医生独立分析,对于有争议的病例通过讨论的方式得出一致结论。所有患者均在手术中取结节组织行病理检查。
1.3 观察指标及评价标准
记录两组甲状腺良恶性结节增强模式、CEUS诊断甲状腺良恶性结节结果和效能、甲状腺良恶性结节TIC参数,并进行对比。
结节增强模式:观察病灶区与周围组织参考区增强程度的差异,增强模式:(1)无增强,造影剂未进入病灶或仅有少许点状和结节状增强;(2)早期低增强,病灶区增强达峰值强度之前低于参考区,晚期的增强强度或峰值强度与参考区基本一致;(3)低增强,病灶区增强强度低于周围参考区强度;(4)等增强,病灶区增强程度与参考区强度无明显差别;(5)高增强,病灶区增强强度早期高于周围参考区,晚期与参考区基本一致或稍高。
CEUS诊断甲状腺良恶性结节结果和效能:记录CEUS诊断甲状腺良恶性结节结果,并计算诊断效能,敏感度=真阳性/(真阳性+假阴性)×100%,准确度=(真阳性+真阴性)/总例数×100%,特异度=真阴性/(真阴性+假阳性)×100%,阳性预测值=真阳性/(真阳性+假阳性)×100%,阴性预测值=真阴性/(真阴性+假阴性)×100%。
甲状腺良恶性结节TIC参数对比:将存储的动态图像进行定量分析,设置感兴趣区,选择结节内与相邻同样深度甲状腺实质对比观察,造影剂增强效果随时间的分布通过时间-强度曲线来反映,通过反映造影剂团注稀释原理的伽马曲线模式进行曲线拟合,获得AT、TTP、PI、AUC数据。
1.4 统计学处理
本研究数据采用SPSS 20.0统计学软件进行分析和处理,计量资料以(±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,等级资料用秩和检验,采用Z检验,P<0.05为差异有统计学意义。
2 结果
2.1 甲状腺良恶性结节增强模式对比
甲状腺良恶性结节的增强模式比较差异有统计学意义(P<0.05),见表1。

表1 甲状腺良恶性结节增强模式对比[例(%)]
2.2 甲状腺良恶性结节TIC参数对比
恶性结节TIC参数的AT、PI、AUC低于良性结节(P<0.05),良恶性结节TIC参数的TTP对比,差异无统计学意义(P>0.05),见表2。
表2 甲状腺良恶性结节TIC参数对比(±s)
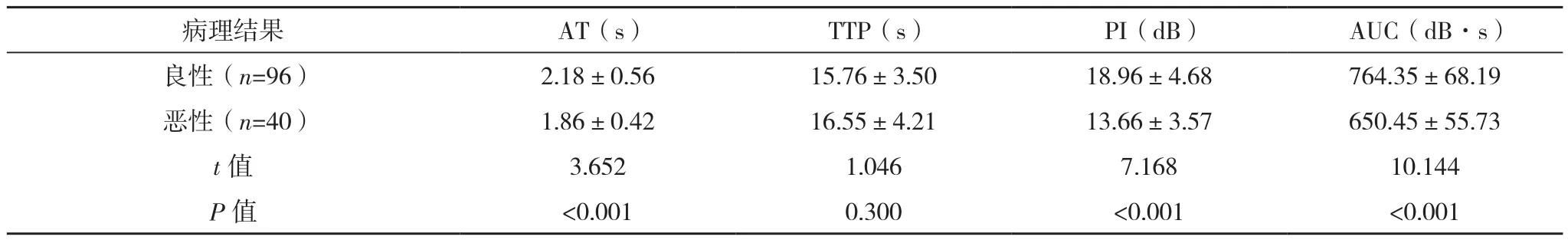
表2 甲状腺良恶性结节TIC参数对比(±s)
注:良性结节包括结节性甲腺肿+腺瘤,恶性结节为乳头状癌。
病理结果 AT(s) TTP(s) PI(dB) AUC(dB·s)良性(n=96) 2.18±0.56 15.76±3.50 18.96±4.68 764.35±68.19恶性(n=40) 1.86±0.42 16.55±4.21 13.66±3.57 650.45±55.73 t值 3.652 1.046 7.168 10.144 P值 <0.001 0.300 <0.001 <0.001
2.3 两种检查方法诊断甲状腺良恶性结节结果和效能对比
CEUS联合定量分析技术诊断甲状腺恶性结节的敏感度、准确度、特异度、阳性及阴性预测值均高于超声检查(P<0.05),见表3、表4、表5。

表3 常规超声诊断甲状腺良恶性结节结果(例)
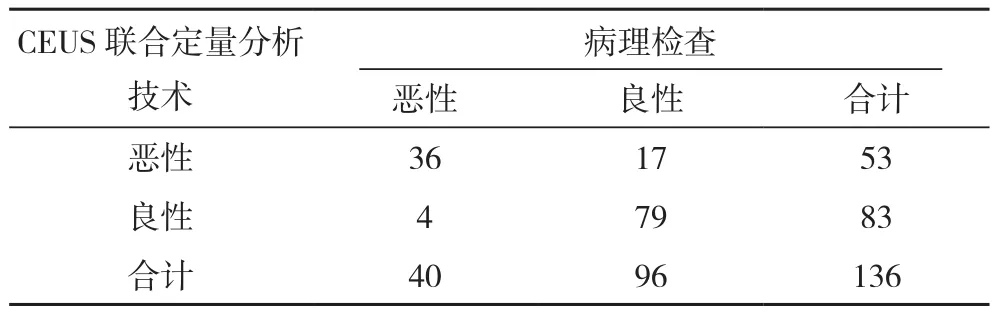
表4 CEUS联合定量分析技术诊断甲状腺良恶性结节结果(例)

表5 两种检查方法诊断恶性结节效能对比(%)
3 讨论
超声多从结节的边界、形态、彩色多普勒血流等信息判断是否侵犯或转移至邻近组织,并判断结节的良恶性,其虽可动态显示结节的微循环灌注,但超声检查下见甲状腺良性结节的血供丰富,而恶性结节的血供相对较少,而甲状腺结节的病理类型较多,且过程复杂,良性与恶性结节的超声表现会有相似的现象,血供特点存在一定混淆,对于诊断诊断结节的性质有一定难度,导致诊断准确率及特异度较低[3]。已有研究表明,甲状腺良恶结节在造影剂进入血液后,造影剂进入血液的快慢、分布和增强强度均有不同的表现[4],为深入分析良恶性结节的CEUS的区别,利用注射血管造影剂观察不同结节的增强表现,并应用TIC参数分析造影剂进入病灶的情况,可能会提高诊断早期甲状腺良恶结节诊断效能。
甲状腺内的血管丰富,CEUS通过向静脉注射造影剂,造影剂在进入正常的甲状腺组织内的血管后呈现均匀、一致性增强,当甲状腺内有结节时,造影剂因微血管增多使得灌注状态改变,可与正常组织的增强表现区别开来[5-6]。且造影剂的气-液界面可增强血流信号,提高肿瘤处血管的显示率,并实时反映造影剂在病灶血管内的动态分布过程和病灶周围血管的分布情况,反映肿瘤血管的形态学特征[7]。
本研究中,甲状腺良恶性结节的增强模式比较差异有统计学意义(P<0.05),恶性结节TIC参数的AT、PI、AUC低于良性结节(P<0.05),两组TIC参数的TTP对比差异无统计学意义(P>0.05),CEUS联合定量分析技术诊断甲状腺恶性结节的敏感度、准确度、特异度、阳性及阴性预测值均高于超声检查(P<0.05),说明CEUS联合定量分析技术可通过观察不同性质结节的增强模式和分析TIC参数,提高诊断甲状腺结节性质的效能。因甲状腺的造影表现与结节的病理变化密切相关,结节性甲状腺肿无纤维包膜,血流状态与周围甲状腺组织较相似,故表现为均匀等增强或高增强。而恶性结节多为囊性乳头状癌,癌组织内多含大量沙砾体,其声像图特征以无回声区内伴沙砾样回声,新生血管相较于良性病变新生血管内皮细胞分化差,细胞间连接松散,基底膜完整性差,故增强模式以早期低增强和低增强为主[8]。
CEUS通过观察不同性质结节的增强模式判断病灶的良恶性程度,因良性病变结节主要是甲状腺肿,其病理改变是滤泡上皮增生性病变、组织的反复增生修复形成结节,还可出现囊性变和钙化灶,可导致造影剂分布不均匀,无明显供血,造影增强可与甲状腺癌发生混淆,可有误诊情况出现[9-10]。良性结节表现为低增强的是与结节所处的病变时期相关。因肉眼观察病灶的增强程度或时间会受医生主观判断的影响,借助定量分析软件可将造影剂随时间变化的特征通过TIC表现出来,并得到相关参数,恶性结节多见于甲状腺乳头状瘤,结节可有微小癌栓,可导致微血管管腔狭窄,故造影剂进入缓慢,AT短,PI、AUC低,TTP对比差异无统计学意义(P>0.05),可能与结节的病变时期有关。提高诊断甲状腺良恶性结节的效能,此研究结果与国内塔娜等[11-12]学者的研究相符合。
综上所述,CEUS联合定量分析技术可通过观察不同性质结节的增强模式和分析TIC参数以鉴别甲状腺结节的良恶性质,诊断价值较高。
