抑郁症治疗前后C反应蛋白水平的变化及与临床疗效的关系*
2021-12-30张喜梅李献云兰志敏石夏明张房昉王智雄霍雪华
张喜梅 李献云 兰志敏 石夏明 张房昉 王智雄 霍雪华
抑郁症是一种常见精神障碍,具有发病率高、治愈率低、复发率高、致残率高、疾病负担重的特点,抑郁症的发病率呈现逐年增高趋势,就疾病负担而言,目前抑郁症在中国已成为除心血管疾病外第二大疾病。抑郁症发病机制还不十分清楚,可能涉及到多种易感基因、内分泌、免疫、自主神经功能、环境因素等。近十余年来不少研究聚焦于探索抑郁症与炎症反应的关系。C反应蛋白(C-reactive protein ,CRP)是一种较敏感的炎症标志物,其浓度与机体的炎症程度相关,比其他炎症标记物更能概括反映炎症激活的程度,且在临床简单易获取,目前有关CRP与抑郁症之间的关系仍不很明确,现有的研究结果各异[1~8]。且有研究报道基线CRP水平可以预测抗抑郁药反应[9]。目前国内探讨CRP与临床疗效相关性的研究较少,本研究旨在通过对抑郁症患者治疗前后血清超敏C反应蛋白(hs-CRP)的变化以及与临床疗效的相关性,以进一步探索血清CRP与抑郁症的关系,并为以后寻找预后评估的生物学指标、实施个体化治疗作一定的铺垫。
1 对象与方法
1.1 对象 研究组来自北京回龙观医院2016年3月~2017年9月临床1~5科住院抑郁症患者。入组标准:(1)入院时根据国际疾病分类第10版(ICD-10)精神与行为障碍分类诊断要点,三级查房临床确诊为抑郁症(包括首发和复发);(2)年龄18~65岁。排除标准:(1)伴有其他精神障碍、神经系统疾病;(2)自身免疫性疾病,或在研究前6个月内有任何主动或被动免疫;(3)近2周内有过任何感染,或使用糖皮质激素、非甾体类抗炎和免疫抑制药物;(4)怀孕或哺乳期妇女;(5)伴有糖尿病、冠心病史、甲状腺功能紊乱,或有糖尿病、冠心病家族史阳性患者;(6)药物、酒精或物质滥用者;(7)住院期间或出院时更改诊断的;(8)住院不满6周;(9)入院时hs-CRP数据缺失,符合入组标准抑郁症患者230例,排除共病精神发育迟滞2例,合并诊断感冒4例,冠心病或冠心病家族史11例,糖尿病或糖尿病家族史 52例,然后收集这些患者数据,排除6例入院时化验有甲状腺功能异常,48例入院hs-CRP数据缺失,再排除住院时间不满6周患者7例,住院期间更改为诊断9例(6例更改为双相情感障碍,3例更改为精神分裂症)。最后共纳入抑郁症患者91例,其中男30例,女61例;平均年龄(41.46±15.89)岁,起病年龄(34.56±14.41)岁,总病程3.10年(0.50,11.00)。所有抑郁症患者病历记载目前均为重度发作,出院疗效的评估均为好转或治愈。对照组来自2016年北京回龙观医院在职职工体检数据。入组标准:(1)无严重躯体疾病;(2)年龄18~60岁;(3)无精神疾病史及精神疾病家族史。排除标准:同研究组患者。共纳入82名,其中男27名,女55名;平均年龄(41.21±11.06)岁。两组性别、年龄比较差异均无统计学意义(P>0.05)。所有入组对象均签署知情同意书,本研究经北京回龙观医院伦理委员会批准。
1.2 方法
1.2.1 临床资料的收集 通过电子病历系统收集患者入院时及出院前后 2周内CRP水平,并提取性别、入院时年龄、起病年龄、总病程、用药资料。疗效的评估取自出院病历中两名主治医师以上人员对出院疗效的评估。
1.2.2 血清hs-CRP水平的检测 于清晨6:00~7:00抽取空腹静脉血5 ml,分离血清,检测工具为BeckmanCoulter全自动生化分析仪(型号为AU5800),采用超敏乳胶免疫比浊法测定。剂量单位为μmol/L。
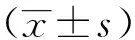
2 结果
2.1 两组治疗前后hs-CRP水平比较 对照组hs-CRP水平为1.23 μmol/L (0.56,2.82),研究组急性期hs-CRP水平为0.56 μmol/L (0.20,1.90),治疗后缓解期hs-CRP水平为1.40 μmol/L (0.45,3.10)。研究组急性期hs-CRP水平低于对照组(Z=-2.411,P=0.016),治疗后缓解期hs-CRP水平与对照组比较差异无统计学意义(Z=-0.84 ,P= 0.399 )。见图1,图2。研究组缓解期hs-CRP水平较急性期升高(Z=-3.375,P=0.001)。

注:研究组急性期hs-CRP水平低于对照组(P<0.05)

注:研究组缓解期与对照组hs-CRP水平比较差异无统计学意义(P>0.05)
2.2 与抑郁症疗效相关的可能因素 将研究组按照疗效分成好转组和治愈组,将两组患者的起病年龄、病程、hs-CRP水平进行比较,结果发现,两组患者性别构成比、起病年龄、病程、急性期hs-CRP水平的差异均无统计学意义(P>0.05)。见表1。同样,以性别进行分组然后统计分析,组间比较发现不同性别的抑郁症患者疗效也与急性期hs-CRP水平无相关性(P>0.05)。见表2。

表1 两组一般资料及急性期hs-CRP的比较

表2 不同性别中两组急性期hs-CRP的比较
3 讨论
抑郁症的发病机制目前还不完全清楚,近年来很多研究者提出了抑郁症发病机制中的炎症假说,该假说认为激活免疫反应系统是情绪障碍背后的驱动力[10],炎症反应通过活化吲哚-2,3-双加氧酶(IDO),能促进色氨酸合成犬尿氨酸,从而导致色氨酸的降解增加,而色氨酸是合成血清素和褪黑素的前体[11],另外犬尿氨酸(KP)通路活性增加,大量生成的犬尿氨酸则通过犬尿氨酸氨基转移酶代谢生成N-甲基-D-天冬氨酸(NMDA)受体拮抗剂-犬尿喹啉酸,影响NMDA的神经保护作用[12]从而导致抑郁的发生。
CRP是一种急性时相反应蛋白,在细胞因子(如IL-1、IL-6等)的促激下由肝脏合成,机体在免疫激活状态时,CRP水平升高。在急性时相反应中,血浆中CRP水平与炎症出现和严重程度具有高度相关性,因此被公认为是一种炎症反应生物标志物。
本研究结果发现研究组急性期hs-CRP水平低于健康对照,与既往一些研究[7, 8]结果一致,但更多的研究是相反的结果[3, 4, 13~18],也有研究认为抑郁症与CRP水平之间并没有关联[6, 19~21]。结果不一致的原因可能有研究方法的差异(比如控制变量的差异)或者样本差异,样本的差异通常与抑郁症本身的异质性大有关,可能炎症仅仅与抑郁症的某些特定的亚型(如迟滞性抑郁[14]、非典型抑郁[22])有关,也就是说免疫激活并非在抑郁症中普遍存在,可能只在抑郁症的某些特定亚型中扮演了一定的角色。有研究发现给予使用抗炎药Infliximab治疗抑郁症,只对高水平CRP患者有效,而CRP水平低者无效[23],这一结果也提示抑郁症可能分多种亚型,且只有部分亚型与机体内的炎症反应有着密切的关系。因此,抑郁症可能更多表现为免疫紊乱,而非免疫激活,也可能是免疫抑制。
纵向分析结果发现,研究组治疗前后hs-CRP水平比较差异有统计学意义,治疗后hs-CRP水平高于治疗前,且治疗后hs-CRP水平与健康对照组比较差异无统计学意义,治疗后hs-CRP水平的变化是药物的影响还是疾病状态(急性期、缓解期)的变化或者症状严重程度的改变所致,有待于进一步研究。
目前抑郁症治疗面临的问题:现有抗抑郁治疗仅能对大约2/3的患者起效,且存在起效缓慢和疗效难以预测的缺点,因此探索对治疗结局具有预测作用的生物学标记研究就具有特别重要的临床意义。有研究发现:促炎症标志物CRP水平增加与抗抑郁药治疗反应较差,包括治疗抵抗相关[24],更有研究认为高水平CRP可作为一种抗抑郁药治疗反应差的预测因子[25]。乔娟等[15]研究发现,高水平CRP是难治性抑郁症的风险因素。但本研究并未发现疗效与患者基线hs-CRP水平的相关性。另外,考虑到抑郁症是一个高度异质性疾病,性别可能是异质性的一个重要来源,且有研究发现抑郁症和CRP之间的关联与性别有关[19, 20, 26],因此本研究进一步进行性别的分层分析,结果无论是男性还是女性患者依然未发现疗效与基线CRP水平的相关性。结果差异的原因,一方面可能是本研究的疗效只是临床大致评估,主观因素及其他干扰因素(如科室治愈率指标要求等)较大,缺乏量表评分的客观依据;另一方面,抑郁症的发病机制复杂,目前抗抑郁药的疗效主要针对生物胺假说,影响疗效的因素也是异常复杂,因此疗效与CRP水平之间的关系也是错综复杂的。或许CRP水平只可预测部分患者对不同药物的疗效,对此需要进一步深入研究。
本研究缺陷:没有考虑更多的混杂因素,如生活方式(吸烟、过度饮酒、体力活动等)、体质量指数等对CRP水平的影响;另外,本研究为回顾性调查,缺少患者临床症状的评估,且抑郁症为高度异质性疾病,抑郁症疾病的病因、类型、严重程度、临床症状特点等均是异质性的来源,因此为进一步明确CRP水平与抑郁症关系,未来研究应加大样本量,着眼于前瞻性研究,并对抑郁症患者进一步亚型分类(比如是否伴有精神病性症状、是否伴有躯体症状、首发还是复发等)、纵向分期,同时对服用药物进行分组,控制混杂因素,以进一步探讨CRP水平与抑郁症的临床特征、疗效的评估和预测、用药、疾病严重程度等的关系,这也是为探索CRP水平能否作为一种外周生物学指标给抑郁症的临床评估、个体化用药以及炎症通路未来作为难治性抑郁治疗可能的途径提供一定的理论依据。
