1 470 nm裸光纤二极管激光器治疗病理性瘢痕的临床研究
2021-12-30孟心娴崔春晓濮哲铭张艳冯少清苏薇洁李华喜雯婧闵沛如张铮许恒李科章一新
孟心娴 崔春晓 濮哲铭 张艳 冯少清 苏薇洁 李华 喜雯婧 闵沛如 张铮 许恒 李科 章一新
病理性瘢痕是创伤后创口异常愈合、皮肤组织过度增生的结果,主要包括增生性瘢痕和瘢痕疙瘩。病理性瘢痕主要以持续的炎症状态、血管新生、成纤维细胞过度增殖、胶原过度生成、细胞外基质过度沉积为特点。临床上,瘢痕疙瘩与增生性瘢痕的不同点在于家族史、好发部位、病程及临床表现上。增生性瘢痕的发生一般无明显家族史;常出现于张力较大的区域(例如胸骨前、关节周围等);病程较短,在创伤后数月内迅速增长形成;基底部多局限于原始损伤界限内。瘢痕疙瘩则主要出现于有色人种,常有家族史;常见于耳垂、肩部和胸部等;病程较长,可在创伤后数年内持续增生;增生范围常超过原始损伤界限,可向周围正常组织浸润[1-2]。此外,瘢痕疙瘩具有更明显的临床症状,常有局部疼痛或瘙痒。病理性瘢痕的常见致病因素包括皮损、烧伤、术后创口、注射后创口和皮炎等,其中烧伤引起的瘢痕最为常见[3-4]。
目前,临床上针对病理性瘢痕存在多种治疗方式,例如硅胶制剂、压迫治疗、糖皮质激素、抗肿瘤药物(如5-氟尿嘧啶)、冷冻疗法、激光剥脱、手术治疗和放射治疗等[5-6]。尽管疗法种类繁多,却尚无能够取得满意疗效的治疗方法。加压治疗、药物治疗、激光剥脱等非手术方法对于厚度大、质地硬的瘢痕效果甚微。这主要是由于病理性瘢痕的质地使得药物或激光光束在瘢痕中难以渗透、扩散[7]。治疗带来的不良反应(如疼痛、溃疡、色沉等)也是另一亟待解决的问题[8]。此外,病理性瘢痕治疗也有着较高的复发率,其中瘢痕疙瘩治疗的复发率约为50%~80%,增生性瘢痕的复发率约为10%[9]。因此,病理性瘢痕的治疗仍是目前整形外科的一大挑战。
前期研究证明,1 470 nm二极管激光器能够通过光热和光选择作用,在较小范围内使组织水分迅速气化,促使组织坏死凝固,从而实现组织消融和炎症控制。1 470 nm激光也可凝固血管、减少瘢痕血流灌注,帮助瘢痕迅速减容[10-11]。此外,本研究中1 470 nm激光采用光纤输入,激光深入瘢痕内部的同时,只在皮肤表面形成微创损伤。本中心既往研究发现,1 470 nm裸光纤二极管激光器应用于炎症和感染的瘢痕疙瘩可较好控制感染[12]。
本研究在前期研究基础上,采用单中心前瞻性队列研究,旨在评估1 470 nm裸光纤二极管激光器用于瘢痕减容的有效性和安全性,为1 470 nm裸光纤二极管激光器在临床上的进一步应用提供依据。
1 资料与方法
1.1 临床资料
选取2020年5月至2021年5月于上海交通大学医学院附属第九人民医院整复外科门诊就诊的病理性瘢痕患者31例(47处),男性19例,女性12例,年龄3~66岁(平均28.1岁)。病灶位置包括胸部(n=12)、背部(n=14)、大腿(n=3)、肩部(n=7)、足背(n=3)、手臂(n=2)和其他区域(n=6)。平均瘢痕大小为217.03 cm2(18~1 063.5 cm2)。
1.2 入选标准
纳入标准:①继发于皮损的病理性瘢痕;②经其他非手术方法治疗(如硅胶制剂、糖皮质激素等)效果不佳的顽固性瘢痕;③瘢痕面积大于10 cm2;④由灼伤、创伤、手术、昆虫叮咬或痤疮引起。
排除标准:①既往接受过浅层X线放射治疗;②有过手术干预史;③曾接受过激光治疗;④合并基础疾病;⑤接受免疫抑制药物或患有自身免疫疾病;⑥不能遵循治疗方案的患者。
本实验参考赫尔辛基宣言(1964年)和随后的修改设定的标准进行。本研究获上海交通大学医学院附属第九人民医院伦理审查委员会批准。临床试验注册号:ChiCTR2000038092(http://www.chictr.org/en/),最新更新为2020-10-19。每位患者(或监护人)均知情同意。
1.3 治疗方法
1.3.1 病例分组
本研究共纳入31例患者,分两组:增生性瘢痕组(n=14),男女各半,平均年龄21.14岁;瘢痕疙瘩组(n=17),男13例,女4例,平均年龄35.64岁。
1.3.2 1 470 nm光纤激光治疗
所有患者完成术前评估后,于全麻或局麻下接受1 470 nm激光治疗。选用激光治疗仪LASEmaR 1500(意大利EUFOTON公司),激光能量通过直径为300 μm的一次性光纤传输。光纤深入瘢痕内部实现瘢痕消融。根据患者瘢痕硬度及厚度,功率选择4~6 W。治疗每1~2个月重复1次,直至获得医患双方均满意的结果。
1.4 观察指标
1.4.1 主观评估
由经验丰富的独立评估人员,在每次治疗前后使用EOS700 D数码相机(日本佳能公司),在相同条件下采集瘢痕照片。利用温哥华烧伤瘢痕评估量表(Vancouver scar scale,VSS)进行评估,内容包括色素沉着(0~3分)、血流(0~3分)、硬度(0~5分)和厚度(0~4分)等4个部分,最后综合计算得分[13]。收集患者术后出现的相关不良反应,包括疼痛、溃疡和瘙痒等。
1.4.2 客观评估
①瘢痕厚度,使用多普勒超声DP-6600数字超声诊断成像系统(深圳迈瑞生物医疗电子股份有限公司)测定瘢痕厚度。②瘢痕硬度,使用皮肤弹性测试仪Cutometer dual MPA580(德国CK公司)评估瘢痕硬度。皮肤弹性测试仪检测基于吸力和伸展的原理,在被测试表面产生负压(500 mbar)将皮肤吸至特定探头中,并使用光学系统估算皮肤被吸入的深度[14]。③瘢痕色沉,利用皮肤黑色素及红斑检测仪Mexameter MX 18(德国CK公司)对瘢痕色素沉着进行检测。该设备基于光谱吸收原理,通过测定特定区域对特定波长光的反射与吸收来测定黑色素含量,结果以黑色素指数表示[14]。④瘢痕血流测定,使用激光散斑血流灌注成像仪 PeriCam PSI(瑞典Perimed公司)和Mexameter MX 18(德国CK公司)检测瘢痕的血液供应的变化。PeriCam PSI系统利用785 nm的激光波长,基于激光散斑对比分析(Laser speckle contrast analysis,LASCA)技术,实现实时血流动态成像监测[15]。Mexameter MX 18则通过光谱吸收原理测定血红蛋白量,结果以红斑指数表示[14]。
检测方法:沿瘢痕长轴选取近端1/3、中点、远端1/3等3个测量点,分别进行上述测量,重复3次取平均值。然后计算3个检测点的平均值,作为瘢痕的整体评价结果。
1.5 统计学处理

2 结果
2.1 一般情况
31例患者均完成本研究,无退出病例。患者平均治疗次数为1.39(1~3次)。平均单次治疗能量为4 481.22 J(388~17 536 J),平均单次治疗功率为4 W(3~6 W)。平均随访时间为7.2个月(6~12个月)。
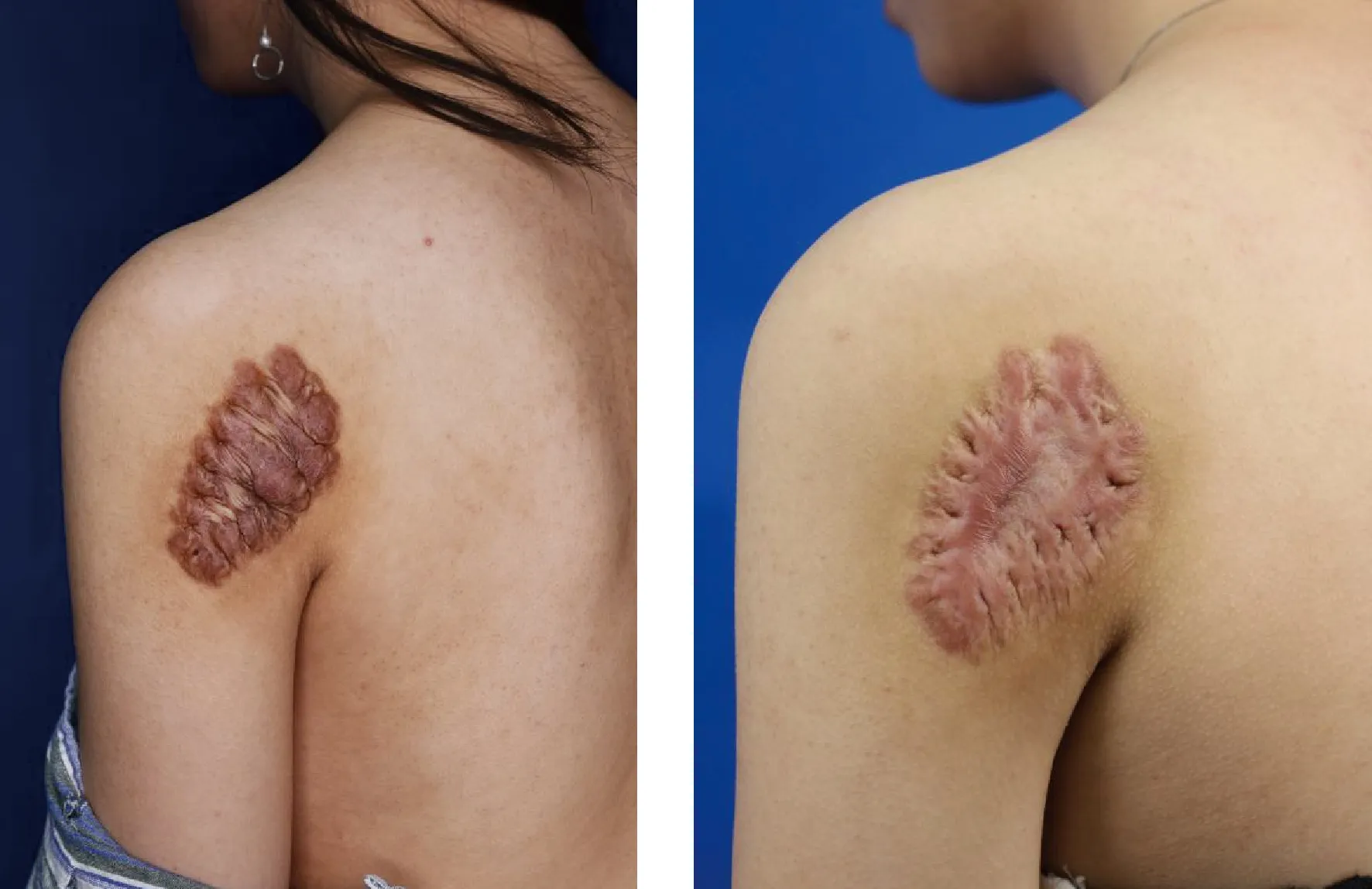
左:治疗前;右:治疗1年后Left: Before treatment; Right: 1 year after laser treatment图1 典型病例:肩部瘢痕疙瘩接受光纤治疗Fig. 1 Typical case: keloid on shoulder treated by 1 470 nm diode laser
2.2 客观评估(图2)
瘢痕厚度检测发现,治疗后6个月时瘢痕厚度平均减少(0.2±0.153)cm(P<0.001)。其中,增生性瘢痕厚度减少21.66%(P<0.001),瘢痕疙瘩减少21.5%(P<0.001)。

A:瘢痕厚度;B:瘢痕硬度;C:黑色素指数;D:血流变化。A: Thickness; B: Firmness; C: Melanin index; D: Perfusion.图2 病理性瘢痕治疗前后客观指标评价Fig. 2 Objective evaluation of pathological scars before and after treatment
瘢痕硬度检测选用R0与Q0两个指标(R0和Q0可综合表示弹性变形能力,两者与皮肤硬度成反比)。治疗后,R0上升了0.016±0.053(0.89%,P<0.05),Q0上升了1.576±8.556(0.43%,P<0.05),提示瘢痕的硬度得到了改善。其中,增生性瘢痕硬度指标改善程度更明显。增生性瘢痕R0上升1.74%(P<0.05),Q0上升0.72%(P<0.05)。而瘢痕疙瘩R0与Q0只分别改善0.27%(P=0.06)与0.15%(P=0.61),无明显统计学意义。
光纤治疗对于瘢痕色沉改善有限,利用Mexameter检测病灶黑色素指数。治疗前为251.413±157.716,治疗后6个月时为234.349±90.708,差异无统计学意义(P=0.308)。瘢痕疙瘩组色沉改善效果优于增生性瘢痕组,较治疗前改善达10.04%(P<0.05)。
瘢痕血运在治疗前后有明显改善。PeriCam PSI检测显示血流灌注量减少了27.418±10.274(P<0.001),Mexameter检测红斑指数减少了14.099±20.669(P<0.001)。其中,增生性瘢痕的血流灌注显著降低28.6%,红斑指数降低3.37%(P<0.001),瘢痕疙瘩中的血流灌注显着降低20.4%,红斑指数降低3.17%(P<0.001)。
2.3 主观评价(图3)
利用VSS评分总体评价病灶色素沉着、血流、硬度和厚度。结果表明,1 470 nm光纤治疗可显著减少血液供应,减少厚度并减轻病灶的硬度。增生性瘢痕组的总VSS评分改善了44%,瘢痕疙瘩组的总VSS评分改善了37.5%(P<0.001)。

A:色素沉着;B:厚度;C:血流;D:硬度。A: Pigmentation; B: Height; C: Vascularity; D: Pliability.图3 病理性瘢痕接受光纤治疗前后VSS评分Fig. 3 VSS score of pathological scars before and after treatment
2.4 不良事件
术后主要不良反应为疼痛、局部肿胀以及瘢痕组织坏死。术后疼痛发生率为85.71%,持续时间(2.19±0.75)d,疼痛程度评分为4.19±1.23,所有患者在治疗后均发生局部肿胀,均可在1周左右消退。局部瘢痕组织坏死率为28.57%,愈合时间为(24.83±12.05)d。治疗后部分病例出现一过性色素沉着,但3个月后可自行消退。所有病例中均未出现瘢痕加重或感染。
3 讨论
由于病理性瘢痕的发病机制尚未完全明确,所以仍缺乏确切的根治方法,治疗后复发率高。针对性的治疗方式不断被提出[7-8,10-12],其中,激光已成为治疗增生性瘢痕的重要手段。1983年,Castro等[16]首次应用Nd∶YAG激光治疗瘢痕,并提出激光能对病理性瘢痕起到有效防治作用。之后,点阵CO2激光(10 600 nm)与脉冲激光分别被用于选择性抑制瘢痕胶原蛋白的产生[17]及瘢痕血运[18],从而抑制瘢痕增生。然而,随后的研究表明,针对较厚较硬的病理性瘢痕,传统激光疗效有限,且不良反应较多。更有研究提示,在治疗后1年的随访中[17,19],瘢痕疙瘩的生长没有受到显著抑制。
1 470 nm光纤二极管激光是一种新兴的激光手段,使用激光二极管系统LASEmaR 1500作为激光能量源,能量通过直径为300 μm的裸光纤传输。在光纤的定向引导下,激光可深入组织内部2~3 mm[20]。此外,该激光器波段接近水的光谱吸收峰值,可产生大量热量使周围组织中水分迅速蒸发,局部细胞溶解、组织坏死,实现靶向性组织消融。
此类光纤激光器目前在其他学科中已有应用,如静脉曲张[21-22]、前列腺增生[10-11]、鼻甲肥大[23]、肛门直肠瘘[24]以及淋巴水肿的治疗等[25]。本中心首次将这种技术用于瘢痕治疗[12],并评估了其在治疗病理性瘢痕中的有效性和安全性。我们的前期研究表明,1 470 nm激光可以有效改善感染瘢痕的炎症状况,减少瘢痕局部的血流灌注。
Albergel等[26]的研究表明,病理性瘢痕会产生过量的胶原蛋白(主要为Ⅰ和Ⅲ型)和细胞外基质,形成纤维化条索,是瘢痕较硬、较厚的主要原因。Miles等[27]提出,三螺旋结构在胶原的稳定中极为重要。当胶原蛋白被加热后,三螺旋结构被破坏,胶原蛋白的拉伸强度和黏弹性从而被改变。研究显示,胶原蛋白的变性温度为60~70 ℃,碳化温度则高于200 ℃[28],而光纤尖端周围组织的温度可达100~200 ℃,这为光纤治疗瘢痕提供了理论支持[29]。本研究结果显示,在进行光纤激光治疗后,瘢痕的硬度有了一定程度的降低(P<0.05),这提示光纤的热效应的确可以导致瘢痕胶原蛋白收缩和变性,从整体上改善瘢痕组织的质地。然而,增生性瘢痕组硬度改善程度高于瘢痕疙瘩,且瘢痕疙瘩组硬度改善无明显统计学意义。这提示质地改善的程度可能与瘢痕本身的硬度有关。瘢痕疙瘩相较于增生性瘢痕增生更为旺盛,这可能使其质地改善更为困难。未来可能可以通过多种激光手段联用,实现瘢痕疙瘩显著的质地改善。
激光治疗之后色素沉着或色素脱失是最常见的不良反应之一[30-31]。本研究发现,1 470 nm光纤激光疗法并未出现明显术后色沉,且长期随访结果显示,光纤治疗可以改善瘢痕疙瘩的色素沉着(减少了10.04%)。
病理性瘢痕呈现过度增生的状态,成纤维细胞过度增殖,胶原蛋白过度合成。Ogawa等[7,32]发现,在病理性瘢痕中,血管内皮生长因子水平以及血管密度均高于正常组织,提示病理性瘢痕的高代谢状态可能由其丰富的血供支持。本研究发现,治疗后6个月时,瘢痕血流灌注显著降低(P<0.001),褪红效果优于脉冲染料激光(治疗后1年观察到瘢痕血流减少)[33],这可能是由于光纤激光缩短了瘢痕的炎症期,从而加速了瘢痕成熟。
本研究尚存在一定的局限性。①样本量较小,且缺少对照组;②本研究中的部分主观结果,可能存在观察者偏倚;③由于瘢痕病灶不断减小,导致每次实际测量点不同④患者之间的随访次数和干预时间不同。上述不足可能会对结果产生潜在影响。
综上所述,1 470 nm光纤二极管激光器在瘢痕减容、改善瘢痕硬度、减少色沉和瘢痕血运等方面取得了令人满意的结果。今后的研究应聚焦于最佳治疗时机、最佳激光参数等。同时,今后或可与其他激光器或其他辅助疗法进行组合,尝试获得更好的治疗效果。
