Torin1、Nutlin-3a促进人诱导多能干细胞来源早期心肌细胞成熟的初步研究
2021-12-30陈颖杨礼宫艺其谭瑶王会景刘明璐卢婷婷罗润娇王伟付炜
陈颖 杨礼 宫艺其 谭瑶 王会景 刘明璐 卢婷婷 罗润娇 王伟 付炜
心血管疾病是全球范围造成死亡的主要原因。2019年超过1 850万人死于心血管疾病,占死亡人数的32.8%;2020年全球心衰患者估计为6 330万人,5年生存率与癌症相似[1]。治疗困难、缺乏有效的疾病模型等问题,限制了心血管疾病研究领域的进展。2006年,Yamanaka通过在成体细胞中过表达Oct4、Sox2、Nanog、KLF4等4个转录因子,将这些细胞转变成为了诱导多能干细胞(Human induced pluripotent stem cell,hiPSC)[2]。iPSCs避免了破坏胚胎获取胚胎干细胞存在的伦理问题,成为心肌细胞的理想来源。利用iPSCs可以进行心脏疾病模型、药物筛选、细胞治疗等一系列研究,极大推动了心脏疾病领域的研究。然而,hiPSC诱导的心肌细胞(Human induced pluripotent stem cell-cardiomyocyte,hiPS-CM)依然存在一些问题,比如成熟度低,更接近胎儿期细胞[3]。大量研究通过延长培养时间、细胞共培养、机电刺激、添加生物活性分子等方法,试图促进心肌细胞成熟[4],但是这些方法或过于复杂,或效果有限。因此,需要进一步研究以获得简单有效的促进iPSCs来源心肌细胞成熟的方法。
雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)是细胞生长和代谢状态的主要调节剂,可以响应营养物质、生长因子和许多细胞外信号[5]。mTOR在心脏中起着重要作用,mTOR信号的异常激活可导致病理性心脏肥大[6]。mTOR的抑制在心脏意外损伤时可起到一定的保护作用。研究发现,mTOR抑制剂雷帕霉素应用于心肌梗死中减少了细胞凋亡[7]。mTOR已被证明与其他类型细胞的成熟相关,包括红细胞、胰腺细胞和自然杀伤细胞[8-9]。然而,mTOR是否以及如何影响心肌细胞的成熟尚不清楚。胚胎发育过程中心脏的生长主要通过心肌细胞的增殖,然而心肌细胞在出生后不久就退出细胞周期,心脏生长主要是通过细胞体积的增大而不是细胞增殖来实现的[10]。研究表明,在小鼠早期发育过程中,胚胎内细胞团增殖需要mTOR,而出生后小鼠心脏中的mTOR表达水平非常低[11]。
已有研究证实,Torin1可以抑制mTOR通路并且上调p53,Nutlin-3a抑制Mdm2/p53相互作用和诱导p53上调,并抑制mTOR通路。我们尝试通过上调p53蛋白的表达,伴随mTOR通路的抑制,可能诱导细胞退出细胞周期,促进cTnT等心肌相关成熟标志物的表达,以期增加iPS细胞分化来源早期心肌细胞的成熟度。
1 材料与方法
1.1 实验试剂及仪器
TESR-E8培养基(Stemcell,加拿大),EDTA(Thermo,美国),Y-27632(Stemcell,加拿大),基质胶(Corning,美国),ACCUTASE消化酶(Stemcell,美国),RPMI1640(Thermo,美国),B27-INSULIN(Thermo,美国),CHIR99021(Stemcell,加拿大),心肌细胞消化液(赛贝,中国),流式细胞固定破膜液(Invitrogen,美国),cTnI抗体(Proteintech,美国),cTnT抗体(Proteintech,美国),p53抗体(Proteintech,美国),ki67抗体(Abcam,英国),α-actin抗体(Sigma,美国),TRIZOL(Thermo,美国),SYBR PCR试剂盒(Qiagen,德国),RT REAGENT KIT试剂盒(TaKaRa,日本),胰酶(Thermo,美国),双抗(Hyclone,美国),FBS(Bioind,以色列),DMSO(Sigma,美国),驴抗兔/鼠IgG二抗(Abcam,英国),DAPI(翊圣,中国),PCR引物订购于上海生工生物科技有限公司,4× Tris-HCl浓缩胶配胶缓冲液pH 6.8 0.5 mol/L、4× Tris-HCl浓缩胶配胶缓冲液pH 8.8 1.5 mol/L(生工,中国),Amersham Hybond P 0.45 PVDF(GE Healthcare,美国),non-fat powder milk(BBI Life Science,美国),Tris-Glycine-SDS缓冲液(生工,中国),10×印迹转膜缓冲液(生工,中国),Tween-20、TEMED、APS、10% SDS(Sangon Biotech,美国),PMSF、RIPA裂解液(强)、30% Acr-Bis(29∶1),5× SDS-PAGE蛋白上样缓冲液(碧云天,中国),Immobilon Western HRP底物(Merk,德国),Pageruler prestained protein ladder(Life Technologies,美国)。
流式细胞分析仪(FACSCantoTMFlow Cytometer,BD,美国),激光扫描共聚焦显微镜(TSC SP8,Leica,德国),倒置荧光显微镜(DMI3000B,Leica,德国),NanoDrop 2000(Thermo,美国),qPCR仪(CFX-Connect,BIO-RAD,美国),化学发光成像仪(Amersham Imager 600,美国)。
1.2 实验方法
1.2.1 细胞培养
hiPSC细胞系由上海儿童医学中心李彦欣教授课题组建系、鉴定,为脐带血细胞来源,捐献者签署了相关知情同意书。
在Matrigel铺板的6孔板中,使用TeSR-E8培养基进行hiPSCs的维持和扩增。
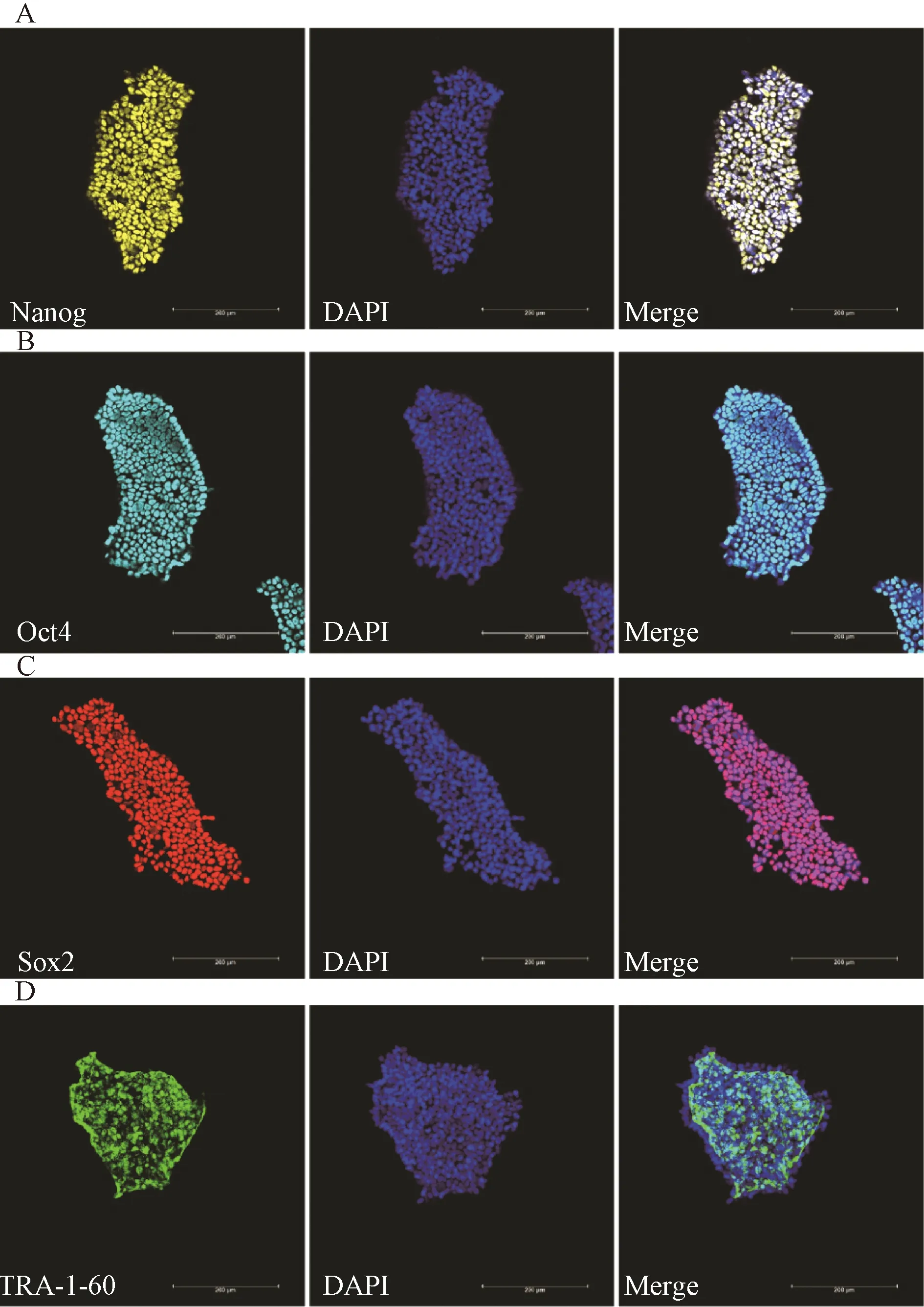
采用GiWi方案分化得到心肌细胞,具体流程为:分化前2 d,将iPS细胞以100万/孔的密度接种于12孔板上,分化第0天加入12 μmol/L CHIR99021(用B27-Insulin配制),2 mL/孔,36 h后吸弃,加入B27-Insulin培养基,2 mL/孔,分化第3天弃培养基,加入5 μM IWP2(用B27-Insulin配制),2 mL/孔,分化第5天吸弃,加入B27-Insulin培养基,分化第7天吸弃,加入B27+Insulin培养基,此后每2天换一次液。分化第9天细胞开始搏动。
将人诱导多能干细胞分化到第11天,即细胞开始跳动后2 d,作为起点,将实验分为3个组:DMSO组(阴性对照组);10 μmol/L Nutlin-3a处理24 h(Nutlin-3a组);200 nmol/L Torin1处理7 d(Torin1组),每2天换一次新鲜的培养基。
3T3细胞培养在6孔板中,30万/孔,用高糖DMEM(包含10%FBS)维持细胞生长,细胞生长至90%融合时以胰酶消化传代。将3T3细胞分为3个组:DMSO组(阴性对照组);10 μmol/L Nutlin-3a处理24 h(Nutlin-3a组);200 nmol/L Torin1处理3 d(Torin1组)。以30万/孔接种于6孔板上,24 h后分别加入DMSO、Nutlin-3a、Torin1,3 d后进行细胞学的相关鉴定。
1.2.2 免疫荧光实验
将细胞以合适的密度接种于共聚焦小皿上,继续培养24 h,待细胞贴壁后,吸去培养液,PBS清洗细胞,4%多聚甲醛固定15 min,0.5% Triton-100破膜通透5 min,5%BSA室温封闭2 h,一抗4 ℃孵育过夜,PBS漂洗3次,二抗室温避光孵育2 h,DAPI染色5 min后PBS漂洗3次,避光保存激光共聚焦显微镜下观察。
1.2.3 定量反转录聚合酶链式反应(Real-time quantitative PCR,qRT-PCR)
吸弃培养液,PBS清洗细胞,每孔加入1 mL细胞裂解液trizol,室温作用5 min,收集细胞,吹打混匀。用氯仿、苯酚等有机溶液提取RNA,用PrimeScript RT reagent Kit进行反转录,得到cDNA,具体操作参照试剂使用说明。使用SYBR Green PCR试剂和相关引物,在bio-rad CFX96实时热循环仪上完成RNA定量实验,以TBP(tata结合蛋白基因)作为管家基因,PCR引物序列如表1所示,依据2-ΔΔCt计算RNA相对表达量。
1.2.4 免疫蛋白印迹(Western blot)
用裂解缓冲液(RIPA、蛋白酶抑制剂混合物)裂解细胞,用BCA蛋白检测试剂盒测定总蛋白含量。将样品与loading混合,95 ℃变性10 min,将样品总蛋白量稀释至相同浓度,以同体积加入配制好的10%凝胶样品孔中,80 V电泳3 h,随后以200 mA、90 min转移到PVDF膜,用5%的脱脂牛奶室温封闭2 h,一抗在4 ℃下孵育过夜。然后用辣根过氧化物酶偶联二抗室温下孵育1 h。采用ECL Western blotting检测试剂盒以化学发光法检测蛋白信号,谱带密度使用AI600软件进行量化。
1.2.5 流式细胞分析技术
将106个3T3细胞在70%预冷乙醇中-20 ℃固定过夜,用Hoechst 33342和pyronin Y室温孵育30 min,用于区分G0、G1、S-G2-M期细胞,数据通过流式细胞分析仪器获取,并使用FlowJo进行分析。
1.2.6 膜片钳电生理技术
将细胞消化成单细胞,细胞计数后按2.5×105个/孔的密度将细胞种植在预先铺好基质胶的共聚焦小皿上,继续培养48 h至细胞完全贴壁。利用消化液消化细胞收缩变圆,随后通过灌流装置灌流10 min动作电位电极外液。选取单个完整心肌细胞作为记录细胞。当记录电极尖端与细胞膜表面形成高阻封接后,吸破细胞膜,补偿细胞膜电容,使用电流钳模式记录心肌细胞自发产生的动作电位。
1.3 统计学分析

2 结果
2.1 Torin1、Nutlin-3a对3T3细胞增殖的影响
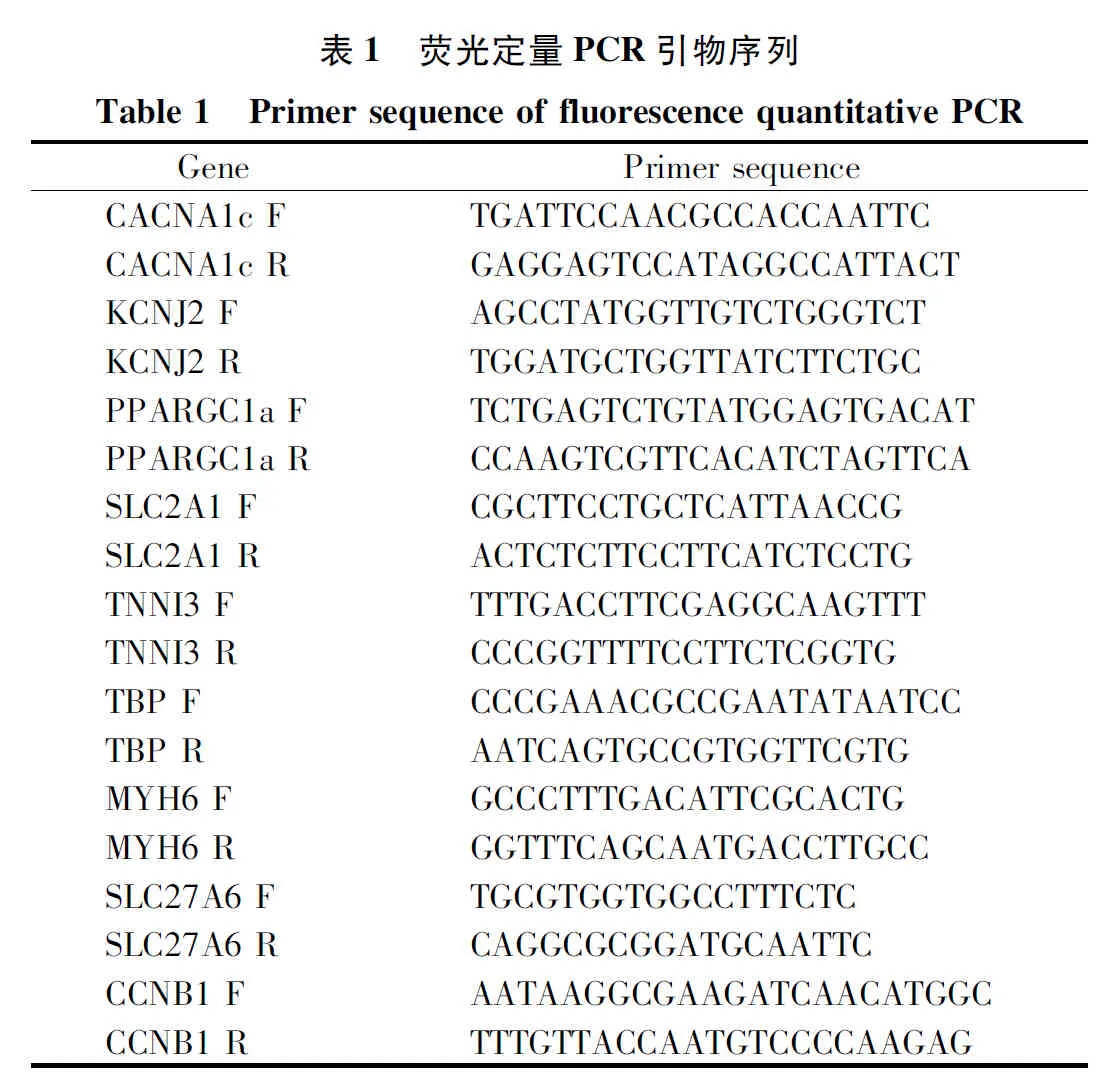
为了验证Torin1、Nutlin-3a对细胞增殖的影响,我们首先在3T3细胞系里进行了验证。3 d后光镜下观察显示:Torin1组和Nutlin-3a组细胞数量比DMSO组明显减少(图1A-C)。免疫荧光染色结果显示:增殖标志物Ki67阳性细胞的比例在DMSO组(32.8%±15.4%)高于Nutlin-3a组(8.2%±3.6%)和Torin1组(8.8%±3.9%),差异有统计学意义(P<0.001,图1D-G)。流式细胞分析显示:Torin1组(31.8%±15.7%)和Nutlin-3a组(41.3%±11.4%)比DMSO组(9.0%±9.5%),有更多的细胞进入G0期(P<0.05),说明Nutlin-3a和Torin1对细胞周期有一定的调控作用(图1H)。上述实验结果说明,Nutlin-3a和Torin1可以通过调控细胞周期而抑制细胞增殖。
A-C: 3t3细胞光镜图(标尺=400 μm);D-F:各组3t3细胞ki67、DAPI、F-actin、Merge免疫荧光(标尺=100 μm);G: ki67阳性3t3细胞统计分析;H: 3t3细胞周期流式分析;*:P<0.05;***:P<0.001。A-C: Light microscopic view of 3t3 cells (bar=400 μm); D-F: Immunofluorescence of Ki67, DAPI, F-actin, Merge (bar=100 μm) in 3t3 cells of each group; G: Statistical analysis of Ki67 positive 3t3 cells; H: Cell cycle analyzed by flow cytometry; *: P<0.05; ***: P<0.001.图1 Torin1、Nutlin-3a对3T3细胞增殖的影响Fig. 1 Effect of Torin1、Nutlin-3a on proliferation of 3T3 cells
2.2 hiPS细胞鉴定及hiPS细胞向心肌细胞分化
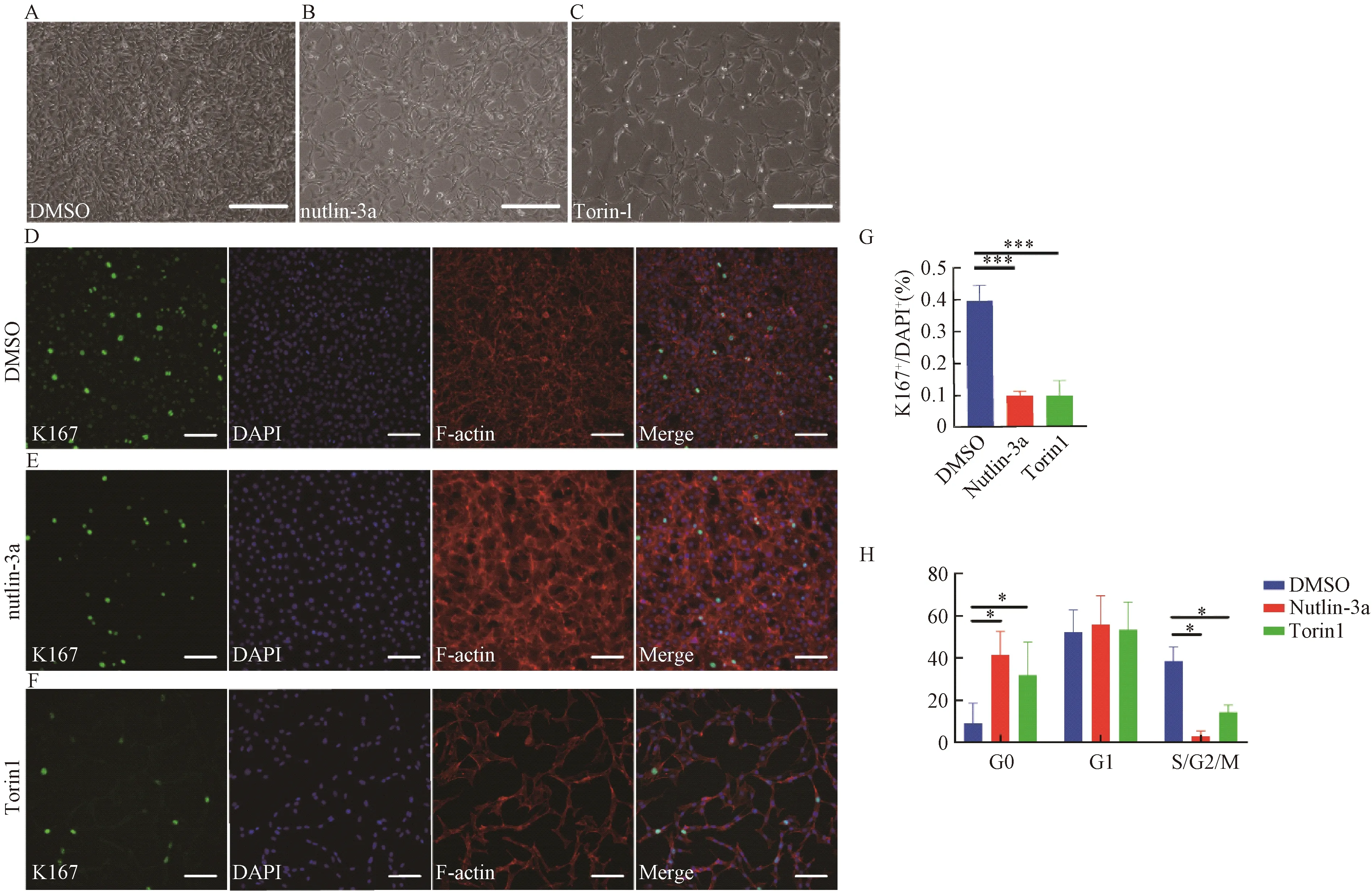
hiPS细胞呈克隆样生长,边缘整齐,细胞小,呈圆形,排列紧密,核质比高。免疫荧光染色结果显示:hiPS细胞高表达干性标志物Nanog、Oct4、Sox2、Tra-1-60(图2)。在hiPS细胞向心肌细胞诱导分化过程中,细胞形态逐渐发生改变,由椭圆形变为多边形的心肌细胞,第9天可以观察到跳动的心肌细胞(图3B-E)。免疫荧光结果显示:分化的心肌细胞高表达心肌特异性标志物cTnT、α-actinin,肌节明显且排列较规整(图3F)。流式细胞分析技术显示:分化的心肌细胞高表达心肌特异性标志物cTnT,效率超过70%(图3G)。
A:Nanog、DAPI、Merge免疫荧光;B:Oct4、DAPI、Merge免疫荧光;C:Sox2、DAPI、Merge免疫荧光;D:TRA-1-60、DAPI、Merge免疫荧光。A: Immunofluorescence of Nanog, DAPI and Merge; B: Immunofluorescence of Oct4, DAPI and Merge; C: Immunofluorescence of Sox2, DAPI and Merge; D: Immunofluorescence of TRA-1-60, DAPI and Merge.图2 hiPS细胞特异性标志物鉴定(标尺=400 μm)Fig. 2 Pluripotency identification of hiPSC (bar=400 μm)
A:hiPS细胞诱导分化为心肌细胞过程模式图;B:hiPS细胞形态;C-E:hiPS细胞诱导分化过程形态变化图(标尺=400 μm);F:分化第35天cTnT、α-actin、DAPI、Merge免疫荧光(标尺=10 μm);G:分化第15天cTnT表达流式分析。A: The process of inducing differentiation of hiPS cells into cardiomyocytes; B: Morphological observation of hiPS; C-E: Morphological changes of hiPS cells during differentiation (bar=400 μm); F: Immunofluorescence of cTnT, α-actin, DAPI and Merge on the 35th day of differentiation (bar=10 μm); G: Flow analysis of cTnT on the 15th day of differentiation.图3 hiPS细胞向心肌细胞分化的过程及心肌细胞鉴定Fig. 3 Differentiation of hiPS cells into cardiomyocytes and identification of cardiomyocytes
2.3 Torin1、Nutlin-3a对hiPS-CM成熟相关蛋白表达的影响
为了评估Torin1和Nutlin-3a对iPS细胞诱导的早期心肌细胞成熟的影响,我们在早期心肌细胞中分别添加Torin1和Nutlin-3a,通过Western blot实验对心肌特异性蛋白cTnT、cTnI以及p53总蛋白含量进行鉴定(图4A)。结果显示:以GAPDH作为内参蛋白,DMSO组、Nutlin-3a组、Torin1组cTnT条带灰度值分别为34 161± 6 679、52 402±10 376、51 274±10 325(图4B),DMSO组、Nutlin-3a组、Torin1组cTnI条带灰度值分别为149 862±60 900、397 738±147 167、470 233±222 324(图4C)。Nutlin-3a组和Torin1组cTnT、cTnI蛋白表达量相比DMSO组有增加的趋势,p53蛋白在DMSO组和Nutlin-3a组表达最高,在Torin1组表达有下降的趋势,与预期不符(图4D)。Western blot结果初步表明,Torin1和Nutlin-3a作用于iPS细胞诱导的早期心肌细胞,在蛋白水平上可能促进心肌细胞成熟。
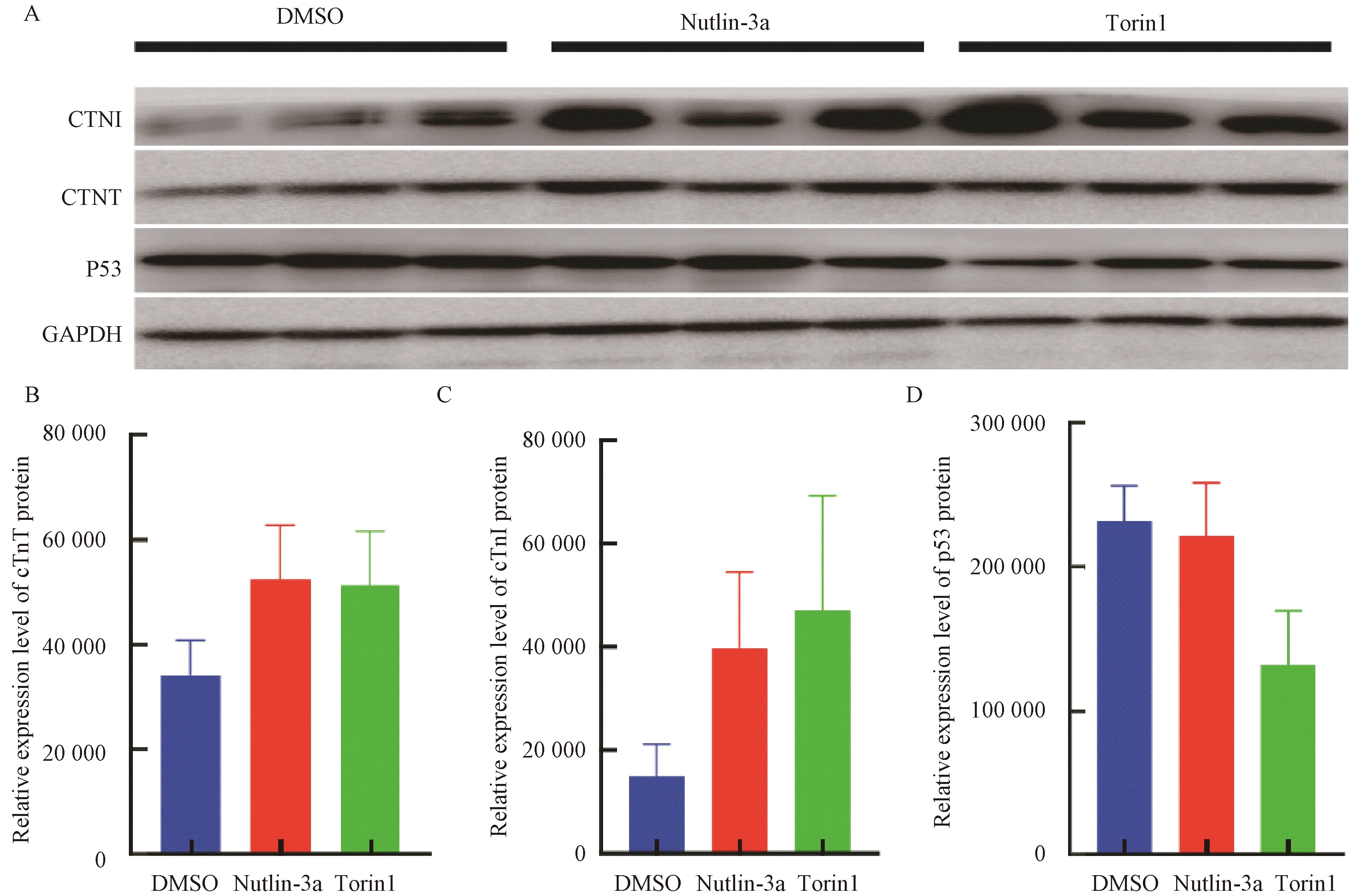
A:WB结果;B:cTnT蛋白条带灰度值统计图;C:cTnI蛋白条带灰度值统计图;D:p53蛋白条带灰度值统计图。A: The result of Western blot; B: Histogram of the gray value of cTnT protein bands; C: Histogram of the gray value of cTnI protein bands; D: Histogram of the gray value of p53 protein bands.图4 hiPS-CM成熟相关蛋白的表达Fig.4 Expression of maturation related protein of hiPS-CM
2.4 Torin1、Nutlin-3a对hiPS-CM成熟相关mRNA表达的影响
为了进一步验证Torin1和Nutlin-3a对iPS细胞诱导的早期心肌细胞成熟的影响,我们对心肌成熟相关分子的RNA表达情况进行了分析。qRT-PCR结果显示:以TBP为内参,心肌特异性标志物TNNI3在Torin1组表达最多(P<0.000 1)。增殖标志物CCNB1在Torin1组表达相比DMSO组有降低的趋势。钙离子通道标志物CACNA1c在Torin1组和Nutlin-3a组表达相比DMSO组有增高的趋势。钾离子通道标志物KCNJ2的表达在3组间未显示出统计学差异,钠离子通道标志物SCN5A在Nutlin-3a组表达有增高的趋势。糖代谢标志物SLC2A1在Torin1组和Nutlin-3a组的表达相比DMSO组有降低的趋势。脂代谢标志物SLC27A6在Nutlin-3a组有表达增加的趋势。脂代谢标志物PPARGC1a在Torin1组表达最高,与DMSO组(P<0.001)以及Nutlin-3a组(P<0.05)相比有统计学差异。进一步表明Torin1处理过后的心肌细胞增殖可能减少,并且可能更多地以脂代谢为能量代谢方式,心肌特异性标志物表达量增高提示心肌细胞内结构可能更加成熟(图5)。
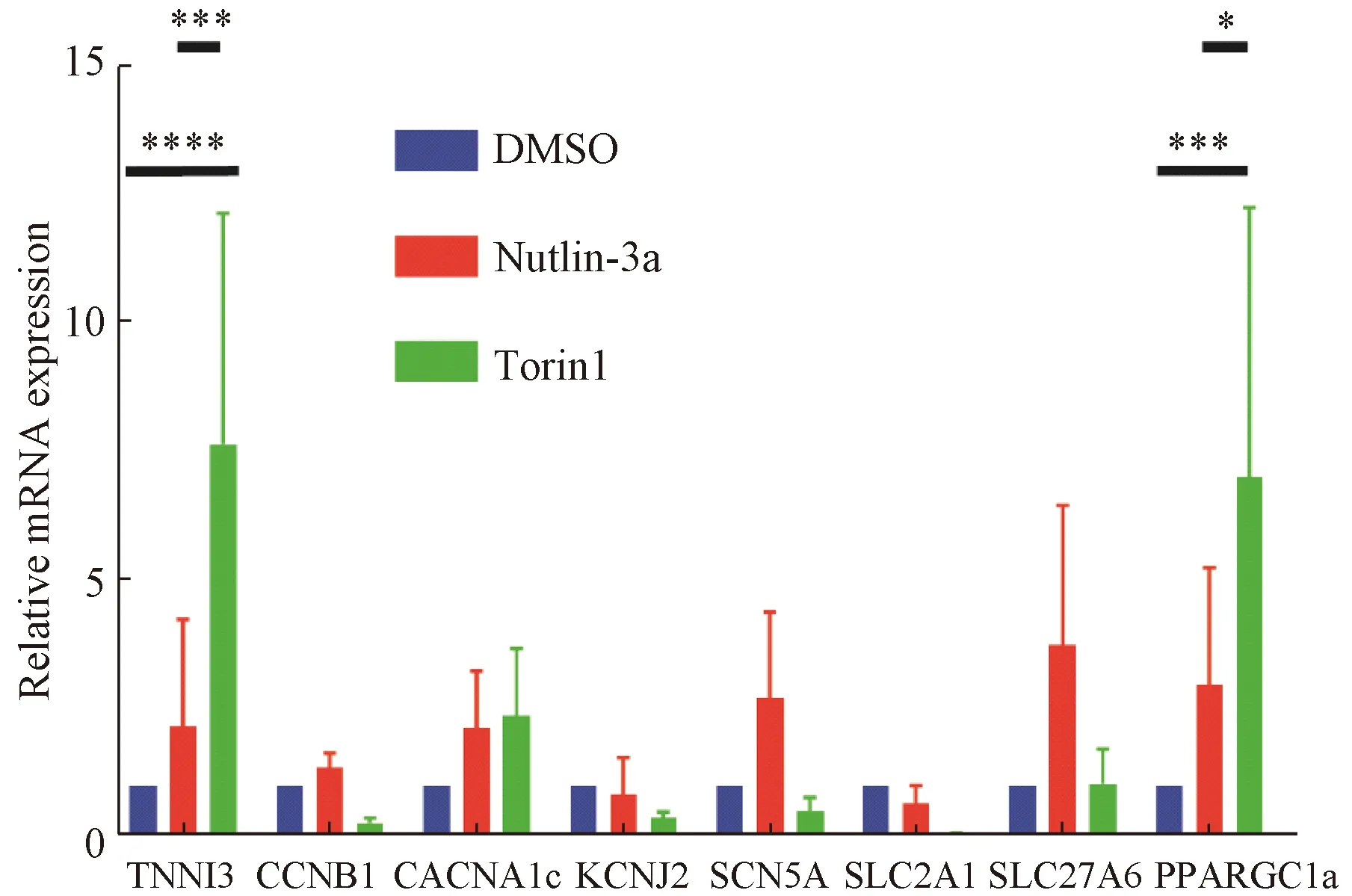
图5 hiPS-CM成熟相关mRNA的表达(*:P<0.05;***:P<0.001;****:P<0.000 1)Fig. 5 Expression of maturation related mRNA of hiPS-CM (*: P<0.05; ***: P<0.001; ****: P<0.000 1)
2.5 Torin1、Nutlin-3a对hiPS-CM形态的影响
为了进一步探究Torin1、Nutlin-3a对iPS细胞诱导的早期心肌细胞形态的影响,我们对Torin1、Nutlin-3a处理后1周的hiPS-CM进行了细胞免疫荧光染色,结果显示:各组细胞表达心肌特异性标志物cTnT,与对照组相比,实验组细胞形态趋近长棒型,其中Torin1组心肌细胞肌节更加丰富,排列更加规整,更加接近成熟心肌细胞形态。该结果表明,Torin1和Nutlin-3a作用于iPS细胞诱导的早期心肌细胞,可能促进hiPS-CM形态的成熟(图6)。

图6 hiPS-CM形态鉴定:hiPS-CM cTnT、DAPI、Merge免疫荧光(标尺=25 μm)Fig.6 Morphological identification of hiPS-CM: Immunofluorescence of cTnT, DAPI, Merge (bar=25 μm)
2.6 Torin1、Nutlin-3a对hiPS-CM动作电位形态的影响
我们对Torin1、Nutlin-3a处理后1周的hiPS-CM进行了动作电位测定,结果显示:Torin1组(23+12.7)和Nutlin-3a组(22.2+2.2)动作电位频率相比DMSO组(28.7+8.1)有降低的趋势(图7B)。3组间的振幅大小无明显差异(图7C)。Torin1组0期最大去极化速率相比DMSO组有增大的趋势(图7 D)。Torin1组和Nutlin-3a组动作电位平台期、APD30、APD70、APD90、阈电位绝对值相比DMSO组有增大的趋势(图7E-I),表明Torin1和Nutlin-3a作用于iPS细胞诱导的早期心肌细胞,可能促进心肌细胞动作电位成熟。
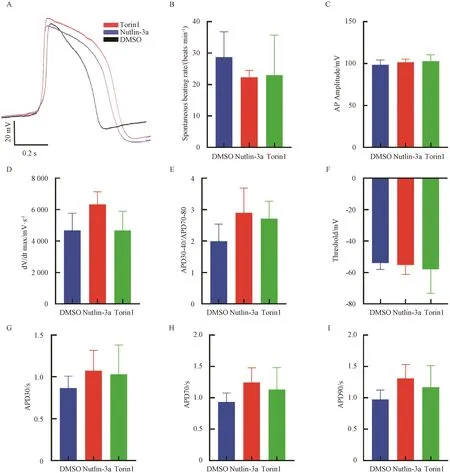
A:动作电位模式图;B:动作电位频率;C:动作电位振幅;D:0期最大去极化速率;E:动作电位平台期;F:域电位;G:30%复极化动作电位时程;H:70%复极化动作电位时程;I:90%复极化动作电位时程;AP:动作电位;dV:电压;dt:时间;APD:动作电位时程。A: Action potential pattern diagram; B: Action potential frequency; C: Action potential amplitude; D: Maximum depolarization rate at phase 0; E: Action potential plateau; F: Domain potential; G: 30% repolarized action potential duration; H: Time history of 70% repolarized action potential; I: 90% repolarized action potential time history; AP: Action Potential; dV: Voltage; dt: Time; APD: Action Potential Duration.图7 膜片钳电生理动作电位分析Fig. 7 Analysis of electrophysiological action potential of patch clamp
3 讨论
hiPSC来源的心肌细胞成熟度不足,不能很好地模拟在体的心肌细胞,成为心血管相关研究发展的一个重要障碍。目前,促进干细胞来源的早期心肌细胞成熟的方法包括延长培养时间、细胞共培养、机电刺激、添加生物活性分子等[12-13],但是这些方法效果有限或者操作复杂,因此需要进一步研究,以获得简单有效的促进iPSCs来源心肌细胞成熟的方法。我们通过Torin1、Nutlin-3a,调控细胞周期,诱导细胞停止增殖,在一定程度上促进了iPS分化来源的早期心肌细胞的成熟。
已有研究证明,心肌细胞在出生后不久便退出细胞周期,停止增殖。成熟的心肌细胞处于静止状态,与心肌细胞代谢方式转变、动作电位时程的延长、细胞的结构和功能的完善相符合[14]。研究表明,Torin1和Nutlin-3a可能抑制mTOR通路,促使细胞退出细胞周期,停止增殖。我们观察到在Torin1和Nutlin-3a作用下,静止期的3T3细胞数量增加并抑制了增殖标记物ki67的表达。
肌节是心肌细胞收缩的基本单位。监测肌节相关蛋白(如cTnT、cTnI等)的表达水平可以对iPS-CM的成熟进行初步评价。与成人心脏组织相比,iPS-CM 的肌节相关基因以及蛋白表达较低[15]。在hiPSC诱导的早期心肌细胞中,可以观察到Torin1和Nutlin-3a在一定程度上促进了心肌细胞肌节相关蛋白和基因的表达。
在细胞形态和结构方面,实验组的细胞形态更趋近长棒型,长宽比增大,肌节丰富且排列规整。心肌细胞的形态对心肌功能的发挥具有重要影响。在体内,心肌细胞是棒状的,但在体外培养时,未成熟的心肌细胞呈扁平状并向各个方向伸展。在心肌细胞发育过程中,肌节结构也变得更有条理[16]。
心肌细胞动作电位的产生需要各种离子通道之间的协调活动。未成熟心肌细胞中钠通道和钙通道蛋白水平较低,分别会导致较慢的0期去极化速度以及缺乏或较短的平台期[17-18]。实验组在动作电位的形态上,表现为频率减慢、0期去极化最大速率增大、动作电位平台期、动作电位时程延长的趋势,类似成熟心肌细胞动作电位的特征。q-PCR结果显示实验组钠离子和钙离子通道相关蛋白的表达相比对照组有增高的趋势,与电生理结果相一致。
研究表明,p53与细胞周期的调控密切相关,伴随mTOR抑制的p53上调导致细胞进入静止状态[19],不伴mTOR抑制的p53上调导致细胞衰老[20]。此外,大量p53的激活可以直接抑制mTOR通路,促使细胞进入静止状态[21]。本实验结果表明,仅仅利用Nutlin-3a直接激活p53,也能起到一定的促成熟效果。但是,Torin1组和Nutlin-3a组p53蛋白的表达没有呈现出预期的上升趋势。可能是由于p53蛋白本身表达量低且易降解,且真正起作用的是活化的p53蛋白。因此,总p53蛋白表达量只能作为参考指标,更准确的评价应该依靠活性p53蛋白的表达量检测。
综上所述,利用Torin1和Nutlin-3a处理iPS分化来源的早期心肌细胞可能诱导细胞静止并改善细胞成熟的相关指标。初步表明mTOR信号通路可能是心肌细胞成熟的关键调节因子,后续还需要进一步通过心肌细胞代谢、细胞亚结构等进一步验证细胞的成熟程度。
