白杨素调控lncRNA GAS5表达对高糖诱导的人视网膜微血管内皮细胞损伤的影响
2021-12-29何昭华梁文旺钟茜
何昭华,梁文旺,钟茜
糖尿病视网膜病变(diabetic retinopathy,DR)是导致成年人视力丧失的主要原因之一,而高血糖被认为是DR 的主要致病因素,并与视网膜微血管内皮细胞凋亡、氧化应激增加有关[1]。白杨素(chrysin)是一种天然的黄酮类化合物,具有抗炎、抗氧化和抗肿瘤特性,其对小鼠局灶性脑缺血再灌注损伤具有保护作用[2]。白杨素与黄芩苷联用对肾小管损伤、肾功能紊乱具有改善作用[3]。长链非编码RNA(long non-coding RNA,lncRNAs)是长度超过200 nt、蛋白编码潜力缺失的RNA 转录本,因其在细胞增殖、凋亡、氧化应激损伤等生物学过程中的作用而受到广泛关注。研究显示[4],上调lncRNA 生长抑制特异性转录本5(growth suppression-specific transcript 5,GAS5)表达可改善脂多糖诱导的软骨损伤。DR患者外周血中lncRNA GAS5 表达降低[5],但白杨素是否调控lncRNA GAS5 表达保护视网膜微血管内皮细胞损伤并不清楚。本研究以高糖刺激人视网膜微血管内皮细胞(human retinal microvascular endothelial cells,HRMECs)构建细胞损伤模型,探讨白杨素对该损伤是否具有保护作用,分析其机制是否与调控lncRNA GAS5 表达有关,以期为DR 治疗提供有效策略。
1 材料与方法
1.1 实验材料
HRMECs 细胞购于上海启达生物科技公司;白杨素(纯度≥98%,规格20 mg)购于上海源叶生物科技公司;GAS5小干扰RNA(si-GAS5)及其阴性对照(si-NC)、GAS5 过表达质粒(pcDNA-GAS5)与其空载体质粒(pcDNA)购于北京华大六合基因公司;脂质体2000(Lipofectamine 2000)购于美国Invitrogen公司;逆转录试剂盒、SYBR Premix Ex Taq II 试剂盒购于上海生工生物公司;丙二醛(MDA)含量检测试剂盒、超氧化物岐化酶(superoxide dismutase,SOD)活性检测试剂盒、膜联蛋白V(annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒购于北京索莱宝科技公司;细胞计数试剂盒(CCK-8)购于上海贝博生物公司;兔源B 细胞淋巴瘤-2 蛋白(B cell lymphoma 2,Bcl-2)、Bcl 相关x 蛋白(Bcl associated x protein,Bax)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体以及山羊抗兔IgG购于上海碧云天生物公司。
1.2 细胞培养、转染
取1×106个HRMECs 细胞接种在24 孔板,当细胞60%汇合时,利用脂质体2000 试剂进行细胞转染,即将脂质体2000(1 μL)和无血清培养液(50 μL)置于无菌EP 管中室温静置5 min,将转染的RNA(20 pmol 的pcDNA-GAS5 或pcDNA 或si-GAS5 或si-NC)和无血清培养液(50 μL)置于另一无菌EP试管中。将上述两管溶液混合,室温静置20 min,得到RNA与脂质体复合物。将混合物加入含有细胞的培养皿中,37℃+5%CO2条件下转染培养6 h,更换为完全培养基代替,收获转染48 h细胞进行下一步实验。
1.3 实验分组
正常组(normal group,NG):用含5.5 mmol/L 葡萄糖的培养液孵育HRMECs 48 h。
高糖组(high glucose group,HG):用含30 mmol/L葡萄糖孵育HRMECs 48 h[6]。
白杨素组(chrysin group,CG):分为3个剂量组,白杨素低剂量组(low dose chrysin group,LCG)、白杨素中剂量(medium dose chrysin group,MCG)、白杨素高剂量(high dose chrysin group,HCG)组:用含30 mmol/L葡萄糖和不同浓度白杨素培养液(12.5、25.0、50.0μmol/L)分别孵育HRMECs 48 h[7]。
pcDNA 组、pcDNA-GAS5 组:用含30 mmol/L 葡萄糖培养液孵育转染pcDNA 或转染pcDNA-GAS5细胞48 h。
HCG+si-NC组、HCG+si-GAS5组:用含30 mmol/L葡萄糖和50.0 μmol/L 白杨素的培养液孵育转染si-NC或转染si-GAS5细胞48 h。
1.4 观察指标及方法
1.4.1 细胞中MDA 含量以及SOD 活性 收集各组HRMECs 至EP 管,离心后弃上清。参照试剂盒说明书加入提取液,冰浴、超声波破碎细胞,4℃离心机10000 rpm 离心10 min,收集上清置于冰上。按照各个试剂盒操作步骤分别测定MDA 水平、SOD 和GSH-Px活性。实验独立重复3次。
1.4.2 CCK-8 法检测细胞活力 将各组HRMECs细胞以1×106个/孔的密度接种96孔板,分别在孵育24、48、72 h时间点向各实验孔加入10 μL的CCK-8工作液,反应2 h。酶标仪检测在450 nm 处光密度(OD)值以表示细胞增殖活力。实验独立重复3次。
1.4.3 流式细胞术检测细胞凋亡 收集各组细胞,室温3000 rpm离心5 min,用预冷的磷酸盐缓冲液重新悬浮细胞,3000 rpm 离心5~10 min,洗涤后加入300 μL 的结合缓冲液重新悬浮细胞。3000 rpm 离心5~10 min,洗涤后加入300 μL 的结合缓冲液重新悬浮细胞。加入5 μL的Annexin V-FITC,暗室孵育15 min。再加入5 μL的PI,暗室孵育5 min。采用流式细胞仪检测细胞凋亡情况。实验独立重复3次。
1.4.4 免疫印记法检测Bcl-2 和Bax 蛋白表达 用放射免疫沉淀试验(radioimmunoprecipitation assay,RIPA)裂解缓冲液处理HRMECs,收集总蛋白,然后用二喹啉甲酸法测定蛋白浓度。采用SDS-PAGE分离细胞蛋白,随后使用湿转移法将蛋白条带转移到硝酸纤维素膜。用5%脱脂牛奶在室温下孵育膜1 h,然后孵育用一抗溶液孵育膜过夜。次日,用PBS 和Tween-20溶液(PBST)洗涤3次,再用稀释的二抗溶液孵育膜2 h,然后用PBST 冲洗三次。将膜置于暗盒内,加入显影剂显影。蛋白相对表达量=目的条带灰度值/GAPDH条带灰度值。实验独立重复3次。
1.4.5 实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)检 测lncRNA GAS5表达 采用Trizol 试剂提取各组细胞的总RNA,取总5 μL RNA 样本用无RNA 的超纯水稀释20倍,紫外分光光度法在260 nm和280 nm测定光密度(OD)值,以确定RNA 的浓度和纯度,如果OD260/OD280值在1.7~2.1之间,则认为RNA合格可用于后续实验。按照逆转录试剂盒将总RNA 反转录成cDNA模板,根据SYBR Premix Ex Taq II试剂盒说明书进行RT-qPCR。2-ΔΔCt法计算lncRNA GAS5表达量。引物序列如下(表1),实验独立重复3次。

表1 RT-qPCR引物序列
1.5 统计学方法
所有数据采用SPSS 21.0 软件进行分析。计量资料以均数±标准差()表示。多组间比较采用单因素方差分析,进一步组间两两比较采用LSD-t检验。当P<0.05时,则认为差异具有统计学意义。
2 结果
2.1 白杨素对高糖诱导的HRMECs氧化损伤的影响
与NG 组比较,HG 组HRMECs 中GAS5 表达量降低(t=45.322,P=0.000),细胞SOD活性降低(t=26.923,P=0.000),MDA含量升高(t=36.123,P=0.000);与HG组比较,MCG组HRMECs中GAS5表达量升高(t=17.391,P=0.000),细胞SOD 活性升高(t=12.231,P=0.000),MDA 含量降低(t=7.510,P=0.002);与HG 组比较,HCG 组HRMECs 中GAS5 表达量升高(t=36.363,P=0.000),细胞SOD 活性升高(t=22.654,P=0.000),MDA 含量降低(t=27.228,P=0.000),差异均有统计学意义(表2)。
表2 对高糖诱导的HRMECs中GAS5表达及氧化损伤的影响(,n=3)

表2 对高糖诱导的HRMECs中GAS5表达及氧化损伤的影响(,n=3)
注:a 与NG相比,P<0.05;b 与HG相比,P<0.05;c 与LCG相比,P<0.05;d与MCG相比,P<0.05。NG 正常组;HG 高糖组;LCG 白杨素低剂量组;MCG 白杨素中剂量组;HCG 白杨素高剂量组;Bcl B细胞淋巴瘤-2蛋白;Bax Bcl相关x蛋白
2.2 白杨素对高糖诱导的HRMECs凋亡的影响
与NG 组比较,HG 组HRMECs 中Bax 蛋白表达量升高(t=24.003,P=0.000),凋亡率升高(t=36.811,P=0.000),Bcl-2蛋白表达量降低(t=27.391,P=0.000),细胞活力(48 h、72 h)降低(t48h=9.507,P=0.001;t72h=16.089,P=0.000);与HG 组比较,MCG 组HRMECs中Bax蛋白表达量降低(t=8.943,P=0.001),凋亡率降低(t=8.896,P=0.001),Bcl-2蛋白表达量升高(t=8.593,P=0.001),细胞活力(48h、72h)升高(t48h=4.406,P=0.012;t72h=6.689,P=0.003);与HG 组比较,HCG 组HRMECs 中Bax 蛋白表达量降低(t=18.464,P=0.000),凋亡率降低(t=24.091,P=0.000),Bcl-2 蛋白表达量升高(t=20.409,P=0.000),细胞活力(48 h、72 h)升高(t48h=7.884,P=0.001;t72h=12.835,P=0.000),差异均有统计学意义(表3、图1A、图2A)。
表3 白杨素对高糖诱导的HRMECs细胞增殖活力及凋亡的影响(,n=3)

表3 白杨素对高糖诱导的HRMECs细胞增殖活力及凋亡的影响(,n=3)
注:a 与NG相比,P<0.05;b 与HG相比,P<0.05;c 与LCG相比,P<0.05;d与MCG相比,P<0.05。NG 正常组;HG 高糖组;LCG 白杨素低剂量组;MCG 白杨素中剂量组;HCG 白杨素高剂量组;Bcl B细胞淋巴瘤-2蛋白;Bax Bcl相关x蛋白
2.3 过表达GAS5对高糖诱导的HRMECs凋亡及氧化损伤的影响
与HG 组,pcDNA-GAS5 组HRMECs 细胞凋亡率降低(t=26.250,P=0.000),Bax蛋白表达量降低(t=1004.667,P=0.000),MDA含量降低(t=24.068,P=0.000),SOD 活性升高(t=29.198,P=0.000),Bcl-2 蛋白表达量升高(t=22.517,P=0.000),细胞活力(48 h、72 h)升高(t48h=7.754,P=0.001;t72h=13.612,P=0.000);与pcDNA 组比较,pcDNA-GAS5 组HRMECs 细胞凋亡率降低(t=26.321,P=0.000),Bax蛋白表达量降低(t=1004.667,P=0.000),MDA含量降低(t=24.231,P=0.000),SOD 活性升高(t=29.259,P=0.000),Bcl-2 蛋白表达量升高(t=22.517,P=0.000),细胞活力(48 h、72 h)升高(t48h=7.323,P=0.002;t72h=13.244,P=0.000),差异均有统计学意义(表4、图1B、图2B)。
表4 GAS5对高糖诱导的HRMECs细胞增殖活力、凋亡及氧化损伤的影响(,n=3)
表4 GAS5对高糖诱导的HRMECs细胞增殖活力、凋亡及氧化损伤的影响(,n=3)
注:a 与HG相比,P<0.05;b 与pcDNA相比,P<0.05。HG 高糖组;pcDNA 空载质粒;GAS5 生长抑制特异性转录本5;Bcl B细胞淋巴瘤-2蛋白;Bax Bcl相关x蛋白;MDA 丙二醛;SOD 超氧化物岐化酶
2.4 抑制GAS5对高糖诱导的HRMECs损伤的影响
与HG 组比较,HCG 组HRMECs 凋亡率降低(t=21.014,P=0.000),Bax 蛋白表达降低(t=22.743,P=0.000),MDA含量降低(t=29.448,P=0.000),Bcl-2蛋白表达升高(t=19.919,P=0.000),SOD 活性升高(t=23.893,P=0.000),细胞活力(48 h、72 h)升高(t48h=6.694,P=0.003;t72h=11.976,P=0.000);与HCG+si-NC 组比较,HCG+si-GAS5 组HRMECs 凋亡率升高(t=14.135,P=0.000),Bax 蛋白表达升高(t=15.465,P=0.000),MDA含量升高(t=21.766,P=0.000),Bcl-2蛋白表达降低(t=13.280,P=0.000),SOD 活性降低(t=19.410,P=0.000),细胞活力(48 h、72 h)降低(t48h=4.909,P=0.008;t72h=9.581,P=0.001),差异均有统计学意义(表5、图1C、图2C)。
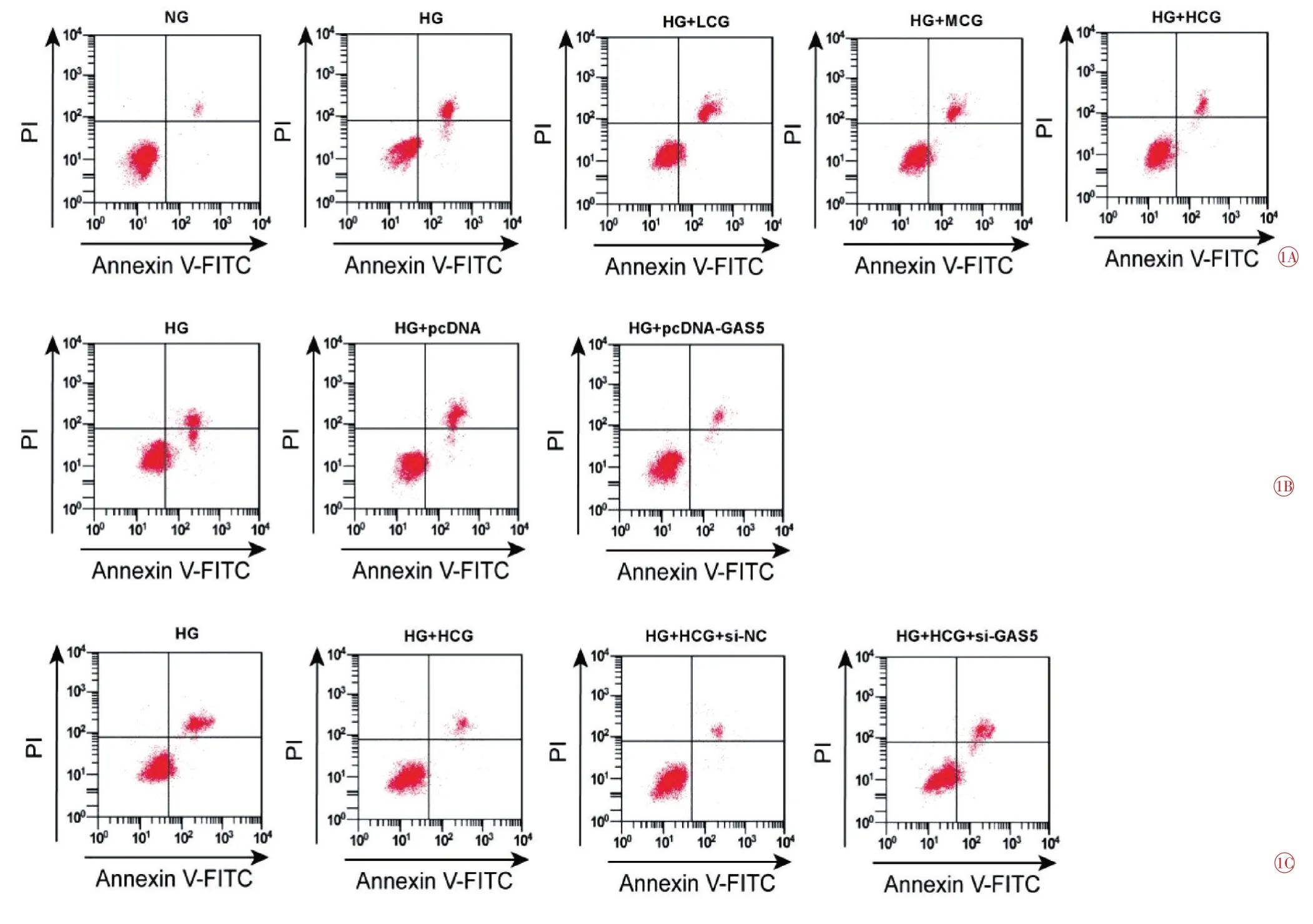
图1 流式细胞术检测细胞凋亡图。1A 白杨素对高糖诱导的HRMECs 凋亡的影响;1B GAS5 对高糖诱导的HRMECs 凋亡的影响;1C 抑制GAS5对高糖诱导的HRMECs凋亡的影响

图2 western blot检测Bcl-2和Bax蛋白表达图。2A 白杨素对高糖诱导的HRMECs中凋亡蛋白表达的影响;2B 白杨素对高糖诱导的HRMECs中凋亡蛋白表达的影响;2C 抑制GAS5对高糖诱导的HRMECs中凋亡蛋白表达的影响
表5 抑制GAS5对高糖诱导的HRMECs细胞增殖活力、氧化损伤及凋亡的影响(,n=3)

表5 抑制GAS5对高糖诱导的HRMECs细胞增殖活力、氧化损伤及凋亡的影响(,n=3)
注:a 与HG相比,P<0.05;b 与HCG+si-NC 相比,P<0.05。HG 高糖组;si-NC 小干扰RNA阴性对照组;si-GAS5 小干扰RNA-生长抑制特异性转录本5;Bcl B细胞淋巴瘤-2蛋白;Bax Bcl相关x蛋白;MDA 丙二醛;SOD 超氧化物岐化酶
3 讨论
白杨素是菊科植物中黄酮类化合物的主要活性成分,具有广泛的药理活性。研究显示,白杨素可抑制NF-κB信号通路的激活,进而对体内、外炎症反应具有抑制作用[8]。白杨素还可抑制紫外线诱导的细胞凋亡、活性氧产生以及环氧合酶2(cyclooxygenase 2,COX-2)表达,保护角质形成细胞免受紫外线诱导的损伤[9]。本研究主要探讨白杨素对高糖诱导的HRMECs 损伤的保护作用,结果发现,高糖刺激后HRMECs 抗氧化酶SOD 活性显著降低,脂质过氧化产物MDA含量、细胞凋亡率显著增加,说明DR细胞损伤模型构建成功。进一步分析表明,中、高剂量的白杨素能增加SOD 活性,降低MDA 含量,抑制细胞凋亡,并表现出剂量依赖性,说明一定剂量的白杨素提高改善细胞氧化应激和细胞凋亡对高糖诱导的HRMECs 损伤具有保护作用。与本研究发现类似,Ali N 等[10]研究证实经白杨素预处理后,可通过改善氧化应激、组织病理改变和凋亡来预防甲氨蝶呤诱导的肝脏毒性。Bax是促凋亡蛋白,Bcl-2是抗凋亡蛋白,Bax表达增加、Bcl-2表达降低可诱导caspase-3活化,促进细胞凋亡,有研究指出白杨素能以剂量依赖性方式,恢复高糖暴露对肾足细胞中Bax 和Bcl-2 蛋白表达的影响[11]。本研究中高糖刺激能上调Bax 蛋白表达,下调Bcl-2 蛋白表达,而白杨素预处理可以逆转上述改变,进一步证实白杨素的抗凋亡作用。以上数据提示白杨素对高糖诱导的HRMECs损伤具有保护作用。
lncRNA GAS5是非编码RNA家族重要成员,其通过抑制细胞增殖、转移、化疗耐药,诱导细胞自噬和凋亡,在宫颈癌、胰腺癌等多种恶性肿瘤中扮演抑癌基因角色[12-14]。此外,GAS5 被证实与多种细胞损伤相关。在脓毒症诱导的足细胞损伤中GAS5表达降低,过表达GAS5 显著减弱脓毒症性足细胞损伤[15]。异硫维醇钠通过调节GAS5 表达减弱调节缺血性卒中小胶质细胞/巨噬细胞极化,发挥神经保护作用[16]。本研究中高糖刺激后HRMECs 中GAS5 表达量显著降低,而中、高剂量的白杨素处理能逆转上述改变,说明白杨素的细胞保护作用可能与调控GAS5表达有关。验证GAS5功能显示,过表达GAS5可增加SOD活性、Bax蛋白表达量,降低MDA 含量、Bcl-2蛋白表达量,抑制细胞凋亡,说明过表达GAS5对高糖诱导的HRMECs 损伤具有保护作用。此外,干扰GAS5 表达能减弱白杨素处理对高糖诱导的HRMECs凋亡、氧化损伤的影响,这进一步证实白杨素的保护作用可能与上调lncRNA GAS5表达有关。
总之,本研究发现,白杨素能够减弱高糖诱导的HRMECs 凋亡、氧化损伤,其机制可能是通过上调lncRNA GAS5 表达实现的。这阐明了白杨素的可能的保护作用机制,为白杨素用于防治DR 提供了一定理论支撑。
