短期盐胁迫下甜菜幼苗的生理伤害和适应变化
2021-12-28张广华刘丹阳范国凯於丽华王宇光
张广华,刘丹阳,何 硕,范国凯,於丽华,王宇光,耿 贵
(黑龙江大学 现代农业与生态环境学院,哈尔滨 150080)
0 引 言
近年来,全球20%的耕地受到盐胁迫的影响,中国9.2×107hm2的耕地正面临着盐渍化的影响[1]。用物理和化学方法改良盐渍化土壤成本过高,培养耐盐作物成为改良盐碱地的重要举措之一,能改良土壤性质,并能产生一定的经济效益和环境效益,因此对作物耐盐机制的研究尤为重要[2]。甜菜是我国主要的糖料作物之一,具有较高的耐盐性和极强的适应性,是开发利用盐碱地的理想作物[3]。盐胁迫是限制作物生长的主要非生物胁迫,盐分以渗透胁迫和离子毒性的形式制约植物的生长。Na+和Cl-在植物组织中的积累破坏了植物体内的离子平衡,并且过高的Na+浓度会限制植物对K+的吸收,间接影响植株的生长[4]。
研究表明,低浓度的盐会对甜菜的生长起到促进作用,但是高浓度的盐会抑制甜菜的生长。施加0.75~9 mmol·L-1的Na+可以促进甜菜幼苗生长,叶面积和干物质量增加[5-6]。在NaCl浓度为80~180 mmol·L-1时,对甜菜干物质量的积累并无影响,在浓度为280~380 mmol·L-1时则会抑制甜菜干物质量的积累[7]。植物可通过改变自身的生理变化来适应盐胁迫,比如积累可溶性蛋白、可溶性糖、脯氨酸等渗透调节物质的含量来提高细胞的保水能力[8-10]。王宇光等研究发现,在Na+浓度>25 mmol·L-1时,过氧化氢酶 (Catalase, CAT) 和抗坏血酸过氧化物酶 (Ascorbate peroxidase, APX)的活性均提高[11]。作物对盐胁迫的响应,目前多数研究通过改变Na+的浓度以及对作物进行长时间的胁迫来探究作物对盐胁迫的响应机制,对于作物在盐胁迫下短时间内的生理变化机制探讨很少。本研究通过研究短期盐胁迫条件下甜菜幼苗的生理伤害和适应变化为甜菜耐盐机制的研究以及耐盐作物的培育奠定理论基础。
1 研究材料与方法
1.1 供试材料
甜菜品种T510。
1.2 实验设计
本研究在黑龙江大学农学楼光培室内进行,采用改良的1/2霍格兰营养液进行水培研究。选取大小均匀一致且饱满的甜菜种子,在发芽盒内利用灭菌的蛭石进行培育。发芽条件为光照强度420 umol·m-2·s,每天光照时间段为6:00—20:00,昼夜温度为25 ℃/20 ℃,湿度为65%。培育6 d后,选取大小一致的甜菜幼苗移植到含有2.5 L营养液的玻璃槽中(营养液PH为5.6)。每槽4穴,每穴两株,7 d换一次营养液,培养28 d后开始进行NaCl胁迫处理,胁迫处理0、3、6、12、24、48 h后分别取样测定。
1.3 测定方法
使用Li-6400便携式光合仪(Li-Cor Inc,USA)测定各叶片的净光合速率(Net photosynthetic rate, Pn)、蒸腾速率(Transpiration rate, Tr)、胞间CO2浓度(Intercellular CO2concentration, Ci)和气孔导度(Stomatal conductance, Gs)。参照吕春华等[12]的方法测定甜菜幼苗MDA、可溶性蛋白、脯氨酸的含量。测定叶片相对含水量参照邹琦等[13]的方法,甜菜收获后用天平称取叶片鲜重,将叶片放入烘干箱中,105 ℃下杀青1 h,80 ℃烘干至恒重,用天平称取干重,用所得数据通过式(1)计算相对含水量(RWC)。

(1)
1.4 数据计算与统计分析
利用Microsoft office Excel 2019进行数据整理和分析;利用IBM SPSS 2020数据分析软件的单因素方差分析对所得数据进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 盐胁迫对幼苗生长的伤害指标动态变化
2.1.1 短期盐胁迫对甜菜气孔交换参数的影响
气孔交换参数能够直接反映植物光合作用的强弱(表1)。由表1可见,甜菜叶片的Tr、 Gs、 Pn、 Ci对盐胁迫的响应基本一致,即随着胁迫时间的增加甜菜叶片的气孔交换参数呈现出先降低后增加的趋势。在胁迫12 h前叶片的Tr、 Gs、 Pn、 Ci快速下降,且均在胁迫12 h达到最低值,分别比胁迫0 h降低了84.8%、87.3%、95.1%、67.5%,呈显著性差异(P<0.05)。胁迫48 h叶片的Tr、 Gs、 Pn、 Ci相比于胁迫12 h有所增强,增幅分别为192.4%、307.4%、1093.2%、105.5%。以上研究结果说明胁迫12 h对甜菜光合作用影响最大,胁迫24 h、48 h甜菜通过自我修复使光合作用有所增强。

表1 短期盐胁迫对甜菜气体交换参数的的影响Table 1 Influence of short-term salt stress on gas exchange parameters of sugar beet
2.1.2 短期盐胁迫对甜菜MDA含量的影响
MDA是膜系统受伤的主要产物,研究发现可通过测定MDA的含量来评价植物的受胁迫程度见图1。由图1可见,随着胁迫时间的增加MDA的含量逐渐增加,呈现先上升后下降的趋势。在胁迫12 h时达到峰值,比胁迫0 h增加了64.5%,呈显著性差异(P<0.05)。胁迫3 h与胁迫0 h相比没有显著差异,说明胁迫3 h对甜菜膜系统的伤害很小。胁迫24 h、48 h的MDA含量分别比胁迫12 h降低了7.9%和19.7%,呈显著性差异(P<0.05),此时MDA的含量开始下降。研究结果说明,胁迫12 h对甜菜膜系统伤害最大,大小比较为12 h>24 h>48 h>6 h>3 h>0 h。
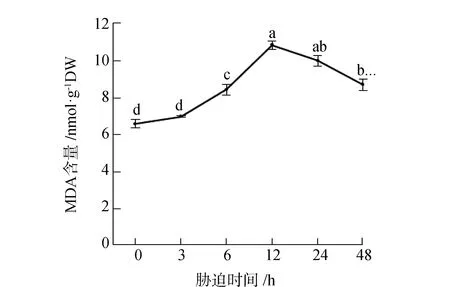
图1 短期盐胁迫对甜菜MDA含量的影响Fig.1 Effects of short-term salt stress on MDA content in sugar beet注:图中不同小写字母表示不同胁迫时间MDA含量差异达到P<0.05的显著性水平。
2.1.3 短期盐胁迫对甜菜相对含水量的影响
叶片相对含水量能直观反映出植物体内的水分代谢状况见图2。由图2可见,随着胁迫时间的不断增加,叶片相对含水量受到了不同程度的抑制,呈现先降低后增加的趋势。胁迫12 h前相对含水量快速下降,在胁迫时间为12 h时达到最低值,比胁迫0 h降低了4%,呈显著性差异(P<0.05)。但胁迫3 h和胁迫0 h相比没有显著性差异,波动幅度很小。胁迫24 h、48 h甜菜体内的水分代谢情况有所缓解,比胁迫12 h分别增加了1.1%和1.8%。研究结果说明,胁迫12 h对甜菜体内水分代谢的影响最大,胁迫12 h后甜菜体内的相对含水量逐渐增加,植株开始对盐胁迫造成的过度失水做出适应调整。

图2 短期盐胁迫对甜菜相对含水量含量的影响Fig.2 Influence of short-term salt stress on relative water content of sugar beet注:图中不同小写字母表示不同胁迫时间相对含水量差异达到P<0.05的显著性水平。
2.2 盐胁迫对幼苗生长的适应指标动态变化
可溶性蛋白是植物体内适应干旱、寒冷、盐渍等逆境中重要的渗透调节物质(图3(a))。由图3(a)可见,随着胁迫时间的增加,可溶性蛋白含量呈现先增加后降低的趋势。在胁迫12 h前可溶性蛋白含量快速积累,细胞渗透压增加。胁迫12 h达到峰值,胁迫12 h比胁迫0 h可溶性蛋白含量增加了32.6%,呈显著性差异(P<0.05)。胁迫12 h后可溶性蛋白含量开始下降,胁迫48 h比胁迫12 h可溶性蛋白含量降低了13.3%,呈显著性差异(P<0.05)。
脯氨酸在维持蛋白质结构的稳定和保持细胞膜的完整性方面发挥重要的作用,同时也是植物体内重要的渗透调节物质,植物体内脯氨酸含量的增加是植物适应逆境的一种保护性措施(图3(b))。由图3(b)可见,随着胁迫时间的增加脯氨酸含量呈现先增加后降低的趋势,与可溶性蛋白含量变化趋势一致,但脯氨酸含量变化幅度更大。胁迫12 h时脯氨酸含量达到最大值,比胁迫0 h脯氨酸含量增加了100.41%,呈显著性差异(P<0.05)。胁迫24 h、48 h脯氨酸含量下降,但分别比胁迫0 h增加了79.1%、62.9%,呈显著性差异(P<0.05)。说明甜菜在受到胁迫12 h前通过不断增加脯氨酸含量来适应逆境,胁迫12 h后甜菜体内脯氨酸含量开始降低。

图3 短期盐胁迫对甜菜可溶性蛋白、脯氨酸含量的影响Fig.3 Effects of short-term salt stress on soluble protein and proline contents in sugar beet注:图中不同小写字母表示不同胁迫时间可溶性蛋白、脯氨酸含量差异达到P<0.05的显著性水平。
3 讨 论
植物叶片的气孔交换参数是衡量其光合作用强弱的重要指标,植物在盐胁迫下光合速率降低,原因包括气孔限制因素和非气孔限制因素[14-15]。若Ci和Gs的变化趋势一致,Ci随着Gs的降低而降低则为气孔限制因素。若Ci和Gs的变化趋势不一致,Ci随着Gs的降低不变或增加则为非气孔限制因素[16]。在NaCl浓度为100 mmol·L-1时,辣椒光合速率下降主要与非气孔限制因素有关,当NaCl浓度>150 mmol·L-1时,辣椒光合速率下降主要与气孔限制因素有关[17]。盐胁迫下蒙古莸苗木叶片光合速率下降的原因是非气孔限制因素[18]。研究发现,随着胁迫时间的增加甜菜叶片的Tr、Gs、Pn、Ci均呈现出先下降后上升的趋势。甜菜叶片Ci和Gs的变化趋势是一致的,因此甜菜幼苗净光合速率的变化趋势可能是由气孔限制因素影响的,甜菜通过关闭气孔来减少水分的散失,导致甜菜光合作用减弱。在胁迫12 h时气体交换参数达到最低,此时甜菜幼苗光合作用受到的影响最大。
MDA是细胞膜脂过氧化的产物,与细胞膜上的蛋白质结合造成蛋白质分子内与分子外的交联,从而破坏生物膜的结构与功能,测定MDA的含量来测定植株受损伤程度[19]。研究发现,在胁迫12 h时甜菜叶片MDA含量达到最高值,在胁迫12h后MDA含量开始逐渐降低,说明胁迫后期甜菜膜脂质过氧反应开始减缓,其对于盐胁迫有较强的适应能力。相对含水量是植物在抗逆过程中衡量其体内水分状况的重要指标,其值越大,说明其体内水分代谢能力越强[20]。前人研究结果表明随着钠离子浓度的增加叶片相对含水量逐渐降低[20],本试验结果表明,在同一钠离子浓度下胁迫12 h时甜菜叶片相对含水量达到最低值,在胁迫24 h、48 h时相对含水量增加,这是有机渗透物质与无机渗透物质共同调节从而减缓甜菜因盐胁迫造成的水分缺失,维持细胞的正常代谢。可溶性蛋白、脯氨酸是植物体内重要的渗透调节物质,植物通过增加和积累其含量来保持渗透平衡、保持细胞膜的稳定性并清除氧自由基,对于提高植物的耐盐性具有重要作用[21]。植物体内主要有3种渗透调节途径:①从外界介质中吸收渗透调节物质;②植株自身合成渗透调节物质;③增加Na+和K+的浓度进行渗透调节[22]。盐胁迫对植物的伤害首先表现为过度失水,在胁迫12 h前可溶性蛋白、脯氨酸含量快速增加,说明在盐胁迫前期植物体内通过增加可溶性蛋白、脯氨酸的含量来维持细胞渗透压平衡,与郭艳超等[21]、杨洋等[23]研究结果一致。在胁迫12 h后甜菜体内可溶性蛋白、脯氨酸的含量增长减缓,由于植物体内的Na+和Cl-等离子的含量逐渐升高导致植物体内渗透压升高,植物通过离子和来维持体内的渗透平衡[24]。盐胁迫前期植物通过积累渗透调节物质来适应逆境,胁迫后期由于植株体内无机渗透调节物质逐渐升高,渗透调节物质含量增加减缓。
4 结 论
本研究结果表明,在280 mmol·L-1的盐胁迫条件下,甜菜的气孔交换参数、相对含水量呈现先降低后增加的趋势,在胁迫12 h达到最低值。甜菜体内的MDA、脯氨酸、可溶性蛋白含量呈现先增加后降低的趋势,在胁迫12 h达到最高值。胁迫前期甜菜积累渗透调节物质的含量来提高体内渗透压来增强细胞的保水性。随着胁迫时间的增加,植物体内的Cl-和Na+等无机渗透调节物质逐渐增加,甜菜体内的脯氨酸、可溶性蛋白的增长速率减慢。
