SPECT/CT对胰腺癌125I植入术后剂量验证
2021-12-28吴维霞邢明泉周志刚郭言言邱晓辉李祥周
吴维霞, 邢明泉,周志刚, 郭言言,邱晓辉,李祥周
(1.亳州市人民医院 a.影像中心; b血液内科,安徽 亳州 236800; 2.郑州大学第一附属医院 放射科,河南 郑州 4500000)
胰腺癌发病隐匿,80%~85%胰腺癌患者发现时已失去了手术治疗的最佳时机[1]。对不可切除胰腺癌患者行125I粒子植入疗效突出且并发症少[2],可治疗各期胰腺癌[3],其具有肿瘤治疗靶区可控性强、对周围组织损伤小等多个优点[4],其疗效极大程度上取决于肿瘤周围剂量,但至今没有公认的最佳推荐治疗剂量[5]。当前粒子植入术后的剂量学验证仍以TPS术后验证为主要手段[6],误差较大。SPECT/CT显像体现核医学及CT双重优势,125I粒子植入术后行SPECT/CT融合显像,既能显示肿块内粒子的空间分布,又能反映肿块内的放射性分布,我科行125I粒子植入治疗胰腺癌患者18例,收到良好的效果,125I粒子植入评价粒子植入后的剂量验证具有重要意义,本研究旨在探讨SPECT/CT 融合显像用于125I粒子植入术后剂量验证的可行性,以期寻找放射性粒子植入术后剂量验证的新的可靠方法。
1 资料与方法
1.1病例选择 2016年9月至2017年12月期间于郑州大学第一附属医院接受125I粒子植入治疗患者18例,术后24小时内行SPECT/CT显像,其中男性11例,女性7例,年龄42~75岁,中位年龄57岁,平均年龄为(57.4±8.4)岁,经病理证实为腺癌17例,黏液癌1例,其中位于胰头10例,位于胰体尾8例,肿块最大径约为24.7~71.3 mm,平均最大径为(44.3±13.1) mm,植入粒子19~87粒。按国际抗癌联盟(UICC)(第8版)中胰腺癌TNM分期系统,其中ⅡB期3例,Ⅲ期12例,Ⅳ期3例。入组标准:(1)经病理学诊断为胰腺癌,且不适宜手术治疗或者患者自身不愿意进行手术治疗者。(2)直径<75 mm的实体肿瘤,并且可测量或者可评价。(3)预计生存时间需>3个月。(4)体能评分(Karnofsky 评分)≥70分。(5)无严重心肺、肝肾功能障碍,且近期无急性感染。(6)白细胞计数≥3×109/L,中性粒细胞绝对数≥1.5×106/L,血红蛋白浓度≥90 g/L,血小板计数≥10×109/L。(7)肿瘤没有侵犯周围重要大血管。排除标准:(1)存在大量腹水或者伴有远处广泛转移或者存在严重感染者。(2)伴有严重的心血管或精神疾病、患有其他不适宜手术的疾病或者全身情况处于衰竭状态。(3)Karnofsky评分小于70 分。(4)预计生存期不超过3个月。(5)严重的凝血功能异常或者白细胞计数<3×109/L、血小板小于<7×109/L。(6)排除失访患者。
1.2主要材料与仪器125I放射性粒子是由上海欣科医药有限公司提供,SPECT/CT显像仪器为Symbia T16,采用低能高分辨准直器,设能峰为35 keV, 窗宽为20%。TPS是由北京科霖众医学技术研究所研发。放射性粒子植入枪是由上海欣科医药有限公司所提供。一次性18G粒子植入针是由日本八光株式会社所生产。放射防护用物。
1.3方法
1.3.1125I粒子植入术 (1)术前计划:将CT图像传输至TPS,常规逐层勾画出肿瘤靶区体积(gross tumor volume, GTV)以及邻近可能危及的器官,重建出肿瘤三维立体图像,设定胰腺肿瘤处方剂量以及粒子的活度,调整植入针和粒子的位置,确定进针路线,计算出患者所需穿刺针、粒子的数目,以及靶区剂量分布,模拟计算出剂量体积直方图(dose volume histogram,DVH)。肿瘤靶区处方剂量设为120 Gy。植入前对所要植入的10%放射性粒子进行随机测定,每个粒子的放射性活度所允许的偏差控制在±5%范围内。(2)术中过程:患者局部麻醉在CT引导下全程监控下进行操作,取仰卧位,在腹正中线处贴标记针,行CT平扫,进一步确定病变的确切位置、进针角度、进针点以及进针深度。取穿刺针沿着定位点按计划角度尽量将针进到计划深度,再CT平扫,确定进针深度及进针角度,若未达预期计划,再缓慢进针到计划深度,再次CT平扫,按此步骤至确定进针到理想位置,按TPS在肿瘤内每间隔10 mm植入1粒125I粒子,接着按前面步骤再次调整层面及进针方向,依次在不同层面、后退式植入125I粒子。确定粒子分布满意之后,退出粒子穿刺针,在穿刺处按压约5 min,记录植入125I粒子的总数,再次行CT平扫,确定有无粒子移位、出血等并发症。术后行剂量学验证、质量评估(包括粒子分布、剂量重建)。将术后CT图像(可来自术后SPECT/CT检查)传输至TPS行剂量验证:125I粒子植入后胰腺肿块层面的CT图像录入TPS,逐层勾画出肿块轮廓并计算出DVH图。如术后验证结果与植入前计划不相符,发现有剂量稀疏区,即“冷区”,可行补种治疗。
1.3.2显像方法 患者行125I放射性粒子植入术后24小时内行SPECT/CT显像。SPECT显像采集条件为双探头平行采集,矩阵128×128,双探头各自旋转180°,20s/帧,1帧/6°,共采集64帧,按标准程序处理得到SPECT图像。采集完成后,再按照SPECT扫描视野行CT扫描,使两者视野相一致。CT图像采集条件为120kV,矩阵512×512,层厚2 mm,螺距为1。图像重建采用flash 3D迭代技术,使用衰减校正。通过计算机处理得到SPECT、CT图像并进行图像融合。
1.3.3图像分析及数据测量 在SPECT/CT融合图像上可以清楚地看到不同颜色细线样的光环,由两位核医学科主治以上医生分别对影像进行分析和诊断,观察记录肿瘤靶区放射性分布情况、是否有粒子移位等信息,若意见不一致,商讨确定。在放大的融合图像中逐层沿黄、绿、蓝、紫四种不同颜色光环勾画,标记为区域A、B、C、D,将鼠标放在不同区域即可显示该层面该区域放射性浓聚区γ总计数值(Counts)、体积(cm3)及层厚,算出区域A、B、C、D内总计数值及总体积,再计算出区域A、B、C、D单位体积内放射性计数(Counts/cm3)。重复勾画、计算取均值。将SPECT/CT检查的CT图像导入TPS,勾画靶区,调至骨窗,拾取粒子,进行术后剂量验证,得到等剂量曲线分布图,观察肿瘤周边的放射性浓聚程度与等剂量曲线分布的情况,评估并记录肿瘤靶区的覆盖率,覆盖率为代表处方剂量的放射性浓聚区所覆盖体积与肿瘤靶区总体积的百分比,相当于V100,即100%处方剂量覆盖体积占靶体积的百分比。在TPS上调整所勾画的靶区,将每一层面逐层与区域A、B、C、D对应,进行剂量计算,从DVH图中可知所勾画靶区的平均剂量。重复操作,计算出区域A、B、C、D分别对应区域的平均剂量。重复计算取均值。将放射性浓聚区的单位体积放射性计数值与该区剂量相关联,见图1~5。
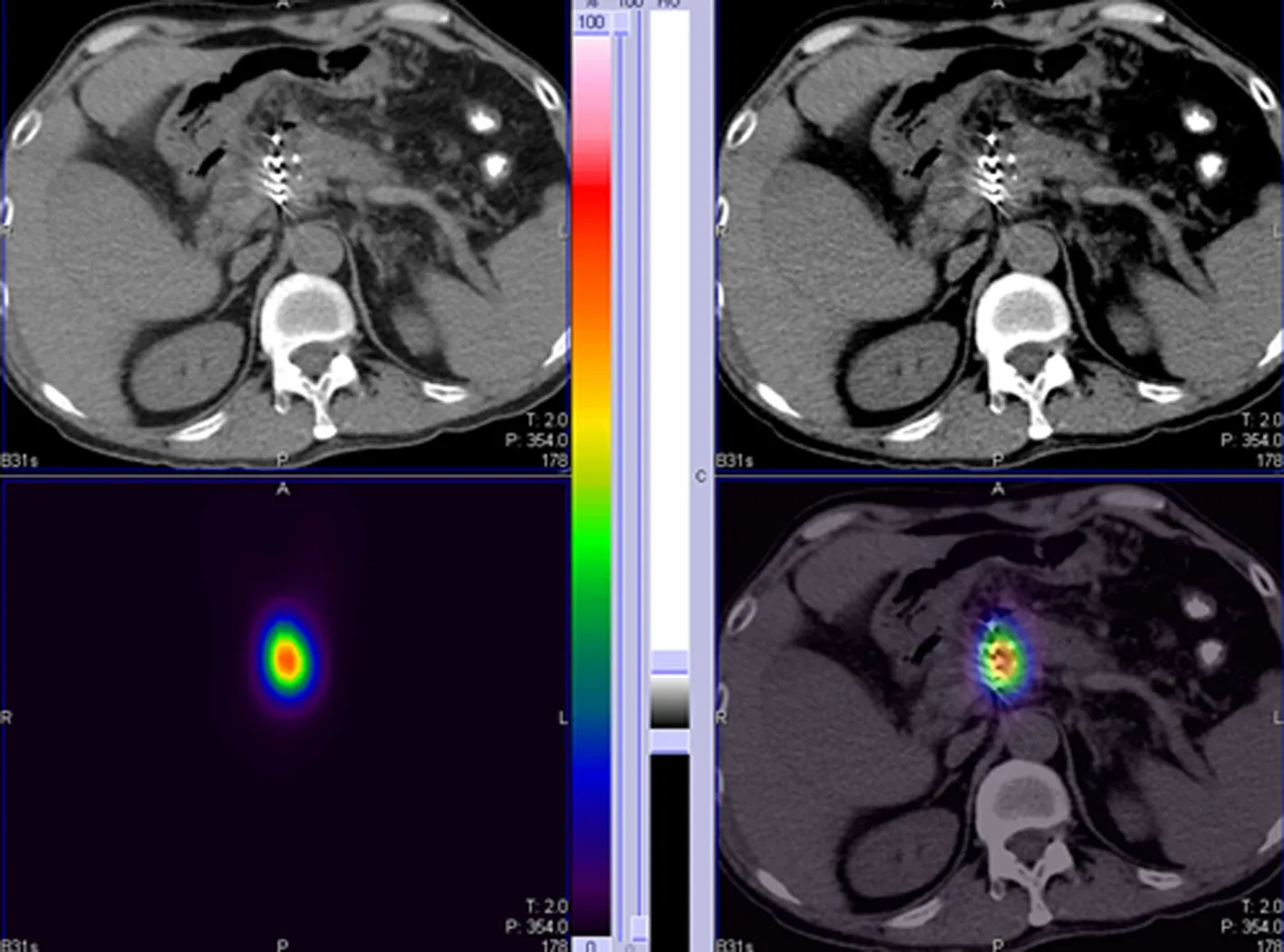
图1 SPECT/CT融合图像

图2 SPECT图像 图3 SPECT图像中勾画放射性活度区
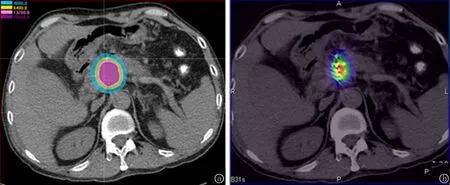
图4 同一层面肿瘤周边的放射性浓聚程度与等剂量曲线分布情況 a.等剂量曲线分布图;b.SPECT/CT融合图像
1.3.4肿瘤近期治疗效果评价指标 主要依据术前、术后2个月复查的CT图像,术后2个月CT图像可以为术后SPECT/CT检查所得CT图像,按照实体肿瘤的疗效评价标准1.1版(Response Evaluation Criteriain Solid Tumors Version1.1, RECIST 1.1)评价疗效:①完全缓解(complete response,CR):所有目标病灶消失;②部分缓解(partial response,PR):基线病灶长径总和缩小≥30%;③疾病稳定(stable disease,SD):肿瘤病灶缩小未达PR 或增加未达PD;④疾病进展(progressive disease,PD):肿瘤病灶长径总和增加≥20%或者出现新的病灶。治疗有效为完全缓解(CR)+部分缓解(PR),有效率定义为(CR+PR)/(CR+PR+PD+SD),肿瘤疾病控制率定义为(CR+PR+SD)/(CR+PR+PD+SD)。
1.3.5统计学方法 应用SPSS 17.0统计学软件分析,计量资料采用中位数(四分位间距)[M(Q)]表示。两连续随机变量且服从正态分布的相关分析采用Pearson相关分析法,不满足条件或分类变量之间的关联分析采用Spearman秩相关分析法,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1近期疗效评价 术后2个月复查CT,依据CT图像及软件系统,测量肿瘤最大径,观察对比术前肿瘤最大径的大小,评价肿瘤近期治疗效果CR 1例,PR 10例,SD 5例,PD 2例,治疗有效率为61.1%。将覆盖率与近期疗效进行关联分析,得Spearman秩关联系数rs=0.587,P=0.010。
2.2单位体积内放射性浓聚处γ计数值与所接受剂量的关系125I粒子植入术后24 h行SPECT/CT显像,并进行图像融合。在融合图像上在放大的融合图像中逐层勾画出区域A、B、C、D,计算出区域A、B、C、D所代表的放射性浓聚区的单位体积内γ计数(Counts/cm3),再在TPS上计算相应剂量,单位体积内γ计数值与所接受剂量呈正相关(r=0.422,P<0.01),见表1。

表1 放射性浓聚区的单位体积内γ计数与所接受剂量关系[M(Q)]
2.3随访 有7例患者在随访第2个月时行局部SPECT/CT断层融合显像,2例发现肿瘤靶区局部放射性分布相对较稀疏,逐行冷区125I粒子补种术。1例新发现游离粒子。
3 讨 论
胰腺癌是一种常见的消化系统恶性肿瘤[7],125I粒子植入治疗胰腺癌是最常用的微创治疗方式之一,疗效突出[8],本研究18例患者总有效率为61.1%,肿瘤疾病控制率为88.9%,疗效显著[9]。而125I粒子植入治疗胰腺癌的疗效很大程度上取决于肿瘤靶区剂量分布情况,但125I粒子植入治疗胰腺癌的最佳治疗剂量目前国内外尚未达到临床共识[10],国内推荐的125I粒子植入治疗胰腺癌的匹配周缘剂量(matched peripheral dose, MPD)为110~160 Gy,适合胰腺癌患者的最佳治疗剂量尚需进一步研究。目前术后剂量学验证仍以术后TPS验证为标准,但其是根据粒子数目、位置及活度计算出来的,难以保证计算出来的就是实际剂量[11]。粒子植入后可能会游走,也可能会因为CT金属伪影[12]等原因导致粒子数目、位置识别困难,造成术后验证不准确,影响对预后的评估[13],所以极需一种有效可行的方法来探测粒子植入后体内实际的剂量分布。125I放射性粒子可以作为核医学显影的放射源,进行SPECT/CT融合显像,不仅可以显示出体内的剂量分布情况,观察肿瘤靶区是否被一定放射性浓聚区所完全覆盖,使术后剂量分布在一定程度可视化,并且术后一段时间也可再次检查,观察粒子周围放射性分布情况;另外,SPECT/CT融合图像示放射性分布不受粒子伪影影响,还可以及时发现“冷区”及粒子移位。SPECT/CT显像可以直接探测出放射性粒子所释放出来的γ射线,125I粒子植入术后行SPECT/CT检查可以清楚显示体内的放射性浓聚区,而放射性浓聚程度可以用放射性计数量化,可在一定程度上将其可视化[14]。SPECT/CT用于放射性粒子植入术后的剂量验证[15],有以下优势:①无需了解粒子当前的活度及数目。放射性粒子释放的射线与粒子实际活度及数目直接相关,粒子的数目越多、活度越大,其所释放出来的射线就越多,测得放射性浓聚区的放射性计数值也就越大[16]。②无需知道粒子的精确位置,SPECT/CT直接探测体内粒子释放出来的射线,与粒子精确位置关系不大,即使不知道粒子的位置,也可以探测到粒子发出的射线[17]。③SPECT/CT显像可使得剂量可视化,简单、直观、易行。④由于不需要考虑放射性粒子的数目、位置等,可反映分期多次行放射性粒子植入术后患者的实际剂量。
本研究通过对18例胰腺癌患者125I植入术后行SPECT/CT显像,发现其可使125I放射性粒子植入术后粒子周围剂量在一定程度上达到可视化,靶区单位体积内放射性计数值与接受剂量为正相关关系,SPECT/CT显像有望成为粒子植入后剂量验证的有效方法,但是本研究由于病例数相对较少,未能揭示SPECT/CT探测到的放射性计数与所植入的肿瘤内粒子放射性活度的确切关系,尚需扩大样本量进一步研究探索。
