颈动脉窦电刺激对野百合碱诱导肺动脉高压大鼠的影响
2021-12-28胡志玲代地林胡邦望包明威
陈 洁 胡志玲 代地林 胡邦望 舒 玲 吴 园 张 艳 包明威
肺动脉高压(pulmonary arterial hypertension, PAH)是一种以肺血管重构和肺血管阻力进行性增加为特征的慢性疾病,最后导致右心衰竭和死亡[1]。PAH发病机制复杂,预后极差,其中确诊患者3年内死亡风险高达30%[2]。目前有很多药物可以治疗PAH,主要是舒张肺血管,例如磷酸二酯酶5抑制剂西地那非和内皮素受体拮抗剂波生坦等,但是这些药物仍然不能治愈肺动脉高压患者,PAH患者的病死率依然很高[1]。
研究已经证实,PAH患者存在交感神经过度激活和迷走神经功能的损害,而且这些因素与PAH患者的运动耐受力和预后密切相关[3, 4]。同时,肺动脉解剖研究表明,肺动脉及左右分支含有丰富的交感、副交感神经纤维,这些神经可以分泌神经递质与肺血管上相应的受体结合,导致肺血管收缩[5]。早期有研究表明,肾上腺素阻滞剂可以治疗PAH,降低肺动脉压力,改善肺动脉重构和右心室功能[6]。同时,最新研究表明,一种口服乙酰胆碱酯酶抑制剂吡斯的明可以通过兴奋迷走神经和提高血浆迷走神经递质水平,改善PAH大鼠的肺动脉重构和右心衰竭[3]。同时,近年来研究表明,非药物干预自主神经也可以治疗肺动脉高压,例如肺血管去神经术、肾交感去神经术、颈上神经节横断等,这些治疗方法可以通过降低交感神经张力从而改善肺动脉重构和右心室功能[7]。因此,笔者认为非药物干预自主神经是未来治疗PAH的一个新的研究方向。
颈动脉窦压力感受器电刺激(carotid baroreceptor stimulation,CBS)可以精准调节自主神经功能,抑制交感神经张力和增加副交感神经张力[8]。最新临床研究表明,CBS可以通过提高迷走神经功能改善顽固性心力衰竭患者的心功能,降低患者的N末端脑钠肽(NT-proBNP),提高患者的运动耐受力[9]。同时,此前有研究表明,CBS可以改善慢性心力衰竭犬的左心室重构和功能[10]。因此,假设CBS可以起到保护MCT诱导PAH大鼠的作用。
材料与方法
1.实验动物:SPF级SD雄性大鼠,体质量为180~220g,购自湖南斯莱克景达实验有限公司。所有大鼠饲养在SPF环境中,在自由饮食、光照/黑暗时间为12h/12h、温度22±1℃的环境中喂养。
2.野百合碱诱导肺动脉高压模型的建立和实验分组:适应性喂养1周后,将大鼠随机分为4个组:①Con-sham组:腹腔注射0.9%NaCl注射液,置入CBS模型,不发放电刺激;②Con-CBS组:腹腔注射0.9% NaCl注射液,置入CBS刺激仪,并发放电刺激;③PAH-sham组:腹腔注射野百合碱(MCT),置入CBS模型,不发放电刺激;④PAH-CBS组:腹腔注射野百合碱,置入CBS刺激仪,并发放电刺激。适应性喂养1周后,所有大鼠置入CBS 刺激仪或者CBS 模型。术后恢复1周,于第2周末,Con-sham 和Con-CBS组给予一次性腹腔注射0.9%NaCl注射液(60mg/kg),PAH-sham组和PAH-CBS组给予一次性腹腔注射野百合碱(MCT,60mg/kg, 美国Sigma-Aldrich公司),同时,Con-CBS组和PAH-CBS组CBS仪器开始发放电刺激,直至第6周末。
3.颈动脉窦电刺激仪的置入:大鼠以45mg/kg戊巴比妥钠全身麻醉后,于颈部正中切口,分离右侧颈动脉窦并用卡夫电极包绕,CBS刺激仪(G3NIX-1010,上海杰升生物科技有限公司)或CBS刺激仪模型埋藏于背部皮下,电极导线经皮下隧道连接于CBS刺激仪或CBS模型。Con-CBS组和PAH-CBS组术后1周发放电刺激,以引起血压下降最低电压的10%或者心率下降15%为刺激电压,刺激频率设置在10Hz,脉冲宽度1ms,每个周期刺激时间5min,间隔时间1min,持续至实验结束。
4.大鼠心脏超声检测:MCT注射4周后通过异氟烷麻醉大鼠,暴露大鼠左侧胸部。采用VINNO6VET型超声心动仪检测心功能指标,使用15Hz的大鼠超声探头,经胸二维、M型及脉冲波多普勒模式获取超声心动图。据研究报道方法测量各组大鼠的心脏超声指标[3]。左心室射血分数和左心室短轴缩短率通过M型超声获得;肺动脉加速时间、射血时间通过主动脉瓣水平胸骨旁短轴测量右心室流出道的脉冲波多普勒流速剖面获取,同时获取右心室流出道内径;右心室舒张末期前后径和右心室舒张末期厚度通过胸骨旁短轴图显示;通过心尖四腔心切面测量并计算右心室面积变化率。
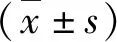
结 果
1.CBS对PAH大鼠肺动脉加速时间的影响:注射MCT 4周后,大鼠出现呼吸加快,体质量减轻,摄食量减少,脚趾发绀,与Con-sham组比较,PAH-sham组大鼠PAT及PAT/ET显著减少,肺血流频谱提示典型的“匕首样改变”,提示肺动脉高压模型成功,而CBS可以增加PAH大鼠的PAT及PAT/ET(图1、图2)。
图1 CBS对PAH大鼠肺动脉加速时间及肺动脉加速时间/射血时间的影响A.肺动脉加速时间;B.肺动脉加速时间/射血时间;与Con-sham组比较,#P<0.01;与PAH-sham组比较,*P<0.05,**P<0.01

图2 CBS对PAH大鼠肺动脉多普勒血流频谱代表图A.Con-sham组;B.Con-CBS组;C.PAH-sham组;D.PAH-CBS组
2.CBS对PAH大鼠的右心室结构和功能的影响:MCT注射4周后,PAH-sham组大鼠的RVEDT、RVAPDd、RVOTD增加,RVFAC降低,而且CBS干预可以改善PAH大鼠上述指标的恶化(图3)。
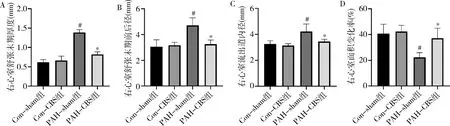
图3 CBS对PAH大鼠右心室结构和功能的影响A.右心室舒张末期厚度;B.右心室舒张末期前后径;C.右心室流出道内径; D.右心室面积变化率;与Con-sham组比较, #P<0.01;与PAH-sham组比较,*P<0.01
3.CBS对PAH大鼠左心室功能的影响:注射MCT 4周后,与Con-sham组比较,PAH-sham组大鼠的左心室射血分数及短轴缩短率无明显减低或升高,各组之间比较,差异无统计学意义(图4)。
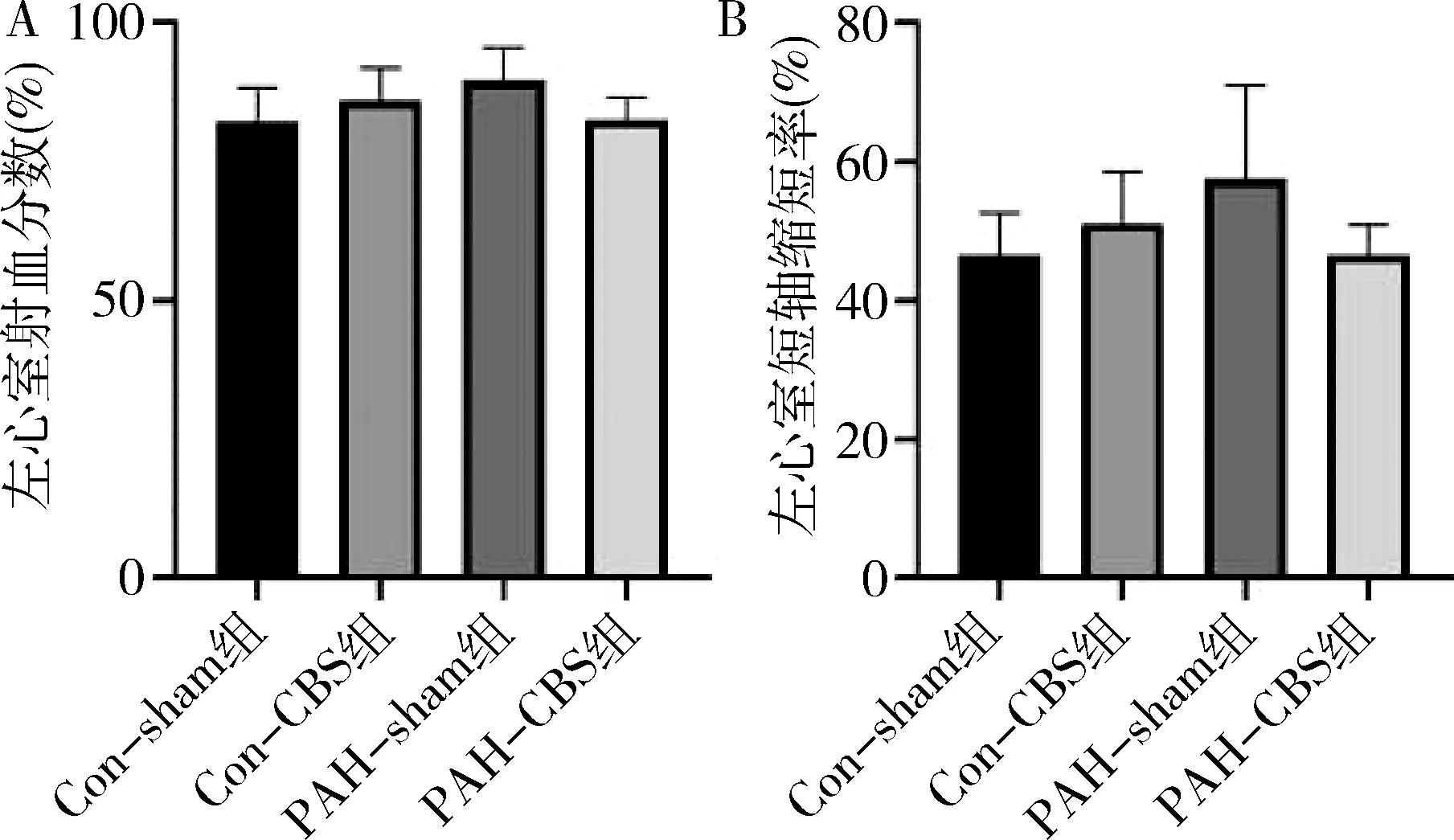
图4 CBS对PAH大鼠左心室功能的影响A.左心室射血分数;B.左心室短轴缩短率
讨 论
通过心脏超声评估,本研究证明了CBS可以改善MCT诱导肺动脉高压大鼠的右心室结构和功能。PAH的发病机制复杂,目前尚不明确,但是不同类型的PAH具有相同的病理生理过程,在疾病的中晚期,肺动脉重构与右心室功能不全是其相同的发病机制[11]。近年来临床证据表明,交感神经过度激活在PAH的发生、发展过程中起着关键作用[7]。早期临床研究发现,伴右心衰竭的PAH患者存在神经内分泌激活,血浆及肺组织中的去甲肾上腺素升高,其中血浆中去甲肾上腺素水平与肺血管阻力呈正相关,与患者的预估生存率呈负相关[12]。基于交感神经激活在PAH发展过程中的重要作用,干预交感神经也成为未来PAH的治疗方向。当前干预交感神经的药物治疗主要是肾上腺素受体阻滞剂。基础研究表明肾上腺素受体阻滞剂可以减轻肺动脉压力,改善右心室功能,降低PAH大鼠的死亡率[6]。但是临床试验表明,β受体阻滞剂会使患者运动耐受力以及血流动力学指标的恶化,因此,目前指南并没有推荐PAH患者常规使用β受体阻滞剂治疗[7]。
目前使用药物干预交感神经系统治疗PAH仍存在争议,而非药物干预交感神经的基础试验表现出良好的前景。经胸肺动脉去神经术可以降低血清中的去甲肾上腺素,从而改善右心室的重构和功能,其潜在机制与降低肺动脉周围的交感神经密度有关[5]。颈交感神经横断也可以通过降低交感神经活性,降低PAH大鼠的右心室收缩压、右心室肥厚指数,提高三尖瓣环收缩位移及心排出量,从而改善右心室功能[13]。这些研究说明非药物干预交感神经可以改善PAH大鼠的右心室功能。
PAH时,短期交感兴奋可以代偿增加心排出量,但是长期慢性交感兴奋会加重右心室的不良重构,加重PAH的进展。同时,交感神经受到刺激后,交感神经末梢会释放多种神经激素,这些神经激素与右心室上相应的受体结合,参与肺动脉高压的发展。同时,还通过超声评估了MCT及CBS对大鼠左心功能的影响,发现各组之间比较,差异均无统计学意义,笔者更多地关注CBS对PAH大鼠右心室功能的影响。右心室功能与PAH患者的严重程度和预后密切相关,临床研究显示,右心衰竭是导致PAH患者死亡的重要原因[14,15]。同时,自主神经系统的损害与PAH的右心室功能紊乱密切相关,交感神经激活程度与患者的运动耐受能力呈负相关,是PAH临床恶化的一个重要预测因子[3,4]。CBS可以降低交感神经张力,增加迷走神经张力,笔者先前的研究也表明CBS可以通过调节离子通道和自主神经重构进而抑制室性心律失常[16]。
PAH时,肺动脉血流超声频谱表现为,收缩早期加速,加速后陡峭上升,PAT明显缩短,与MCT诱导PAH大鼠的肺血流频谱结果一致,也呈现典型的“匕首样”改变。由于条件限制,本研究暂时不能获取肺动脉收缩压、三尖瓣和肺动脉瓣反流速度等直接反映肺循环血流的指标,因此笔者通过测量肺动脉加速时间来间接评估肺动脉压力。有研究表明PAT越短,提示肺血管阻力和肺动脉压力越高[17]。本研究也表明,PAH大鼠的肺血流频谱PAT明显变短,而CBS可以提升PAH压大鼠的PAT,提供了CBS可以降低PAH大鼠的肺动脉压力的间接证据。同时,CBS可以降低右心室舒张末期厚度及右心室舒张末期前后径,说明CBS可以改善PAH大鼠的右心室肥厚以及降低右心室容积。一项临床研究显示,RVFAC不仅能够反映右心室的收缩功能,而且RVFAC与右心室射血分数呈正相关,比起三尖瓣环收缩位移更能反映肺动脉患者的血流动力学的严重程度[18]。CBS可以降低MCT诱导肺动脉高压大鼠的RVFAC,说明CBS不仅可以提高MCT诱导PAH大鼠的收缩功能,而且再次为CBS降低PAH大鼠的血流动力学参数提供了间接证据。因此,笔者推测CBS可能可以通过调节自主神经功能,在一定程度上降低肺动脉压力,并改善右心室的结构和功能,从而起到保护MCT诱导PAH大鼠的作用。
综上所述,笔者通过检测MCT诱导PAH大鼠的肺血流及右心室心脏超声,发现CBS可以改善MCT诱导PAH大鼠的右心室功能,其机制可能与降低肺动脉压力和调节自主神经的平衡有关。这一研究为早期干预和治疗PAH提供了新的方案。本研究中应用MCT诱导PAH大鼠模型,这一定程度模拟了临床上的特发性肺动脉高压类型,但CBS对于其他类型的PAH是否有效仍需进一步研究。此外,CBS对PAH大鼠的治疗作用与自主神经之间的相互作用关系以及其具体分子机制尚需进一步探讨。
