电荷调控下Ti3C2O2和V2CO2吸附CH4的第一性原理计算
2021-12-27闪静祎王军凯于书敏张晶晶袁一博夏启勋胡前库周爱国
闪静祎, 王军凯, 于书敏, 张晶晶, 袁一博, 夏启勋, 胡前库, 周爱国
(河南理工大学 材料科学与工程学院 河南省深地材料料学与技术重点实验室, 焦作 454003)
1 引 言
甲烷(CH4)是大气中仅次于二氧化碳的最重要的温室气体[1],占了约25%的人为温室气体效应[2],气体浓度的爆炸极限为5%[3]. 近年来,国内外频频发生矿井内瓦斯爆炸事件,造成大量的经济损失和人员伤亡,其主要引发原因是CH4在煤矿下的聚集[4]. 因此,在泄漏气体系统中,探测或捕获低浓度的CH4气体对于预警和防止其危害具有十分重要的意义.
目前,国内外常用的甲烷探测方法有半导体金属氧化物探测[5-7]、气相色谱法[8]、光声传感器[9-11]、石英晶体微量天平传感器[12]等. 在这些技术中,半导体金属氧化物能够根据CH4气体的存在改变电导率或电阻率,得到了广泛的研究,最常见的是氧化锡传感器[5]. 但是传统的基于氧化锡的气体传感器存在气体响应差、工作温度高、稳定性低、缺乏选择性[13]等不足之处. 气相色谱的分离能力可以将CH4和常见干扰气体进行分离,但因存在需要耗材、响应速度慢等缺点使得其应用范围受到了很大限制[14]. 基于差分亥姆霍兹共振的光声系统与近红外二极管激光器一起使用,虽然可以检测大气压或减压条件下气流中的CH4[10],但整个系统非常复杂. 因此,寻找具有高效CH4探测和捕获功能的先进材料是非常必要的.
MXene是层状过渡金属碳化物、氮化物,最近作为一类新的2D石墨烯状材料出现,并在材料科学领域引起了极大兴趣[15, 16],其化学通式为Mn+1XnTX(n = 1、2、3),M代表早期过渡金属,如Ti、Zr、V、Mo等,X代表C或N元素,Tx为表面基团,通常为-OH,-O,-F和-Cl[16, 17]. 到目前为止,理论和实验研究已经广泛报道了MXene具有良好的热稳定性[18]、电化学性质[19]及吸附性[20, 21]等. 鉴于MXene材料良好的吸附性能,近年来,已经有部分学者研究了MXene材料对一些气体的吸附行为. Lee[22]等人用Ti3C2TX传感器检测乙醇、甲醇、丙酮和氨气,其中氨气的响应最高,丙酮的响应最低,表明Ti3C2TX对氨具有较高的敏感性. Yu[23]等人研究了单层Ti2CO2对NH3的吸附,发现单层Ti2CO2可以作为潜在的高选择性和高灵敏度的NH3传感器. Hu[24]等人系统的研究了二维Sc2C的储氢特性,发现吸附位置的不同,氢原子受束缚能不同. Guo[20]等人计算表明所有的M2C型MXenes均具有自发的CO2捕获和活化能力. Wu[25]等人发现Ti3C2可以作为室温下高选择性的NH3检测传感器. Liu[26]等人发现由NaF和KF制备的MXenes在高压下吸附CH4,在低压下释放CH4. 这表明MXene材料对CH4气体的吸附较弱.
研究表明,电荷调控是调节二维材料性能的有效手段[27, 28]. Qin[29, 30]等人发现中性单层C2N[29]、C3N[30]对CO2分子的吸附较弱,而通过改变C2N、C3N的电荷态可以显著增强其对CO2的吸附作用. NadarajSathishkumar[31]等人发现N掺杂五元环石墨烯(PG)对CO2的吸附较弱,而在电荷诱导作用下,其对CO2的吸附强度明显增强. Sun[32]等人的研究也表明通过改变BN纳米片的电荷状态,可以控制和逆转BN纳米片上的CO2吸附和解吸. Yoon[33]等人发现分子氢在带正电荷或带负电荷的富勒烯上的结合强度可以显著提高到0.18-0.32 eV. Xiao[34]等人的研究表明O端半导体MXenes是用于NH3传感器或捕获的优秀材料,通过控制系统中的电荷状态可以实现NH3的可逆释放和捕获. 然而,电荷调控下不同MXenes材料对CH4气体的吸附性能尚缺乏充分的研究.
基于此,本文采用第一性原理计算的方法研究了Ti3C2O2和V2CO2与CH4气体分子间的相互作用,着重研究了电荷调控作用下Ti3C2O2和V2CO2对CH4气体分子的吸附行为.
2 计算方法
本文采用Materials Studio软件中的DMol3程序包进行第一性原理计算[35],采用电子密度函数对材料的性质进行有关分析. 所有计算均采用广义梯度近似(GGA)泛函PBE进行[36, 37],布里渊区K点网格划分采用Monkhorst-Pack方法[38]. 在几何优化过程中,能量、力参数及最大位移的收敛标准分别为 1×10-5Ha,0.002 Ha/Å,0.005 nm. SCF计算收敛的电子密度变化小于1×10-6Ha. 本文构建了Ti3C2O2和V2CO2的3×3×1超胞,为了尽可能避免Ti3C2O2和V2CO2二维材料与其周期性重复结构之间的相互作用,使用20 Å的真空层(如图1所示).
文中采用Hirshfeld电荷分布判断 CH4气体分子被吸附前后的电荷量转移情况. 此外,为了定量描述Ti3C2O2和V2CO2材料对CH4气体分子的吸附强度,我们定义Ti3C2O2和V2CO2对CH4气体分子的吸附能Eads为:
Eads=EM+CH4-(EM+ECH4)
其中,EM+CH4表示Ti3C2O2、V2CO2分别与CH4气体分子吸附后体系的总能量,EM表示吸附前Ti3C2O2、V2CO2的能量,ECH4表示吸附前CH4气体分子的能量.Eads越负,表明吸附体系越稳定.

图1 3×3×1Ti3C2O2超胞和3×3×1V2CO2超胞俯视图和主视图. (A-C)表示原子可能的吸附位点Fig. 1 Top and side view of the optimized structure of Ti3C2O2 with 3×3×1 supercell and V2CO2 with 3×3×1 supercell. (A-C) represent the possible adsorption sites for metal atoms
3 结果与讨论
3.1 无电荷调控下CH4气体分子在Ti3C2O2和V2CO2表面的吸附

图2 甲烷的不同取向模型Fig. 2 Different orientations of CH4
首先研究了未施加电荷条件下Ti3C2O2和V2CO2对CH4气体分子的吸附行为. 考虑了CH4气体分子的三种可能吸附位点,即A、B和C,如图1所示. 其中A位点位于O原子的正上方,B位点位于C原子的正上方,C位点分别在Ti和V原子正上方. 同时考虑了CH4气体分子的三种不同取向,如图2所示:一个H原子朝向Ti3C2O2和V2CO2表面(a),两个H原子平行Ti3C2O2和V2CO2表面(b),三个H原子所在平面平行Ti3C2O2和V2CO2表面(c).
3.1.1Ti3C2O2对CH4气体分子的吸附
将不同取向的CH4气体分子置于Ti3C2O2表面的不同吸附位点上方3.000 Å处,通过MaterialsStudio软件中的Dmol3模块对初始模型进行优化,得到的最终吸附模型如图3所示. 表1示出了CH4气体分子吸附于Ti3C2O2时对应的吸附能(Eads)、距离(d)和电荷转移(CT)数值. 从中可以看出,Ti3C2O2对不同取向CH4气体分子进行吸附时,吸附能均为负值,表明不同取向CH4气体分子均可以被Ti3C2O2吸附,但吸附能力较弱,吸附能数值均大于-0.5 eV[39],属于物理吸附,吸附距离基本变化不大,电荷转移微弱. Ti3C2O2不适合直接用于探测/捕获CH4气体分子.
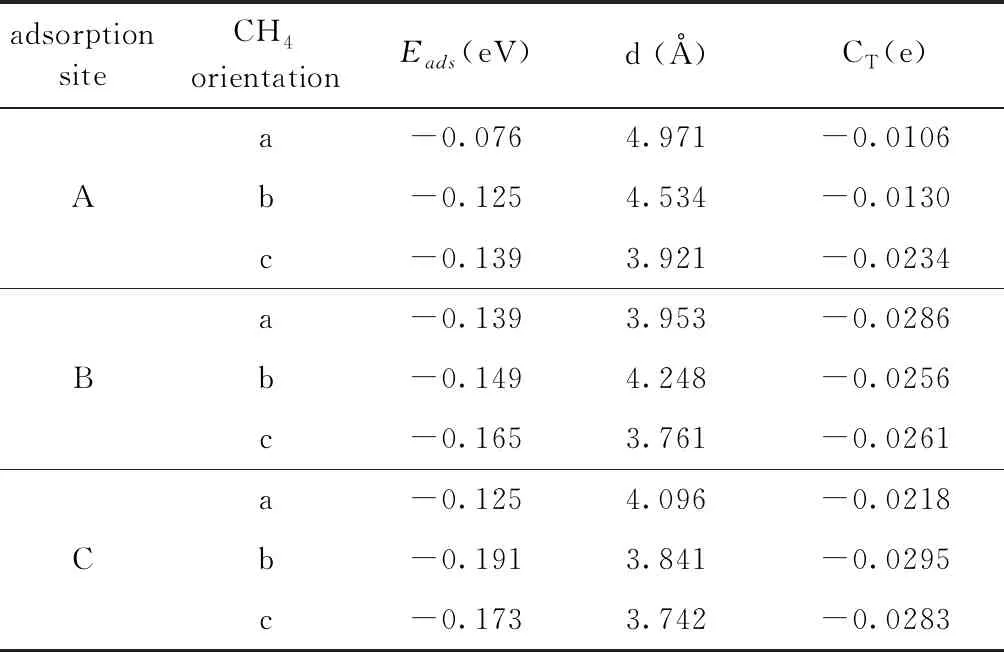
表1 Ti3C2O2与CH4气体分子间的吸附能、距离及电荷转移
3.1.2V2CO2对CH4气体分子的吸附
采用同样的方法研究了V2CO2和CH4气体分子吸附行为. V2CO2表面不同吸附位点对不同取向CH4气体分子的吸附能(Eads)、距离(d)和电荷转移(CT)如表2所示. 从表2可知,V2CO2对CH4气体分子的吸附行为与Ti3C2O2非常相似,基本仍然属于物理吸附. 这表明V2CO2也不适合直接用于探测/捕获CH4气体分子.

图3 不同取向的CH4气体分子吸附在Ti3C2O2表面不同位点的优化结构Fig.3 Optimized structures of different orientation CH4 adsorbed at different sites on Ti3C2O2 surface
3.2 电荷调控下CH4在Ti3C2O2、V2CO2表面的吸附
本文选择c取向的CH4进行一步研究了电荷调控下Ti3C2O2、V2CO2是可以作为CH4气体分子探测/捕获的候选材料. 分别对Ti3C2O-CH4和V2CO2-CH4体系在-1、-2及-3电荷态时的性质进行分析,研究电荷调控是否有利于Ti3C2O2和V2CO2对CH4气体分子的吸附.
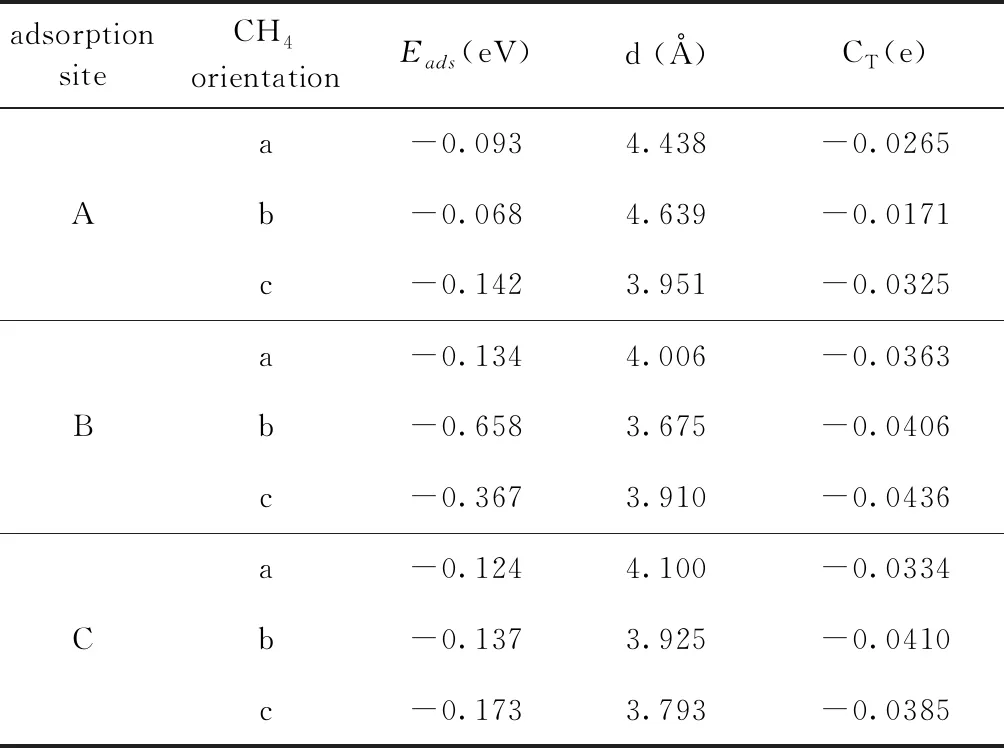
表2 V2CO2与CH4气体分子间的吸附能、距离及电荷转移
3.2.1电荷调控下Ti3C2O2对CH4的吸附
电荷调控下,CH4在Ti3C2O2表面的A、B、C三个吸附位点吸附能、吸附距离、电荷转移变化如图4所示. 观察图4(a)可知:总体而言,改变Ti3C2O2的电荷态时,CH4与Ti3C2O2之间吸附能也全部为负值,因此在电荷调控下,Ti3C2O2表面的三个吸附位点对于CH4气体分子仍然具有吸附作用. 进一步通过对比发现,吸附能随电荷态数量的增加而逐渐增加,吸附作用从物理吸附逐渐转变为化学吸附. 在Ti3C2O2-CH4吸附体系中,随着外加负电荷的增加,B位点和C位点的吸附能变化程度基本一致均显著增加. A位点构型在-1电荷态时,吸附能基本不变,但随着负电荷的加入,吸附能增加而且增幅略大于B、C两个位点. 具体而言,随着外加负电荷从0增至-3 e,B位点的吸附能从-0.165 eV急剧增加到-1.059 eV,C位点的吸附能从-0.173 eV增加到-1.078 eV,A位点的吸附能从-0.139 eV增加到-1.141 eV,三个吸附位点吸附能均呈增加状态. 表明外加负电荷后的Ti3C2O2对于CH4有更好的吸附效果,而且Ti3C2O2负电荷态越多,对CH4的吸附越强. 一般认为,吸附能在-0.50 eV以下时,气体小分子可以被有效捕获[38]. 据此可以推断,当Ti3C2O2超胞电荷态大于或等于-2时,CH4气体分子能够被有效捕获.
从图4(b)可知,随着外加负电荷数量的增加,从Ti3C2O2转移到CH4分子上的电荷数量也相应随之增大. 在Ti3C2O2-CH4吸附体系中,B位点和C位点的Hirshfeld电荷转移曲线变化程度基本一致,从Ti3C2O2转移到CH4气体分子的电荷数量都随着外加负电荷的增加而增加. A位点的Hirshfeld电荷转移曲线表明,CH4气体分子获得电荷数量也随外加负电荷的增加而增加,但是其变化幅度略少于B、C两个位点. 当Ti3C2O2电荷态从0变化至-3时,B位点CH4获得的电荷从0.0261 e增加到0.0903 e,C位点CH4获得的电荷从0.0234 e增加到0.0574 e,A位点CH4获得的电荷从0.0283 e增加到0.0933 e,其中A位点的变化量最少. 这表明,当吸附位点为Ti3C2O2表面的A位点时,Ti3C2O2与CH4气体分子之间的吸附作用相对较弱. 但总体而言,外加负电荷可以显著提高Ti3C2O2对CH4气体分子的吸附效果,且所加的负电荷越多,Ti3C2O2对CH4气体分子的吸附性能越好.
图4(c)为外加负电荷的条件下,CH4在Ti3C2O2表面的A、B及C三个吸附位点距离变化. 可以发现,B位点和C位点的距离变化曲线基本重合,即说明在此位点下,CH4中的C原子到Ti3C2O2中Ti原子的距离,随着外加负电荷的增加变化不大. A位点的距离变化曲线却有所相同,在Ti3C2O2为-1电荷态时距离有所增加,Ti3C2O2为-2电荷态和-3电荷态时距离基本不变. 这再次表明CH4气体分子不易吸附在Ti3C2O2表面的A位点.
通过撤去施加在Ti3C2O2上的负电荷,研究了CH4气体分子在Ti3C2O2表面的释放过程. 表3所示为撤去负电荷后,CH4气体分子与Ti3C2O2之间吸附能和Hirshfeld电荷转移的值. 结果表明,-1、-2及-3电荷态的Ti3C2O2表面不同的吸附位点对CH4气体分子的吸附能,在撤去负电荷后均变弱,而且吸附能数值接近0电荷态时对应的数值. 观察电荷转移的数值发现:不同电荷态的Ti3C2O2在撤去负电荷变为0电荷态时,电荷转移数量均减少,且都接近0电荷态时CH4获得的电荷数量. 这些结果表明,撤去负电荷后,化学吸附又转变为物理吸附,CH4气体分子易被释放.
综上所述,随着外加负电荷的增多,Ti3C2O2表面的B、C位点对CH4的吸附作用逐渐增强,物理吸附逐渐转变为化学吸附. 当Ti3C2O2的负电荷态恢复至0时,其与CH4气体分子之间的吸附能、电荷转移量均接近0电荷态时的数值. 说明两者之间的吸附作用从化学吸附又变为物理吸附,CH4气体分子很容易实现脱附.

表3 撤去负电荷条件下,CH4气体分子与Ti3C2O2间的吸附能和电荷转移
3.2.2电荷调控下V2CO2对CH4的吸附

(a)吸附能

(b)电荷转移

(c)吸附距离图4 外加负电荷条件下,Ti3C2O2表面的不同吸附位点对CH4的吸附:(a)吸附能,(b)电荷转移,(c)吸附距离Fig. 4 Adsorption of CH4 on different adsorption sites on the surface of Ti3C2O2 under the condition of external negative charge: (a) Eads, (b) CT, (c) d
图5为电荷调控下,CH4在V2CO2表面不同吸附位点吸附能、吸附距离、电荷转移变化. 从图5(a)可知,吸附能随电荷态数量的增加而逐渐增加,吸附作用从物理吸附逐渐转变为化学吸附. 在V2CO2-CH4吸附体系中,随着外加负电荷的增加,A位点和C位点的吸附能变化基本一致均增加. B位点的吸附能在-1电荷态时变弱,-2电荷态与-3电荷态时变强,整体上仍呈增强趋势. 进一步观察发现当V2CO2的电荷态从0变化至-3时,A位点的吸附能从-0.142 eV增加到-1.414 eV,C位点的吸附能从-0.173 eV变化至-1.345 eV,B位点的吸附能从-0.366 eV逐步增加到-1.356 eV,三个吸附位点吸附能均呈增加状态. 表明外加负电荷后的V2CO2对CH4气体分子吸附作用增强,与Ti3C2O2吸附CH4气体分子相似,V2CO2超胞电荷态大于或等于-2时,CH4气体分子能够被有效捕获.

(a)吸附能

(b)电荷转移

(c)距离图5 外加负电荷条件下,V2CO2表面的不同吸附位点对CH4气体分子的吸附:(a)吸附能,(b)电荷转移,(c)吸附距离Fig. 5 Adsorption of CH4 on different adsorption sites on the surface of V2CO2 under the condition of external negative charge: (a) Eads, (b) CT, (c) d
对比图5(b)中不同变化曲线发现,随着V2CO2负电荷态数目增加,从V2CO2转移到CH4上的电荷数量也随之增大. 在V2CO2-CH4吸附体系中,B位点和C位点的Hirshfeld电荷转移曲线变化程度基本一致,从V2CO2转移到CH4气体分子的电荷数量都随着外加负电荷的增加而增加. A位点的Hirshfeld电荷转移曲线表明,CH4气体分子获得电荷数量也随外加负电荷的增加而增加,但是其变化幅度略少于B、C两个位点. 具体而言,当V2CO2电荷态从0变化至-3时,A位点CH4获得的电荷从0.0325 e增加到0.0869 e,C位点CH4获得的电荷从0.0385 e增加到0.1398 e,B位点CH4获得的电荷从0.0436 e增加到0.1446 e. A位点的变化量最少,表明A位点处V2CO2与CH4气体分子之间的吸附作用相对较弱. 但总的来说,外加负电荷可以显著提高V2CO2对CH4气体分子的吸附效果,且所加的负电荷越多,V2CO2对CH4气体分子的吸附性能越好.
图5(c)为CH4在V2CO2表面不同位点的吸附距离随外加负电荷变化曲线. 观察发现,B位点和C位点的距离变化曲线不重合,但两条曲线变化幅度均很小,可以忽略不计. A位点的距离变化曲线与B、C位点不同,在V2CO2为-1电荷态时增大,V2CO2为-2电荷态时基本不变,V2CO2为-3电荷态时有所减小,但是距离变化整体上呈增长状态,再次表明V2CO2的A位点对CH4气体分子的吸附作用相对较弱.
撤去施加在V2CO2上的负电荷后,CH4气体分子与V2CO2之间吸附能和电荷转移的值如表4所示. 与Ti3C2O2结果相似,不同电荷态的Ti3C2O2对CH4气体分子的吸附能以及两者之间的电荷转移数量,在撤去负电荷后均变小,而且接近0电荷态时对应的数值. V2CO2与CH4气体分子之间的吸附作用也从化学吸附转变为物理吸附.
因此,随着V2CO2负电荷态的增加,其表面的B、C位点对CH4的吸附作用增强变为化学吸附. 当撤去负电荷后,V2CO2与CH4气体分子之间的吸附能、电荷转移量均接近0电荷态时数值. 且两者之间的吸附作用从化学吸附变为物理吸附,CH4气体分子很容易脱附.
4 结 论
本文采用第一性原理计算研究了电荷调控下Ti3C2O2和V2CO2与CH4气体分子之间的相互作用. 主要研究结论如下:
(1)无电荷调控时,Ti3C2O2和V2CO2对CH4的吸附较弱,属于物理吸附,不适宜直接用作CH4气体分子的探测/捕获.
(2)电荷调控下,随着Ti3C2O2、V2CO2电荷态的增加,Ti3C2O2、V2CO2与CH4气体分子之间的Hirshfeld电荷转移逐渐增加,吸附作用增强并且从物理吸附转化为化学吸附. 当体系电荷态大于或等于-2时,Ti3C2O2和V2CO2可以有效捕获CH4. 撤去电荷后,Ti3C2O2和V2CO2与CH4气体分子之间的吸附恢复至物理吸附状态,CH4气体分子很容易实现脱附.

表4 撤去负电荷条件下,CH4气体分子与V2CO2间的吸附能和电荷转移
(3)通过调控Ti3C2O2和V2CO2的电荷态,可以简单地实现CH4的捕获与释放. 因此,Ti3C2O2和V2CO2有望成为探测或捕获CH4的候选材料.
