补肾降脂方调控自噬与胆固醇流出干预ApoE-/-小鼠动脉粥样硬化的机制研究
2021-12-26申定珠
闫 黎 申定珠
上海中医药大学,上海市中医老年医学研究所,上海 200031
作为心脑血管事件关键病理基础的动脉粥样硬化(atherosclerosis,AS),胆固醇外排是胆固醇逆向转运(reverse cholesterol transport,RCT)的关键步骤,在AS 病理进程中扮演重要角色[1]。肝X 受体α(liver X receptor alpha,LXRα)在RCT 过程中发挥重要作用[2]。RCT 靶点蛋白ATP 结合膜盒转运蛋白A1(ATP-binding membrane cassette transport protein A1,ABCA1)可调节胆固醇外流[3]。激活LXRα/ABCA1 途径可促进RCT、增加胆固醇外排,调节脂质代谢紊乱[4]。自噬是高度保守的自我降解过程,可选择性将脂滴吞噬并递送至溶酶体降解[5]。基于补肾法乃AS 行之有效的临床治则[6],结合补肾降脂方有效调控高脂饮食诱导的ApoE-/-小鼠脂质代谢紊乱、调控自噬相关蛋白表达的前期工作基础[7-8],本研究从自噬介导胆固醇流出角度解析补肾降脂方干预治疗AS 的相关机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 6 周龄雄性ApoE-/-小鼠与C57BL/6J小鼠,SPF 级,体重(20±3)g,购自江苏集萃药康生物科技有限公司,动物质量合格证号:SCXK(苏)2018-0008,喂饲于上海中医药大学实验动物中心SPF 级动物房。方案通过上海中医药大学实验动物福利与伦理审查(PZSHUTCM200628005)。
1.1.2 药物与试剂 补肾降脂方颗粒由菟丝子、枸杞子、沙苑子、女贞子、覆盆子、黑大豆各10 g 组成(江苏江阴天江药业有限公司,19120222、19100372、19080302、19100472、19110522、19090562);阿托伐他汀片(辉瑞制药有限公司,DT1537);3-甲基腺嘌呤(3-methyladenine,3-MA)(Sigma-Aldrich 公司,M9281);油红O 染色试剂盒(武汉赛维尔生物科技有限公司,G1016);FILIPIN 染色试剂盒(上海杰美基因医药科技有限公司,GMS80059.3);总胆固醇(total cholesterol,TC)、游离胆固醇(free cholesterol,FC)试剂盒(北京普利莱基因技术有限公司,E1005、E1006);兔抗LXRα、鼠抗ABCA1(Abcam 公司,ab176323、ab18180);兔抗微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)A/B、兔抗p62、兔抗GAPDH(Cell Signaling Technology 公司,4108S、23214S、5174S)。
1.2 分组
100 只6 周龄雄性ApoE-/-小鼠适应性喂养至8 周,采用随机数字表法将其分为模型组、补肾组、他汀组、3-MA 组,每组25 只,高脂饲料(小鼠常规基础饲料+21%脂肪+0.15%胆固醇)喂饲;25 只同品系、同周龄雄性C57BL/6J 小鼠为正常对照。补肾组、他汀组分别以补肾降脂方水溶液(3842.85 mg/kg)、阿托伐他汀水溶液(2.055 mg/kg)灌胃,0.2 ml/只,每日1 次;3-MA组以3-MA 水溶液腹腔注射(15 mg/kg),隔日1 次[9];正常组、模型组以等体积蒸馏水灌胃,每日1 次。干预12 周。
1.3 观察指标与检测方法
1.3.1 苏木精-伊红(hematoxylin-eosin,HE)染色取主动脉连同心脏,10%福尔马林固定,用于HE 染色。脱蜡→苏木精染色→伊红染色→封片,光学显微镜采集图像,Image-Pro Plus 分析主动脉窦斑块面积/管腔总面积。
1.3.2 油红O 染色 取主动脉连同心脏,10%福尔马林固定,用于油红O 染色。切片干燥→异丙醇分化→苏木精复染→盐酸酒精分化→返蓝液返蓝→封片。数字切片扫描仪采集图像,Image-Pro Plus 分析主动脉窦红染脂质面积/管腔总面积。
1.3.3 FILIPIN 染色 取主动脉连同心脏,10%福尔马林固定。按FILIPIN 染色试剂盒说明书操作,荧光显微镜采集图像,Image J 分析阳性区域平均荧光强度。
1.3.4 透射电镜 取主动脉弓处组织,2.5%戊二醛预固定,1%锇酸后固定,梯度酒精脱水,包埋切片,透射电镜观察自噬小体与脂滴。
1.3.5 比色法 眼球摘除取血,离心(12 000 r/min,15 min,4℃;离心半径为10 cm),取上清,按TC、FC 测定试剂盒说明书操作,550 nm 处测光密度(optical density,OD)值,绘制标准曲线;胆固醇酯(cholesterol ester,CE)=TC-FC。
1.3.6 Western blot 取胸主动脉至腹主动脉段,蛋白提取及定量。SDS-PAGE 电泳湿转,室温封闭1.5 h,4℃过夜孵育一抗(LXRα、ABCA1、LC3A/B、p62,1∶1000;GAPDH,1∶2000)。TBST 洗膜,室温孵育二抗(1∶3000)1 h,洗膜后显影。结果以目的蛋白条带灰度值/GAPDH条带灰度值表示。
1.4 统计学方法
采用SPSS 24.0 统计学软件对所得数据进行分析,计量资料采用均数±标准差()表示,组间比较采用单因素方差分析,两两比较采用LSD-t 或Games-Howell 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 各组主动脉窦病理形态比较
正常组主动脉窦未见明显AS 斑块(图1A)。模型组AS 斑块面积比大于正常组,差异有高度统计学意义(P <0.01);补肾组、他汀组AS 斑块面积比小于模型组,差异均有高度统计学意义(P <0.01);3-MA组AS 斑块面积比大于模型组,差异有高度统计学意义(P <0.01);补肾组与他汀组比较,差异无统计学意义(P >0.05)(图1B)。

图1 各组主动脉窦HE 染色情况与斑块面积比比较
2.2 各组主动脉窦脂质蓄积比较
正常组主动脉窦未见明显红染脂质(图2);模型组红染面积大于正常组,差异有高度统计学意义(P <0.01);补肾组、他汀组红染面积小于模型组,差异均有高度统计学意义(P <0.01);3-MA 组红染面积大于模型组,差异有统计学意义(P <0.05);补肾组与他汀组比较,差异无统计学意义(P >0.05)(图3)。

图2 各组主动脉窦油红O 染色情况(40×)

图3 各组主动脉窦红染脂质面积比比较
2.3 各组主动脉窦FC 染色情况比较
正常组主动脉窦未见明显蓝色荧光(图4);模型组主动脉窦阳性染色面积大于正常组,差异有高度统计学意义(P <0.01);补肾组、他汀组阳性染色面积小于模型组,差异均有高度统计学意义(P <0.01);3-MA 组阳性染色面积大于模型组,差异有统计学意义(P <0.05);补肾组与他汀组比较,差异无统计学意义(P >0.05)(图5)。

图4 各组主动脉窦FILIPIN 染色情况(200×)
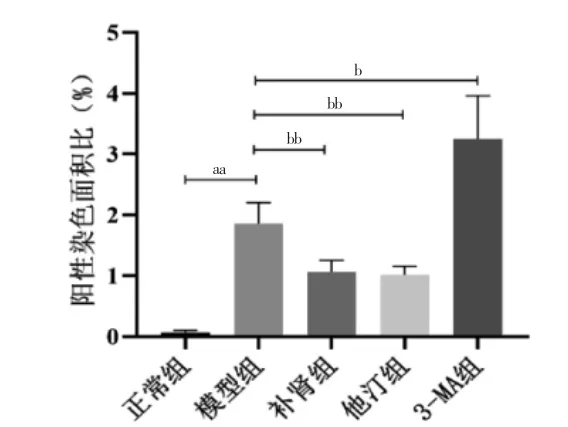
图5 各组主动脉窦阳性染色面积比比较
2.4 各组主动脉自噬小体与脂滴情况
正常组主动脉内皮细胞结构完整,可见自噬小体;模型组主动脉内皮细胞肿胀,可见脂滴,未见自噬小体;补肾组、他汀组主动脉内皮细胞可见自噬小体;3-MA 组主动脉内皮细胞膜破损,细胞核形态不完整,多处可见脂滴,未见自噬小体(图6)。
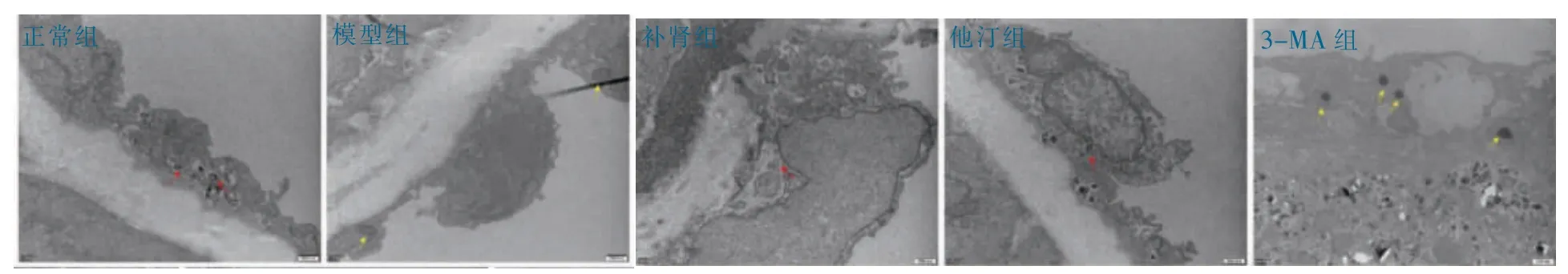
图6 各组透射电镜情况(20 000×)(黄:脂滴;红:自噬小体)
2.5 各组血清TC、FC、CE 含量比较
模型组TC、FC 及CE 含量高于正常组,差异有高度统计学意义(P <0.01);补肾组TC、FC 及CE 低于模型组,差异有统计学意义(P <0.05 或P <0.01);他汀组TC、FC 及CE 低于模型组,差异有高度统计学意义(P <0.01);3-MA 组TC、CE 高于模型组,差异有统计学意义(P <0.05);补肾组与他汀组比较,差异无统计学意义(P >0.05)。见表1。
表1 各组血清TC、FC、CE 含量比较(mmol/L,)

表1 各组血清TC、FC、CE 含量比较(mmol/L,)
注:与正常组比较,aaP <0.01;与模型组比较,bP <0.05,bbP <0.01。TC:总胆固醇;FC:游离胆固醇;CE:胆固醇酯;3-MA:3-甲基腺嘌呤
2.6 各组主动脉LXRα、ABCA1、LC3、p62 蛋白表达比较
模型组LXRα、ABCA1、LC3Ⅱ/Ⅰ表达低于正常组,p62 表达高于正常组,差异有高度统计学意义(P <0.01);补肾组LXRα、ABCA1、LC3Ⅱ/Ⅰ表达高于模型组,p62 表达低于模型组,差异有统计学意义(P <0.05或P <0.01);他汀组LXRα、ABCA1、LC3Ⅱ/Ⅰ表达高于模型组,p62 表达低于模型组,差异有统计学意义(P <0.05 或P <0.01);3-MA 组LC3Ⅱ/Ⅰ表达低于模型组,p62 表达高于模型组,差异有统计学意义(P <0.05);补肾组与他汀组比较,差异无统计学意义(P >0.05)。见图7。
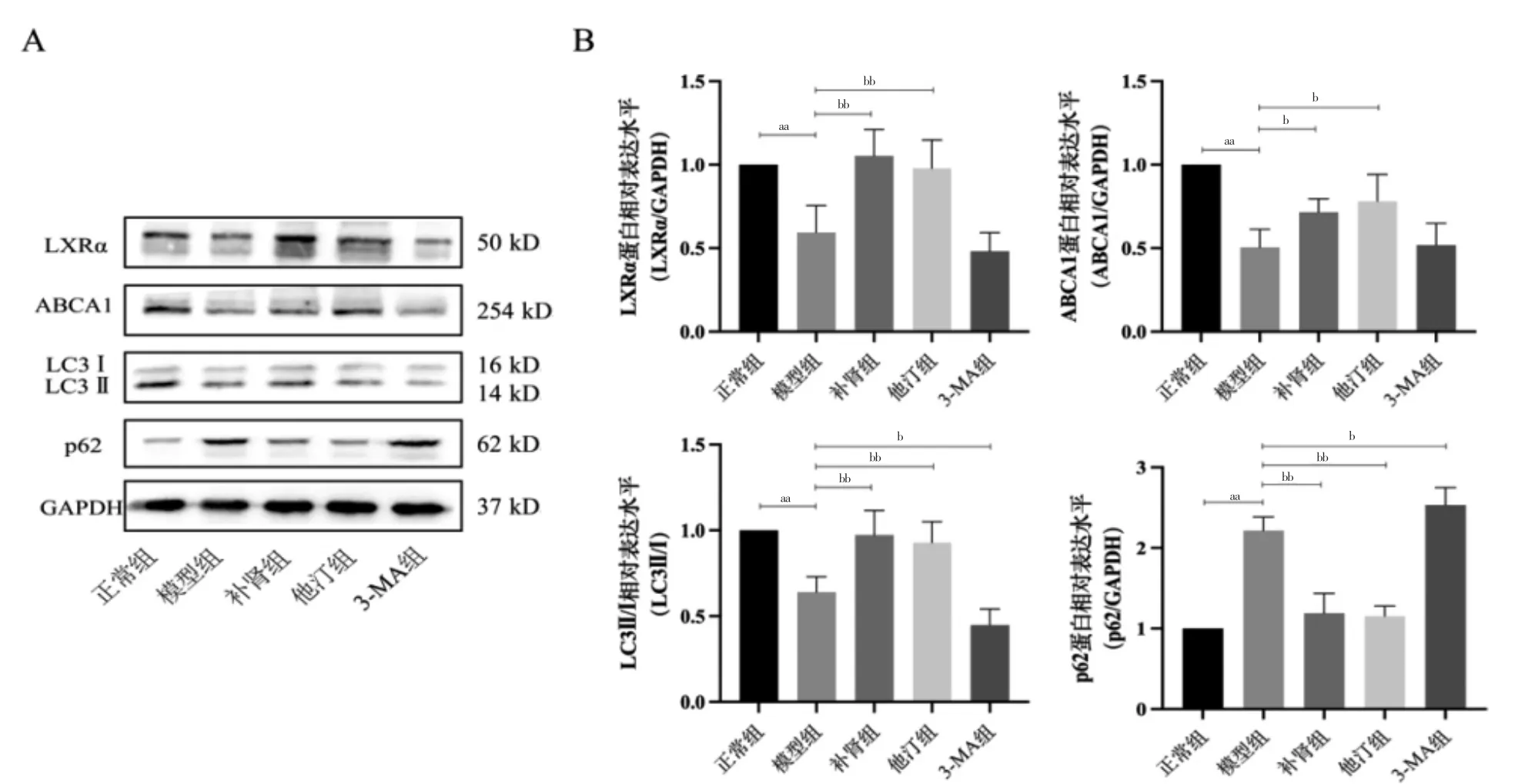
图7 各组主动脉LXRα、ABCA1、LC3Ⅱ/Ⅰ、p62 蛋白表达比较
3 讨论
脂质代谢紊乱是AS 形成的关键病理环节,胆固醇流出为RCT 初始步骤,在AS 病理进程中意义重大[10]。RCT 关键靶蛋白ABCA1 可介导胆固醇向apoA-Ⅰ转运促进脂质外排[11]。激活胆固醇含量的感受器LXRα 上调ABCA1 表达,促进胆固醇流出[9]。ApoE-/-小鼠所致AS 病变与人类AS 病变相似,高脂饮食可加速AS 形成[12]。自噬活性不足或过度均可致AS[13]。自噬小体为自噬的标志性结构,电镜是检测自噬的金标准[14]。3-MA 是广泛应用的自噬抑制剂[15]。自噬发生过程中,LC3-Ⅰ可脂化为LC3-Ⅱ,以LC3-Ⅱ/Ⅰ评估自噬水平:自噬降解底物p62 可反映自噬活性[16]。脂滴可经自噬溶酶体途径降解,即脂滴被自噬小体包裹后与溶酶体融合,甘油三酯与CE 在溶酶体中被酸性脂肪酶水解为FC 与游离脂肪酸,其中FC 外排由ABCA1 介导[17]。激活LXRα/ABCA1 可减少ox-LDL 诱导的VSMCs 脂质蓄积,与诱导自噬有关[18]。在Ac-LDL诱导的THP-1 巨噬细胞泡沫化进程中,FGF21 可通过RACK1 诱导自噬,促进胆固醇流出[19]。本研究显示,与正常组比较,模型组AS 斑块、脂质蓄积、FC 阳性染色面积及脂滴增加,TC、FC、CE 含量及p62 表达升高,自噬小体减少,LXRα、ABCA1、LC3Ⅱ/Ⅰ表达降低:较之模型组,3-MA 组斑块、脂质蓄积、FC 阳性染色面积及脂滴增加,TC、CE 含量及p62 表达升高,未见自噬小体,LC3Ⅱ/Ⅰ表达降低。
根据临床表现,AS 可归属“脉痹”“胸痹”等范畴。本虚标实乃AS 病机之根,肾虚致AS 理论受诸多学者重视。本课题组前期研究证实,AS 与增龄相关,以肾虚为本;补肾降脂方可调控RCT、促进自噬,进而有效干预治疗AS[7-8];但从自噬与脂质代谢角度探讨补肾方药干预AS 的机制尚待阐明[20]。补肾降脂方由菟丝子、枸杞子、沙苑子、女贞子、覆盆子、黑大豆组成,具补肾益精、降脂利脉之功。菟丝子补肾固精、枸杞子滋肾益精,共为君药:沙苑子补肾助阳、女贞子补肾滋阴、覆盆子益肾固精,共为臣药:黑大豆活血利水解毒为佐使药。本研究显示,补肾降脂方可减少AS 斑块、脂质蓄积、FC 及脂滴,降低TC、FC、CE 含量及p62 表达,增加自噬小体,升高LXRα、ABCA1、LC3Ⅱ/Ⅰ表达。
综上,补肾降脂方有效干预治疗AS 的作用机制可能与其调控自噬、促进胆固醇流出有关。基于自噬与脂质代谢的相关性,本课题组将结合体内、体外研究,深入解析补肾降脂方有效干预治疗AS 的科学内涵。
