异槲皮苷促进犬骨髓间充质干细胞(cBMSCs)的成骨分化及机理
2021-12-24汪娅媛田仰清昂艳芬闫晓霞严玉霖
汪娅媛,郭 娟,田仰清,严 涵,昂艳芬,闫晓霞,严玉霖*
(1.云南农业大学 动物医学学院,云南 昆明 650201;2.云南西双版纳州动物疫病预防控制中心,云南 景洪 666100)
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)具有自我更新能力以及向骨和软骨等多种中胚层组织分化的能力,在骨缺损的修复中起着关键作用[1]。BMSCs现已应用于多种人类与动物疾病模型的基础研究中,并获得了较好的效果[2],以犬骨髓间充质干细胞(canine bone mesenchymal stem cells,cBMSCs)为基础的再生医学是兽医学研究的热点和前沿领域[3]。
天然类黄酮异槲皮苷,也称为罗布麻甲素和槲皮素3-O-β-D-吡喃葡萄糖苷[4],是我国云南特种经济植物辣木中天然黄酮类的主要有效成分之一,具有抗骨质疏松、抗氧化、抗炎、抗肿瘤、抗突变、抗菌、抗病毒、降血压、降血脂、抗动脉粥样硬化、降血糖、神经保护等作用。近年来,研究人员利用中药粗提物或其活性成分作用于BMSCs,探讨中药对BMSCs增殖、凋亡和分化的影响。有研究表明,中药淫羊藿苷、柚皮苷等多种黄酮类化合物对BMSCs向成骨细胞分化有促进作用[5-6]。异槲皮苷可通过调控RUNT相关因子2和骨形态形成蛋白的表达来影响BMSCs的增殖与分化[7],异槲皮苷与BMSCs的成骨分化有着密切的关系。
c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)参与细胞增殖和分化、形态维持、骨骼构建、凋亡、恶性转化等的调节,在成骨细胞增殖、分化和应激中发挥重要作用[8]。目前的研究表明,JNK信号通路可能是细胞成骨分化相关信号通路之一,且许多中药及化合物,如淫羊藿、川续断皂苷Ⅵ、丙二醇等是通过JNK信号通路实现对BMSCs向成骨细胞分化的调控[9]。基于上述研究推测,异槲皮苷能促进cBMSCs的成骨分化,且分化机制可能与JNK信号通路有关,但目前相关研究较少,因此深入开展异槲皮苷对cBMSCs成骨分化影响的研究,可为进一步开展cBMSCs定向分化以及利用异槲皮苷防治相关疾病等的研究提供理论依据。
1 材料与方法
1.1 主要试剂和仪器FITC标记的羊抗兔二抗(爱必信(上海)生物科技有限公司);RNA逆转录试剂盒(TaKaRa公司);异槲皮苷标准品(四川省维克奇生物科技有限公司);倒置荧光显微镜(Olympus公司);BIO-RAD-CFX荧光定量PCR仪(美国BIO-RAD公司)。
1.2 细胞的培养及分组取云南农业大学病理实验室液氮保存的原代cBMSCs进行培养传代,至第3代后用于后续试验。通过MTT试验计算得到异槲皮苷对cBMSCs的最适试验浓度为10-6mol/L。试验分为2组,对照组:即普通成骨诱导培养基(以DMEM培养基为基础,添加地塞米松 0.25 μmol/L、抗坏血酸 5 mg/L、β-甘油磷酸二钠水合物10 mmol/L、胎牛血清10% 和青链霉素 0.1%);异槲皮苷组:即添加10-6mol/L 异槲皮苷的普通成骨诱导培养基。
1.3 MTT 法检测细胞增值率MTT法参照GB/T16886.5-2003 《医疗器械生物学评价 5 部分:体外细胞毒性试验》,在最适药物浓度下测定对照组和异槲皮苷组的细胞活性,使用酶联免疫检测仪检测各孔D490 nm值。
1.4 成骨诱导茜素红染色cBMSCs传代至第3代后接种六孔板,培养至 80% 后分别用普通诱导培养基和添加异槲皮苷的诱导培养基,分别培养 7,14,21 d 后去除培养基进行固定,洗涤后加入茜素红染色,于相差倒置显微镜下观察钙化结节染色情况,染色完成后弃掉染液,拍照。
1.5 mRNA的提取与反转录收集细胞后,采用Trizol法提取总RNA。将完整性良好的RNA定量为 1 000 ng后进行反转录,按照宝生物反转录试剂盒说明书步骤操作。
1.6 实时荧光定量PCR根据NCBI数据库中碱性磷酸酶(ALP)、特异AT序列结合蛋白2(SATB2)、SOS1和激活转录因子2(ATF2)的基因序列,利用在线Primer 6.0、Oligo 6.0等引物设计软件设计荧光定量PCR引物,以GADPH为内参基因。利用反转录产物进行荧光定量PCR试验。反应液体系:TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)10 μL,PCR Forward primer(10 μmol/L)0.8 μL,PCR Reverse primer(10 μmol/L)0.8 μL,DNA模板2 μL,灭菌水 6.4 μL。反应程序:5℃ 3 min;95℃ 1 min,50~60℃ 30 s,72℃ 5 min,扩增 40 个循环。
1.7 酶联免疫分析细胞上清及细胞内ALP含量酶联免疫分析细胞上清及细胞内ALP含量需在测定时制作标准曲线,按步骤将标准品进行处理,并设置空白孔,测定D值。以标准物浓度为横坐标,D值为纵坐标绘制标准曲线。
1.8 统计学方法所有数据用平均数±标准差表示,应用SPSS 19.0 软件,采用单因素方差分析及Tukey检验,P<0.05为差异显著,使用Graphpad prism 6.0制作图形。
2 结果
2.1 MTT检测结果各组细胞增殖率见图1,在所有时间点异槲皮苷组cBMSCs的增值率均显著高于对照组(P<0.05),说明异槲皮苷对cBMSCs无明显细胞毒性,且异槲皮苷可促进cBMSCs的增殖。

注:与对照组比较,*表示P<0.05差异显著,**表示P<0.01差异极显著。下同图1 各组cBMSCs细胞增殖率(n=3)
2.2 茜素红染色成骨诱导后细胞变为多角形或不规则状,体积增大,钙质沉积部分被茜素红着色为红褐色。诱导7 d时,用茜素红染色,2组cBMSCs均未出现明显的钙化结节(图2 A,D);诱导14 d时,相较于对照组,异槲皮苷组有更多的红褐色的钙化结节(图2 B,E);诱导21 d时,异槲皮苷组的钙化结节面积明显增大(图2 C,F)。

注:→指示为 cBMSCs 钙质沉积图2 成骨诱导茜素红染色(400×)
2.3 成骨相关基因荧光定量 PCR 检测结果
2.3.1cBMSCs中ALP mRNA的表达 从图3可得知,异槲皮苷组ALP mRNA表达水平在培养7,14 d时极显著高于对照组,而在培养21 d时则极显著低于对照组(P<0.01)。

图3 cBMSCs ALP mRNA表达水平的比较(n=3)
2.3.2cBMSCs中SATB 2 mRNA的表达 从图4可得知,相较于对照组,异槲皮苷组在所有时间点均可极显著促进cBMACs中SATB2 mRNA的表达(P<0.01)。

图4 cBMSCs SATB2 mRNA表达水平的比较(n=3)
2.4 细胞及上清中 ALP 含量检测
2.4.1ALP的标准曲线 由ALP的标准品得到其标准曲线,回归方程为y= 0.034 6x-0.012 1,相关系数为R2= 0.998 9,符合标准曲线要求(图5)。

图5 ALP的ELISA标准曲线
2.4.2ALP的含量变化 从图6可得知,与对照组比较,异槲皮苷组cBMSCs在所有时间点ALP含量均极显著高于对照组(P<0.01)。

图6 cBMSCs 培养基上清中 ALP 含量(n=3)
2.5 JNK信号通路相关基因荧光定量PCR检测结果
2.5.1cBMSCs中SOS1 mRNA的表达 从图7可得知,异槲皮苷组SOS1 mRNA表达水平在培养7 d显著低于对照组(P<0.05),培养14,21 d时极显著低于对照组(P<0.01)。
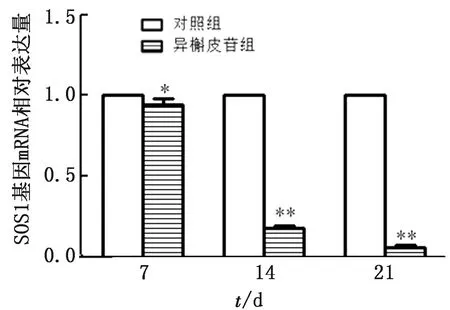
图7 cBMSCs SOS1 mRNA表达水平的比较(n=3)
2.5.2cBMSCs中ATF2 mRNA的表达 从图8可知,异槲皮苷组ATF2 mRNA表达水平在所有时间点均极显著低于对照组(P<0.01)。

图8 cBMSCs ATF2 mRNA表达水平的比较(n=3)
3 讨论
近年来中药对成骨细胞成骨分化影响的研究逐渐增多,多种黄酮类的化合物被证实参与成骨细胞的钙质沉积[10-12]。本研究在了解辣木的有效成分后,选择将α-托可醌、异槲皮苷、绿原酯等辣木有效成分添加入cBMSCs培养基中,发现异槲皮苷对cBMSCs的活性影响显著,最终选择异槲皮苷进行进一步的研究。
3.1 异槲皮苷在cBMSCs成骨分化过程中促进细胞增殖经异槲皮苷培养1,2,5 d 后,MTT法检测发现对照组在前期会出现少部分cBMSCs死亡的现象,其增殖率明显低于添加异槲皮苷的cBMSCs。JNK信号通路磷酸化可介导细胞凋亡[13],而本研究中的黄酮类化合物异槲皮苷可使SOS1 mRNA的表达量下降,对JNK信号通路上的相关因子有负调控作用,因此促进了cBMSCs的增殖,与齐鹏飞等[14]的研究结果相近。
在干细胞移植治疗中,由于干细胞的特性,在其移植治疗疾病过程中的异常增殖所导致的癌变也是再生医学研究的一大难题。SOS1作为细胞癌变的指示因子之一,在癌症发生时对细胞转移、形态改变、黏附动力学等起重要作用,因此SOS1可指示在骨肉瘤中癌细胞的增殖扩散情况[15]。蒋国君等[16]报道,异槲皮苷通过MAPK信号转导下调RAS、RAF、MEK、ERK mRNA及相关蛋白的表达,诱导肝癌细胞凋亡。JNK信号通路中的SOS1是组织癌变的指标之一,而本研究发现异槲皮苷可减少SOS1在cBMSCs中的表达水平,这提示异槲皮苷可能会降低cBMSCs移植治疗时癌变的风险,但其中的机制以及作用需做进一步的研究。
3.2 异槲皮苷促进cBMSCs的成骨分化转录因子SATB2可以影响成骨细胞分化和头骨发育,SATB2基因过表达可促进 MSC的成骨分化,当BMSCs向成骨细胞分化时,SATB2的表达量也会上调,其表达水平与成骨细胞分化程度呈正相关[17],而ALP是BMSCs成骨分化程度的指示性因子[18]。本研究中异槲皮苷组相较于对照组明显促进了cBMSCs的SATB 2和ALP的mRNA表达水平及ALP蛋白的表达,并使钙质结节面积增加,表明异槲皮苷对cBMSCs的成骨分化有促进作用。多种黄酮类的化合物被证实具有促进成骨细胞钙质沉积的作用,且有研究发现,绝经期妇女常发的骨质疏松症,可通过食用与雌激素结构相似的异槲皮苷使病情得到改善[19],上述观点进一步证实异槲皮苷对成骨分化有促进作用。
3.3 异槲皮苷通过下调JNK信号通路促进cBMSCs成骨分化SOS1和ATF2是JNK信号通路的上下游因子。WANG等[20]发现,当JNK信号通路受阻时,SOS1的表达量会下降。且有研究表明通过实验处理细胞,促使细胞SOS1的表达量上升后再抑制细胞 JNK 信号通路,SOS1的表达量会下降。ATF2是转录因子ATF/CREB家族的一员,细胞受到应激后通过MAPKs/p38/JNK磷酸化而被激活诱导细胞凋亡[21-22]。JNK介导ATF2磷酸化增强了其转录活性,c-Jun磷酸化的诱导对于许多细胞的增殖和凋亡非常重要[21]。本研究中,异槲皮苷组SOS1和ATF2 mRNA表达水平显著降低,提示JNK信号通路受到抑制,而异槲皮苷促进cBMSCs成骨分化,这一过程可能是通过下调SOS1和ATF2从而抑制JNK信号通路实现的。有研究表明,JNK信号通路磷酸化有降低成骨细胞ALP沉积的作用,与异槲皮苷结构相近的化合物骨碎补可促进成骨细胞ALP的沉积,并下调JNK信号通路因子。本研究与刘立萍[23]的研究报道不一致,抑制JNK信号通路后,会显著抑制中药左归丸对小鼠成骨细胞系MC3T3-E 1细胞的ALP活性。分析原因发现可能是由于所使用的细胞种类来源不同,cBMSCs相对于小鼠成骨细胞系是更为原始的细胞,而且药物的处理浓度也不同,这有待于进一步研究。
综上所述,异槲皮苷具有促进cBMSCs增殖及成骨分化的能力,这一过程可能是通过抑制JNK信号通路来实现的,且可能存在抑制细胞癌化的作用,提示异槲皮苷可能是一种在cBMSCs的研究和临床治疗中可考虑使用的细胞添加剂,但具体的添加剂量、作用时间及机制需要做进一步的研究。
