J亚群禽白血病病毒致病机理研究进展
2021-12-24张帆帆涂凌云李海琴曾艳兵康昭风谭美芳方绍培
张帆帆,涂凌云,李海琴,曾艳兵,康昭风,谭美芳,谭 佳,方绍培,杨 群*
(1.江西省农业科学院 畜牧兽医研究所,江西 南昌 330200;2.南昌市动物疫病预防控制中心,江西 南昌 330008)
禽白血病(avian leukosis,AL)是由禽白血病病毒(avian leukosis virus,ALV)引起的一种呈世界性分布的禽类传染病,能够垂直和水平方向传播,在生产养殖中可导致鸡产生肿瘤、免疫抑制、生产性能下降甚至死亡等,被列为国家中长期动物疫病规划(2012-2020)的3大禽病之一[1-4]。根据病毒囊膜蛋白的特性,目前鸡的ALV共分为7个亚群(A、B、C、D、E、J和K),其中ALV-J是当前最为流行、致病性最强的ALV。自1999年在我国发现以来,我国肉鸡、蛋鸡及地方品种鸡群中普遍存在ALV-J的感染,对我国家禽种质资源的安全构成极大威胁,也给行业养殖造成巨大经济损失[1,5-6]。迄今为止,ALV-J无有效的疫苗和药物,控制ALV-J的主要方法是淘汰阳性鸡、净化鸡群。本文对ALV的基因组特征、病毒复制、致瘤机制、免疫抑制机制及宿主天然抗病毒过程的分子机制等研究进展进行综述。
1 ALV-J基因组特征
ALV-J属于反转录病毒科正反转录病毒亚科α反转录病毒属成员,为有囊膜单股正链线性的RNA二聚体病毒。病毒基因组不能作为mRNA翻译蛋白质,需反转录成前病毒整合到宿主细胞基因组,利用宿主细胞的细胞器及酶系统完成病毒的转录、翻译和组装[7]。病毒基因组全长约7.2~7.9 kb,两端包含2个非编码区(untranslated region,UTR),中间包含3个结构蛋白基因gag、pol、env,基因组结构为5′-UTR-gag-pol-env-UTR-3′。病毒基因组由RNA反转录到DNA前病毒过程中在基因组两端分别添加U3和U5,构成长末端重复序列(long terminal repeats,LTR),形成5′-LTR-gag-pol-env-LTR-3′基因组结构(图1)[8]。以马立克氏病病毒(marek’s disease virus,MDV)作为CRISPR/Cas9递送系统靶向ALV-J基因组的5′LTR,可有效地破坏潜伏整合的病毒基因组,并为细胞提供防御新ALV-J感染的能力[9]。gag基因编码病毒的多聚前体蛋白Pr76,在病毒天冬氨酸蛋白酶P15的切割下形成6种非糖基化结构蛋白,包括基质蛋白P19、P2、P10、衣壳蛋白P27、核衣壳蛋白P12、蛋白酶P15[10-11],其中衣壳蛋白P27的氨基酸序列高度保守,为群特异性抗原[12-13];pol基因编码病毒的反转录酶p68和整合酶p32;env基因编码病毒的囊膜糖蛋白SU表面蛋白(gp37)和TM跨膜蛋白(gp85),主要决定病毒的宿主范围,并与病毒的致瘤性相关[14-16]。
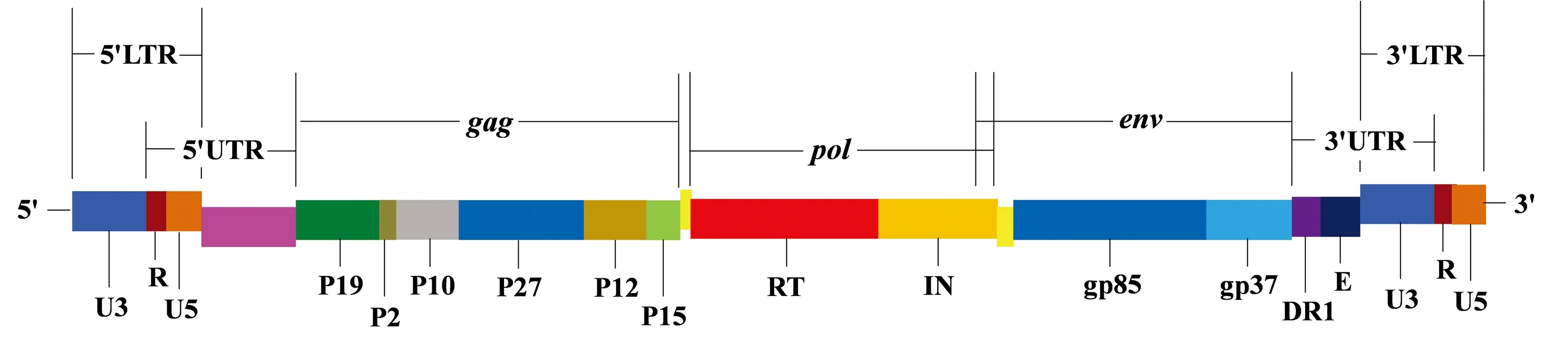
图1 ALV-J前病毒基因组结构示意图
2 病毒的复制
ALV-J的复制过程主要包括吸附、穿入、脱壳、生物合成、组装成熟和释放。病毒粒子以囊膜表面蛋白与鸡Na+/H+交换Ⅰ型跨膜细胞表面蛋白(chicken Na+/H+exchanger typeⅠ,chNHE1)/鸡ANXA2(chicken annexin A2,chANXA2)受体结合介导ALV-J与宿主细胞的吸附(图2),在吸附过程中病毒囊膜蛋白构象发生改变,在辅助受体或内体的帮助下病毒核心粒子进入细胞内,完成脱衣壳[17-18]。研究表明,ALV-J gp85的两段序列基序(38~131 aa和159~283 aa)是与chNHE1结合所必需的,其2个N-糖基化位点(N6和N11)和2个半胱氨酸(C3和C9)在病毒与受体结合和进入细胞过程起着至关重要的作用[15]。研究人员利用CRISPR/Cas9对鸡胚胎原始生殖细胞进行编辑,成功制备了缺失chNHE1基因的基因编辑鸡,研究结果表明,同野生型鸡相比,chNHE1缺失的鸡没有表现出任何明显的副作用,并对ALV-J具有较强的抵抗能力[19-20]。脱壳完成后,病毒RNA在自身逆转录酶作用下反转录为cDNA,与整合酶等多种病毒蛋白及宿主蛋白共同形成整合前复合体(pre-initiation-complex,PIC),PIC入核后在整合酶的作用下整合进入宿主基因组形成前病毒,经宿主细胞RNA聚合酶作用转录形成新的RNA,合成各种病毒结构蛋白,组装后出芽释放成熟的子代病毒粒子[21]。
3 病毒的致病机理
3.1 ALV-J致瘤机制ALV主要通过癌基因转导和插入突变两种机制启动癌基因的表达而使易感细胞和组织发生转化致瘤。其中以启动病毒癌基因为基础的机制称为癌基因转导机制,病毒感染机体细胞后导入癌基因,几天或几周内诱导细胞转化形成肿瘤,又称为急性转化型[22];以启动细胞癌基因为基础的机制称为插入突变机制,病毒不携带癌基因,病毒感染机体细胞后将前病毒插入至宿主细胞原癌基因或其周围,间接激活染色体基因组中的原癌基因,与癌基因转导机制相比,这一机制的致瘤潜伏期较长[23]。ALV-J病毒主要通过LTR插入突变机制,当前病毒插入在原癌基因上游,LTR中启动子诱导原癌基因的非正常表达,称为启动子激活;当前病毒插入在原癌基因附近,使增强子激活而诱导原癌基因过表达,称为增强子激活[24];前病毒插入在原癌基因中,LTR中的启动子启动病毒转录,进而启动原癌基因转录称为转录不终止激活。
不同于其他亚群的ALV,ALV-J主要诱发机体淋巴细胞瘤白血病,其还可诱发鸡只骨髓细胞样肿瘤、血管瘤、肝细胞癌和其他恶性肿瘤[24-26]。研究者利用ALV-J HB2009毒株感染鸡只并观察至20周龄,发现骨髓瘤病例最早见于13周龄,并且还出现血管瘤的特征,在脑组织中检测到瘤细胞,推测瘤细胞可能通过血脑屏障或骨膜浸润到脑组织[27]。通过对比ALV-J HPRS-103毒株和A亚群RAV-1毒株发现,ALV-J诱导的髓系白血病与病毒对粒单核细胞的嗜性相关,其感染后诱导粒细胞的原癌基因c-myc激活而转化成瘤细胞;感染RAV-1毒株的鸡只法氏囊内病毒基因表达水平较高,而感染HPRS-103毒株的鸡只则没有表达,这可能是HPRS-103毒株不能诱导淋巴白血病的原因[28]。另外,各种致癌因子的协同作用失衡也可引起机体形成肿瘤,感染ALV-J NX0101毒株的肉鸡延髓、肝脏和肺组织p53相关肿瘤基因的mRNA表达水平显著升高,促进肿瘤的形成[29-30]。近年来研究发现,小分子RNA在肿瘤的形成过程中同样具有重要的作用。gga-miR-221和gga-miR-222等相关基因能够促进肿瘤细胞的增殖、周期进程及迁移能力,同时也会抑制细胞凋亡[31]。microRNAs(miRNAs)的异常表达与ALV-J引起的肝癌进展有关。为了探索对相关病理机制及病毒和宿主的相互作用,研究人员选择了7个先前报道的miRNAs,通过比较分析感染和未感染DF-1 的细胞miRNA表达,发现6种与肿瘤发生有关的miRNAs(let-7b/7i、miR-221/222、miR-125b和miR-2127)均出现上调,表明这些miRNA可能在肿瘤发生和发展过程中起重要作用[32]。环状RNA(circRNA)是一种新型的非编码RNA,具有高度保守和稳定的共价闭环结构,在多种生物过程和疾病发生中起着重要作用。试验分析发现,感染组和对照组之间circRNA_3079的含量差异显著,而且circRNA_3079及其预测的靶基因在许多与免疫或肿瘤相关的信号通路中富集,如p53信号通路、JAK-STAT信号通路、NOD样受体信号通路等,说明circRNA_3079可能通过调控靶基因间接调控ALV-J诱导的肿瘤形成[33]。
3.2 ALV-J免疫抑制机制ALV-J诱导的免疫抑制能够影响鸡的生长和疫苗免疫应答水平,并造成其他病原的继发感染。目前已知ALV-J引起的免疫抑制主要包括:引起骨髓组织发生病变进而导致T、B淋巴细胞减少;引起胸腺、法氏囊等淋巴细胞凋亡或坏死,使得T、B淋巴细胞的分化成熟受阻;引起外周免疫器官(如脾脏)发生病变,致使成熟淋巴细胞减少,使机体体液和细胞免疫及非特异性免疫水平下降。在感染过程中,ALV-J使淋巴滤泡中淋巴细胞发生转化,转化的B细胞丧失了产生IgG的能力,仅能产生IgM,而抗原特异性体液反应的产生需要B细胞和T细胞相互协调。研究者用ALV-J先天感染模型,从形态和功能两个方面研究ALV-J先天感染B细胞及其前体细胞的发育、分化和免疫功能,发现与早期感染鸡只相比,先天性ALV-J感染导致了严重的免疫耐受,免疫器官特别是法氏囊发育不良,鸡的IgM和IgG阳性细胞和总免疫球蛋白水平显著降低,通过流式细胞分析证实,ALV-J阻断了法氏囊CD117chB6 B细胞前体细胞的分化,B细胞及其祖细胞的体液免疫和免疫能力都受到了显著地抑制[34]。朱丽君等[35]将ALV-J接种1日龄和7日龄SPF雏鸡,研究不同感染时间对机体的免疫器官、CD4+和CD8+T淋巴细胞等的影响,发现1日龄感染组中枢器官等免疫器官抑制程度显著高于7日龄感染组,CD4+细胞数量明显下降,而CD8+细胞数量明显升高;而通过不同途径接种SPF雏鸡,除生长性能和免疫器官指数下降外,淋巴细胞转化率和细胞因子的分泌量(IL-2、IL-4、IFN-γ)显著降低,腹腔和肌肉注射组降低的最明显。
ALV-J的TM区是引起机体诱发免疫抑制的主要因素。ALV-J的TM中存在一段高度保守的免疫抑制序列,亦称为免疫抑制区(ISU)。该区域合成的多肽可在体内外抑制淋巴细胞的活性,通过比较不同毒株发现,保守序列编码的多肽的抑制活性与毒株种类无关。通过对ISU进行氨基酸三级结构分析,发现该区域可形成一个独特的α螺旋,可与胞外片段内的抗体反应区(ARD)产生强烈的相互作用,而ISU和ARD之间相互协调的平衡关系可能就是免疫抑制发生的关键[36-38]。临床上ALV-J常和其他病原混合感染引发机体更为明显的免疫抑制。在ALV与禽网状内皮组织增殖病毒(REV)共感染的蛋鸡病例中发现一种少见的细胞类型,介于原淋巴细胞和巨噬细胞之间(称为淋巴-巨噬细胞),这可能是ALV-J与REV相互促进、协同作用的结果。通过对ALV-J和REV感染CEF细胞的转录组进行分析,发现TRIM62调控微丝细胞骨架在共感染机制中起重要作用[39]。目前,对ALV-J引起的免疫抑制的防治虽取得了一定的进步,但是仍无有效药物或疫苗,其根本原因在于病毒靶向机体免疫系统并导致其损伤或无能。为此,需要在明确ALV-J诱导免疫抑制机制的同时,寻找减轻或消除机体免疫抑制的方法,是有效防治其危害的根本途径。
4 抗ALV-J天然免疫及其病毒靶点
病毒感染后,宿主细胞通过宿主不同类型的模式识别受体(pattern recognition receptor,PRR)感知具有病原体相关分子模式(pathogen-associated molecular patterns,PAMP)的病毒以及病毒产物的存在,触发不同的信号传导途径,诱导机体产生IFN或免疫相关因子抵抗病毒感染,激活相关免疫途径,抑制病毒复制(图2)。病毒与机体之间的进化导致了细胞先天性免疫蛋白和抗病毒因子的出现。通过研究发现,许多被确定为抑制特定逆转录病毒的限制因子对其他逆转录病毒也具有广泛的抗病毒活性,并且在多种病毒与宿主的相互作用下适应性进化,构成了抵御病毒攻击的先天免疫系统[21]。一方面,限制因子通过干扰病毒复制所需的细胞过程实现抗病毒。不育-α-基序结构域(SAM域)和组氨酸/天冬氨酸残基双联体结构域(HD域)包涵蛋白1(sterile alpha motif and histidine-aspartic acid domain-containing protein 1,SAMHD1)通过其水解酶功能调节细胞内脱氧核苷三磷酸(dNTPs)水平,抑制髓系和树突状细胞中病毒的复制,并限制CD4+T细胞对病毒的抑制作用[40]。当骨髓细胞或树突状细胞缺失SAMHD1时,病毒逆转录产物增加,并观察到的SAMHD1在残基T592处的磷酸化状态与细胞周期调控有关。BST2是一种Ⅱ型单程跨膜蛋白,具有独特的拓扑结构,充当细胞膜和出芽病毒粒子之间的桥梁,将出芽病毒粒子限制在细胞膜上,阻碍其感染其他正常细胞。另一方面,限制因子通过与病毒核酸相互作用限制病毒复制,APOBEC3酶催化病毒单链DNA的脱氨反应,产生对病毒致死的G→A高突变现象,产生缺陷病毒蛋白和非传染性病毒颗粒阻断反转录[41-42]。CCCH型锌指抗病毒蛋白(CCCH-zinc finger antiviral protein,CCCH-ZAP)作为宿主天然防御因子,可以通过识别并结合病毒蛋白发挥抗病毒作用,还可通过竞争结合的方式使ALV-J囊膜蛋白中ISU从类Norbin蛋白(NLP)上脱离,解除病毒造成的免疫抑制,恢复T细胞对外来病原体的免疫反应能力[43]。通过研究不同宿主限制因子与病毒生命周期阶段的相互作用,有助于了解ALV-J传播复制的机制,并利用这些限制因子的抗病毒作用开发新的治疗方法。

图2 限制因子阻断逆转录病毒生命周期的特定阶段[21]
5 展望
除了ALV-J外,其他亚群的ALV如A、B、C、D、E和K亚群等均可通过水平传播和垂直传播感染鸡只,进而导致鸡只发生肿瘤和免疫抑制。而ALV与其他反录病毒的部分基因同源,产生肿瘤或免疫抑制的分子机制也部分相似,因此,可为解析宿主抗病毒的天然免疫机制互相提供参考。例如Mx蛋白是一类由干扰素诱导产生具有抗病毒活性的动力蛋白样GTP酶,可以抑制人体免疫缺损病毒(human immunodeficiency virus,HIV)、马传染性贫血病毒(equine infectious anemia virus,EIAV)、猫免疫缺陷病毒(feline immunodeficiency virus,FIV)等反转录病毒的复制,但其对于ALV-J的抗病毒活性却还未研究。研究显示,ALV-J感染SPF雏鸡后,在ALV-J感染的外周血淋巴细胞(PBL)中Mx1表达显著增加,而其是否发挥抗病毒作用还未可知。到目前为止,虽然人们对于ALV-J的感染、复制、致瘤、免疫抑制及其天然抗病毒免疫的分子致病机制进行了研究,但是相对于人源反转录病毒分子机制研究的深入程度而言,还需要更深入的研究,从而为临床上ALV-J新型药物及疫苗的研制提供基础。
