不同性别和生长阶段对克氏原螯虾肠道菌群多样性的影响
2021-12-24谢梦琪张诗雨许荔立袁军法吴志新陈孝煊
谢梦琪 张诗雨 许荔立 蒋 飞 袁军法, 吴志新, 陈孝煊,
(1. 华中农业大学水产学院, 武汉 430070; 2. 湖北省水生动物病害防控工程技术中心, 武汉 430070;3. 华中农业大学水产养殖国家级实验教学示范中心, 武汉 430070)
肠道微生物生活在动物胃肠道黏膜和内容物中, 在长期的进化过程中, 与宿主之间形成了极为密切的关系。在正常生理状态下, 肠道微生物之间通过相互作用维持着动态平衡, 共同影响宿主的营养、免疫、生产性能、生理状态和疾病等过程[1,2]。研究表明, 许多肠道微生物可以分泌消化酶, 分解饲料中的淀粉和纤维素等物质, 为机体提供短链脂肪酸、氨基酸和维生素等[3], 促进机体的营养吸收[4]。许多微生物还可以促进宿主免疫系统(包括免疫细胞和免疫组织)的发育[5], 并通过影响黏膜分泌免疫球蛋白、非特异性免疫和免疫应答等过程提高机体的健康状况[6]。因此, 维持肠道菌群的稳态对提升宿主健康水平和促进宿主生长发育具有重要意义。
影响肠道菌群稳态的因素有很多, 例如宿主基因型、性别、环境、生长阶段和食物等。这在哺乳动物中已有广泛研究, 在鱼类中的研究也有较多报道[7—12]。在甲壳动物中, 有研究发现中华绒螯蟹(Eriocheir sinensis)成年雌性蟹的细菌群落多样性高于雄性蟹, 不同生长阶段各细菌比例不同, 优势细菌的丰度发生了显著变化; 雌性和雄性蟹具有相同的优势细菌, 且菌群丰度随生长阶段发生的变化在雄蟹和雌蟹中显示出一致的趋势[13]。对虾类肠道菌群的研究大多关注与疾病发生相关的微生物组成变化[14,15], 目前已有研究者对中国对虾(Pe-naeus chinensis)、日本对虾(Penaeus japonicus)、凡纳滨对虾(Litopenaeus vannamei)和墨吉对虾(Penaeus merguiensis)等虾类早期发育阶段的肠道菌群进行了分离鉴定[16—19]。但关于克氏原螯虾(Procambarus clarkii)肠道菌群在不同性别和不同生长阶段之间的差异还未见报道。
克氏原螯虾是一种淡水虾类, 是我国重要的经济养殖虾类之一[20]。本实验通过16S rRNA高通量测序的方法, 对自然环境中不同性别的克氏原螯虾以及实验环境下不同生长阶段的克氏原螯虾肠道菌群组成及功能进行了分析, 为克氏原螯虾生长过程中肠道益生菌的筛选及克氏原螯虾养殖产业中益生菌制剂的研究提供科学依据和理论指导。
1 材料与方法
1.1 不同性别克氏原螯虾肠道取样
克氏原螯虾样品采集自湖北省武汉市蔡甸区武汉沃土清源稻虾供养专业合作社(30.39°N,113.77°E)。取不同性别, 体长约10.00 cm的克氏原螯虾成虾, 用75.0%的酒精进行体表消毒, 在无菌环境下分离其后肠, 每3—4只虾肠混成一个样品, 保证每个样品肠道中的内容物共计不低于0.20 g, 其中雌性3个样品, 雄性4个样品, 置于无菌管中, 在-80℃下冻存。对克氏原螯虾的处理严格遵从实验动物饲养和处理标准。用粪便基因组DNA快速提取试剂盒(北京艾德莱生物科技有限公司)提取样品微生物总DNA。
1.2 不同生长阶段克氏原螯虾肠道取样
克氏原螯虾亲本采集自武汉沃土清源稻虾供养专业合作社。体表用高锰酸钾浸泡消毒后, 置于经高锰酸钾消毒过的水族箱中暂养2周, 养殖密度为10只/箱, 雌雄性别比例为1∶1。养殖用水为经过曝气的自来水, 水深(5.00±1.00) cm, 水温(25.00±1.00)℃, L∶D为12∶12, 投喂商业颗粒饲料(通威集团生产)。亲虾自然交配产卵, 幼虾孵出后置于另外的水族箱中饲养, 投喂饲料和饲养条件与成虾相同。取体长约2.00 cm的幼虾(孵化后1个月)肠道(10只幼虾肠道混为1个样品)及体长约27.00 cm的成虾(3只成虾肠道混为1个样品), 置于无菌管中, 在-80℃下冻存。按1.1的方法提取总DNA。
1.3 PCR扩增条件和测序
对16S rRNA的V3—V4区域进行扩增(引物为341F: 5′-CCTAYGGGRBGCASCAG-3′和806R: 5′-GGACTACNNGGGTATCTAAT-3′)。热反应条件为94.00℃变性5min; 94.00℃ 30s, 54.00℃ 30s,72.00℃ 30s的30个循环; 最后在72.00℃下延长10min。从1.2%琼脂糖凝胶上切下PCR产物, 并使用AxyPrep DNA凝胶提取试剂盒(AXYGEN, 美国)纯化。对每种纯化的PCR产物进行基于Illumina的高通量测序(BGI, 中国深圳)。
1.4 生物信息分析
对数据进行数据过滤[21], 获得Clean data。使用FLASH (Fast Length Adjustment of Short reads,v1.2.11)软件, 利用reads 之间的重叠关系将双末端测序得到的成对reads组装成一条序列[22], 最小匹配长度10 bp, 重叠区域允许错配率为0.1, 得到高变区的Tags; 利用USEARCH (v7.0.1090)软件[23], 在97.0%的相似度下将Tags 聚类成OTU, 去除嵌合体,然后通过OTU 与数据库比对, 对OTU 进行物种注释; 基于OTU 和物种注释结果进行样品物种复杂度分析及组间物种差异分析。
Alpha多样性是对单个样品中物种多样性的分析[24], 包括Observed species指数、Chao1指数、ACE指数、Shannon指数及Simpson指数等。通过mothur (v1.31.2)软件计算样品的Alpha多样性值, 用SPSS 22.0对Alpha多样性指数进行独立样本t检验(Independent samplest-test)。
Beta多样性分析是用来比较一对样品在物种多样性方面存在的差异大小, 包括Bray-Curtis距离、weighted UniFrac距离和unweighted UniFrac距离等。通过QIIME (v1.80)软件分析各类群在样品中的含量, 进而计算出不同样品间的Beta多样性值。
2 结果
2.1 性别对克氏原螯虾肠道菌群的影响
高通量测序的一般分析对2组克氏原螯虾样品(4个雄性样本, 3个雌性样本)的肠道微生物进行测序, 去除低质量序列后, 共获得876639条序列,雄性肠道菌群高质量序列在122100—133200, 雌性高质量序列在123068—127654。对每个样本获得的序列按97.0%的序列相似度进行归并和OTU划分, 共得到2039个OTU。
用Alpha多样性指数分析雌雄虾肠道菌群多样性的差异(表 1)。Chao1指数、ACE指数、Shannon指数和Simpson指数均无显著性差异, 表明雌雄克氏原螯虾肠道菌群的Alpha多样性在统计学上无差异。

表1 不同性别克氏原螯虾肠道微生物Alpha多样性指数(平均值±标准差)Tab. 1 Alpha diversity index of intestinal microbiota in P. clarkii of different sexes (mean±SD)
肠道菌群组成和结构通过与数据库进行比对, 对OTU进行物种分类并分别在门、纲、目、科、属、种几个分类等级对各个样品作物种profiling面积图和柱状图。在门水平上, 雌雄克氏原螯虾肠道优势菌群(相对丰度>1.0%)组成较为一致,包括变形菌门Proteobacteria (27.3±12.8)%、厚壁菌门Firmicutes (25.7±14.1)%、软壁菌门Tenericutes(18.8±13.7)%和拟杆菌门Bacteroidetes (18.3±17.3)%等, 各优势菌门在个体间丰度不同, 但不具有显著性差异(图 1)。

图1 门水平上不同性别克氏原螯虾肠道菌群组成Fig. 1 Composition of intestinal microbiota of P. clarkii of different sexes at the phylum level
在属水平上, 除未能归类的属外, 雌雄克氏原螯虾肠道优势菌群的组成较为一致, 包括拟杆菌属Bacteroides(11.8±14.0)%、希瓦氏菌属Shewanella(6.8±6.5)%、梭菌属Clostridium(4.8±7.7)%、厌氧杆菌属Anaerorhabdus(3.8±5.3)%和柠檬酸杆菌属Citrobacter(1.5±0.7)%等, 个体间相对丰度不同, 但不具有显著性差异(图 2)。

图2 属水平上不同性别克氏原螯虾肠道菌群组成Fig. 2 Composition of intestinal microbiota of P. clarkii of different sexes at the genus level
肠道菌群Beta多样性克氏原螯虾肠道菌群基于Weighted_UniFrac多样性距离、Unweighted_UniFrac多样性距离及Bray_curtis多样性距离的聚类热图分析都未显示出根据性别进行聚类的现象,在雌性和雄性的肠道菌群组成中并未表现出有规律的差异(图 3)。

图3 不同性别克氏原螯虾肠道菌群Beta多样性分析Fig. 3 Beta diversity analysis of intestinal microbiota of P. clarkii of different sexes
2.2 成虾和幼虾肠道菌群组成差异
高通量测序的一般分析在去除低质量序列后, 从8个样本中共分离到249813条序列, 对获得的序列按97.0%的序列相似度进行归并和OTU划分, 共得到18186个OTU。
Alpha多样性指数分析显示(表 2), Chao1指数和ACE指数有显著性差异(P<0.05), Simpson和Shannon指数没有显著性差异, 表明幼虾的肠道菌群多样性高于成虾。
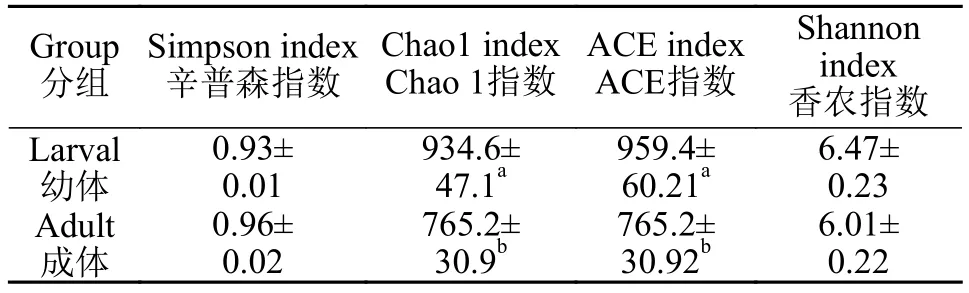
表2 不同生长阶段克氏原螯虾肠道微生物Alpha多样性指数(平均值±标准差)Tab. 2 Alpha diversity index of intestinal microbiota in P. clarkii at different stages of growth (mean±SD)
肠道菌群组成和结构在门水平上, 幼虾肠道中相对丰度较高的优势门有变形菌门(35.6%)、拟杆菌门(32.0%)、厚壁菌门(17.6%)、软壁菌门(8.8%)和放线菌门(5.1%)。成虾肠道中相对丰度较高的优势门有变形菌门(65.7%)、拟杆菌门(20.4%)、厚壁菌门(9.6%)、放线菌门(0.9%)和疣微菌门Verrucomicrobia (0.7%; 图 4a)。虽然成虾和幼虾的优势菌群较为一致, 但Meta-stats分析显示其丰度具有偏向性, 有显著性差异的细菌门有13个, 包括Thermi、酸杆菌门、放线菌门、拟杆菌门、衣原体门Chlamydiae、芽单胞菌门Gemmatimonadetes、GN02、浮霉菌门Planctomycetes、变形菌门、SR1、软壁菌门、TM7和疣微菌门(图 4b)。

图4 门水平上不同生长阶段克氏原螯虾肠道菌群组成和差异Fig. 4 Intestinal microbial composition and differences of P. clarkii at different stages of growth at the phylum level
在属水平上, 成虾和幼虾的肠道优势菌群组成差异较大, 在幼虾肠道中相对丰度较高的优势属有伯克氏菌目的一个未归类属Unclassified_Burkholderiales (21.1%)、氢噬胞菌属Hydrogenophaga(7.6%)、黄杆菌属Flavobacterium(7.4%)、丛毛单胞菌科的一个未归类属Unclassified_Comamonadaceae(5.4%)和嗜碱菌属Alkaliphilus(5.2%); 成虾肠道中相对丰度较高的优势属有拟杆菌属(12.5%)、黄杆菌属(10.8%)、Paracoccus(9.1%)和毛螺菌科的一个未归类属Unclassified_Lachnospiraceae (5.5%; 图5a)。Metastats分析显示, 在属水平上成虾和幼虾有显著性差异的细菌属有70个, 前20位差异最大的细菌属包括枝动菌属Mycoplana、不黏柄菌属Asticcacaulis、鞘氨醇单胞菌Sphingomonas、嗜碱菌属、新鞘氨醇杆菌属Novosphingobium、Methylopila、鞘脂菌属Sphingobium、成对杆菌属Dyadobacter、红球菌属Rhodococcus、氢噬胞菌属Hydrogenophaga、分枝杆菌属Mycobacterium、Tepidibacter、甲基醌菌属Demequina、Kaistobacter、曲杆菌属Ancylobacter、戴尔福特菌属Delftia、苍白杆菌属Ochrobactrum、Rheinheimera、Methyloversatilis和Sediminibacterium(图 5b)。

图5 属水平上不同生长阶段克氏原螯虾肠道菌群的组成和差异Fig. 5 Intestinal microbial composition and differences of P. clarkii at different stages of growth at the genus level
肠道菌群Beta多样性PCA分析显示出按照生长阶段, 即成虾和幼虾分别聚类的结果(图 6a)。无论基于Unweighted_UniFrac距离还是Weighted_UniFrac距离的PCoA分析, 都显示出明显地根据生长阶段分别进行聚类的结果(图 6b和图 6c)。对测序结果进行Adonis/PERMANOVA分析, 基于加权和未加权UniFrac距离的分析结果均显示出成虾和幼虾肠道菌群有显著差异(P<0.05)。

图6 不同生长阶段克氏原螯虾肠道微生物的Beta多样性分析Fig. 6 The β diversity analysis of intestinal microbiota in P. clarkii at different stages of growth
NMDS分析和UPGMA聚类分析也显示出明显的根据生长阶段进行聚类的情况。进一步对测序结果进行Anosim分析, 基于加权和未加权UniFrac距离的分析结果均显示出成虾和幼虾肠道菌群的显著性差异(P<0.05; 图 7)。

图7 不同生长阶段克氏原螯虾肠道微生物的NMDS分析和UPGMA聚类分析Fig. 7 The NMDS and UPGMA clustering analysis of intestinal microbiota in P. clarkii at different stages of growth
成虾和幼虾肠道菌群的比较分析PLSDA分析显示成虾和幼虾肠道菌群结构具有显著性差异; 使用R软件, 对丰度前50位的属进行聚类分析并绘制热图, 结果也显示出其肠道菌群根据生长阶段进行聚类的情况(图 8)。

图8 不同生长阶段克氏原螯虾肠道微生物的PLS-DA分析和热图Fig. 8 The PLS-DA and heatmap of intestinal microbiota in P. clarkii at different stages of growth
幼虾和成虾肠道菌群的功能预测在KEGG pathway database数据库中对幼虾和成虾的肠道菌群进行PICRUSt功能预测, 使用R软件, 对丰度前50位的功能类群进行聚类分析并绘制热图(图 9)。成虾和幼虾肠道菌群的主要功能包括细胞通讯、膜运输、氨基酸代谢、碳水化合物代谢、遗传信息复制和修复和能量代谢等, 2个生长阶段差异最显著的功能有细胞运动、膜运输、碳水化合物代谢、异生素的生物降解和代谢、脂质代谢和信号转导等。

图9 PICRUSt预测的不同生长阶段克氏原螯虾肠道菌群功能的相对丰度Fig. 9 The relative abundance of the function of the intestinal microbiota predicted by PICRUSt in P. clarkii at different stages of growth
3 讨论
对不同性别克氏原螯虾肠道菌群进行高通量测序发现, 在野外虾塘养殖下的克氏原螯虾的肠道菌群不论是在群落多样性、物种丰度还是菌群功能预测上, 都未体现出性别间的差异, 且肠道菌群的个体差异较大。对成虾和幼虾的肠道菌群进行高通量测序发现, 不同阶段对肠道微生物的群落多样性、丰度及功能都有显著影响。
3.1 不同性别克氏原螯虾肠道菌群的分析
有报道表明, 中华绒螯蟹雌雄个体的肠道菌群并无明显差异, 具有相同的优势细菌, 且菌群丰度随生长阶段发生的变化在雄蟹和雌蟹中显示出一致的趋势[11]。在本实验中雌雄克氏原螯虾肠道菌群的Alpha多样性指数(Chao1指数、ACE指数、Shannon指数和Simpson指数)均无显著性差异。在物种组成和结构上, 其拥有的优势菌群较为一致, 门水平上包括厚壁菌门、变形菌门和拟杆菌门等, 属水平上包括拟杆菌属、希瓦氏菌属、梭菌属和柠檬酸杆菌属等,这些优势菌在成虾肠道中趋于保守, 属常驻菌群, 与南美白对虾和黑虎虾(Penaeus monodon)等结果相似[25—27]。
3.2 不同生长阶段克氏原螯虾肠道菌群的分析
在罗非鱼的研究中发现, 随着养殖周期的推移, 其肠道菌群多样性表现出先上升后下降的趋势, 不同生长阶段的优势菌群组成也有所差异[28]。在本实验中克氏原螯虾幼虾的Chao1指数和ACE指数显著性高于成虾(P<0.05)。
在门水平的物种组成和结构上, 两个阶段的优势菌群较为一致, 包括变形菌门、拟杆菌门和厚壁菌门等。其中, 变形菌门是相对丰度最高的细菌门, 在许多动物肠道中都属常驻菌, 肠道微生物群落的失衡通常源于变形菌门丰度的变化,在变形菌门中有许多条件致病菌, 其在肠道内的比例能够反映微生态和肠道微生物群落结构的稳定性, 是肠道菌群失调的微生物标志[27]。拟杆菌门与碳水化合物的发酵相关, 可以参与到胆汁酸以及类固醇的代谢中。拟杆菌门和厚壁菌门对发酵多糖都非常重要, 且两者之间存在着一种相互促进的共生关系, 它们共同促进宿主吸收或储存能量, 其比值的变化会影响机体内肠道菌群的代谢潜力, 具有十分重要的意义。有研究表明患有肥胖症的小鼠肠道内厚壁菌门较多, 拟杆菌门较少, 这种菌群结构在分解食物和促进宿主能量吸收方面的能力更强[30]。在本实验中幼虾的比值为0.47 (F∶B=0.47), 成虾比值为0.55 (F∶B=0.55), 显示出成虾更强的分解食物和吸收营养的能力。
在属水平上, 成虾和幼虾的优势菌群均包括黄杆菌属、拟杆菌属和氢噬胞菌属, 是克氏原螯虾的核心菌群。黄杆菌属可以分解多糖, 拟杆菌的表面鞘脂的合成有助于维持肠道稳态[31], 且与氢噬胞菌属一样可以代谢氨基酸和碳水化合物,这些菌属均在肠道代谢中扮演着重要作用[32]。成虾和幼虾有显著性差异的细菌属包括嗜碱菌属、甲基醌菌属、曲杆菌属和红球菌属等。其中嗜碱菌属在幼虾中相对丰度较高, 是一类严格厌氧菌, 在自然界中常见于盐度较高的水体中,而成虾中相对丰度较高的甲基醌菌属同样是嗜碱菌, 可以分解代谢木聚糖。红球菌属是一种好氧的革兰氏阳性菌, 在成虾肠道内相对丰度较高。有研究表明有些红球菌可以合成自由基清除剂参与机体的免疫防御机制[33], 大多数红球菌则通过分泌多种消化酶参与宿主营养代谢[34,35],广泛存在于虾蟹的肠道菌群中, 与本实验结果相符。
在对成虾和幼虾肠道菌群Beta多样性的分析中, PCA分析、PCoA分析、多元方差分析、NMDS分析、UPGMA聚类分析和PLS-DA分析均显示出不同生长阶段间肠道菌群组成和结构上的差异, 与鲤(Cyprinus carpio)等水生动物的报道相似[36]。功能预测的结果显示, 幼虾和成虾肠道菌群差异较大的功能中, 成虾肠道菌群的优势功能包括膜运输和碳水化合物代谢等, 幼虾肠道菌群的优势功能包括细胞运动、异生素的生物降解和代谢、脂质代谢等。由于成虾A4样品与铁复合运输系统(Iron complex transport system)相关功能的相对丰度较高, 在聚类时与幼虾聚为一支。
有作者报道, 莫桑比克罗非鱼(Oreochromismossambicus)肠道正常菌群的建立是在其孵化后20—60d, 并推测其建立与肠道的结构与功能的发育有关[37]。研究表明, 在克氏原螯虾的养殖过程中, 从幼虾发育为成虾会由摄食浮游生物转换为摄食颗粒饲料[38], 肠道内多种消化酶表达增强[39]。为了适应这种摄食习性的转换, 克氏原螯虾肠道菌群也会随着消化系统的发育产生结构和功能上的变化。
