中成药复方丹参片质量标准研究
2021-12-24母丹
母 丹
(重庆市生物技术研究所有限责任公司 重庆 401121)
中药复方提取物是一个较复杂的混合物,为提高中药质量,保证用药的安全、合理、有效,在中药制剂的研究,生产,保管,供应及临床使用过程中,都应进行严格的分析检验,全面控制中药制剂的质量。在平时工作中,中药整个制作流程,从原料采购、生产设备、生产工艺、检验检测到储存都应该严格遵守中药的质量标准。本论文按《中国药典》(2015年版一部)[1]质量标准考察复方丹参片的质量,主要是用高效液相色谱法测定复方丹参片中每片含丹参量,以丹参酮IIA的含量来判断,复方丹参片中每片含丹参以丹参酮IIA计不得少于0.20mg。
一、复方丹参片的介绍
(一)复方丹参片的制法
按照《中国药典》中规定的方法制得。丹参450g,三七141g,冰片8g这三味中药材,先将丹参提取三次,第一次加入乙醇回流,过滤,回收浓缩至相对密度1.30(55~60℃)。第二次加50%的乙醇回流1.5小时,过滤。第三次加水回流2小时,过滤,合并后面两次的滤液再回收乙醇,浓缩至相对密度1.40(55~60℃),与第一次的浓缩液合并,混匀,制成相对密度为1.35~1.39(55℃)的清膏。将三七粉碎成细粉,与丹参清膏拌匀,干燥,制成颗粒,将冰片研细,与上述颗粒混匀,压制成1 000片,或包糖衣或薄膜衣,即得。
(二)复方丹参片的药理作用
复方丹参片是由丹参、三七及冰片按一定比例互配制成的中成药[2],具有活血化淤、理气止痛的功效。常用于活血化瘀,理气止痛及气滞血瘀所致的胸中憋闷,症见胸闷、心前刺痛、心绞痛等。临床上,常用于心血管疾病方面的治疗,因此必须保证复方丹参片的产品质量,研究其质量标准有着极其重要的作用。
二、实验部分
本论文实验根据中国药典2015年版一部检验标准对复方丹参片进行质量检验,共检测了20100901、20100902、20100903三批复方丹参片,规格为0.3g。
(一)性状
根据药典的方法,对复方丹参片的外观性质进行记载。
(二)定性鉴别
按照《中国药典》2015年版一部质量标准中测定方法进行测定。
1.样品色谱中,样品色谱和丹参酮IIA对照品色谱相同位置上,当显现出相同颜色的斑点后,马上喷上1%香草醛硫酸溶液,再110℃加热显色。在与冰片对照品色谱相同的位置上,显现相同颜色的斑点(色谱图见图1)。

图1 复方丹参片中丹参与冰片的TLC鉴别
2.供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点(色谱图见图2)。

图2 复方丹参片中三七的TLC鉴别
(三)检查
复方丹参片为片剂,除按照《中国药典》2015年版通则0101片剂项下的规定测定其重量差异,崩解时限项目外,还应该测定砷盐、重金属、微生物限度的指标。
1.重量差异
取3批样品各20片,按重量差异检查法(《中国药典》2015年版通则0101)检查结果。
2.崩解时限
按《中国药典》2015年版通则0921检查法检查。
3.重金属
按《中国药典》2015年版四部重金属检查法第二法检查。
4.砷盐
取本品研细,取1g,加10%硝酸镁乙醇液10mL,点燃,熄灭后,缓缓在550℃炽灼使完全炭化、放冷,残渣加盐酸溶液(2~10)10mL时溶解,将溶液移入检砷瓶中,坩埚用13mL的水分次洗涤干净,洗液均加入检砷瓶中,再加3mL盐酸,按《中国药典》2015版四部砷盐检查法项下第一法(古蔡氏法),自“再加碘化钾试液5mL”起,依法操作,检测3批样品中砷盐含量。
5.微生物限度检查
按《中国药典》2015年版四部(通则1105)检测法检查。
复方丹参片属于中药复方制剂,其处方组成为丹参-三七-冰片(450∶141∶8),实验中发现,由于复方丹参片中含有丹参和冰片,这两种中药材均含有抑制菌落生长的物质,对微生物限度检查结果会产生一定的影响,在进行微生物限度检查时,由于常规法和培养基稀释法检出率较低,为了制定科学合理的复方丹参片微生物限度检验方法,制定出科学合理的微生物限度标准,特采用薄膜过滤法对细菌、酵母菌及霉菌进行检查,以消除药品中抑菌成分的干扰。
三、有效成分含量测定
为了更好地控制制剂的质量,对处方中的有效成分进行含量测定,拟选择处方中主药丹参所含的有效成分丹参酮IIA作为控制本品质量的指标成分。由于高效液相在药品分析定量方面应用广泛、灵敏、准确、重现性好、精密度高等优点。故参照《中国药典》2015年版有关规定,建立了高效液相色谱法测定丹参酮IIA的含量测定方法。
(一)丹参酮IIA的测定
丹参酮IIA照高效液相色谱法(通则0512)测定。
1.色谱条件
色谱柱:ZORBAX Eclipse XDB-C18(4.6×250mm粒度 5-Micron);流动相:甲醇:水为73:27;柱温:室温;流速1.0mL/min;检测波长为270nm;理论板数按丹参酮IIA峰计算应不低于2 000。
2.配液
制备对照品溶液,精密称取丹参酮Ⅱ<[A]>对照品10mg,放置在50mL的棕色量瓶中,加入甲醇溶解,定容至刻度,摇匀。精密量取5mL,置25mL棕色量瓶中,加甲醇至刻度,摇匀,即得(每1mL中含丹参酮Ⅱ<[A]>40μg)。
供试品溶液的制备取本品10片,除去糖衣片,用乳钵研细至粉末,精密称取1g,加入甲醇25mL,称定重量并记录,超声处理15分钟,放冷,再称定重量,用甲醇补足减少的重量,摇匀后过滤,取续滤液,即得。
(二)线性关系考察
精密移取对丹参酮IIA照品溶液0μL、2μL、4μL、6μL、8μL、10μL、12μL、14μL分别进样,测定,以峰面积为纵坐标,质量为横坐标,绘制标准曲线。
(三)精密度实验
精密吸取对丹参酮IIA对照品溶液,按上述色谱条件连续进样6次,每次进样10μL,测定。
(四)重复性实验
精密吸取取同一批号供试品液,按上述色谱条件连续进样3次,每次进样10μL,测定。
(五)供试品含量测定
分别精密吸取对照品与供试品溶液各10μL,注入液相色谱仪,测定即得。
四、结论
本次实验中对药物进行的质量评价,所涉及到的检测项目有:性状、鉴别、粒度、水分、溶化性、装量差异、含量测定、微生物限度。通过本次实验加深了对药品检查项目的了解,以及在操作过程中很多问题也在实践中得到解决。[3]
本论文按照《中国药典》2015版复方丹参片的检验标准,依次进行性状检验;鉴别项检验;有关物质、崩解时限、微生物限度的检查;含量测定;完成了对三个批号复方丹参片的质量检测。其检验结果见表1。
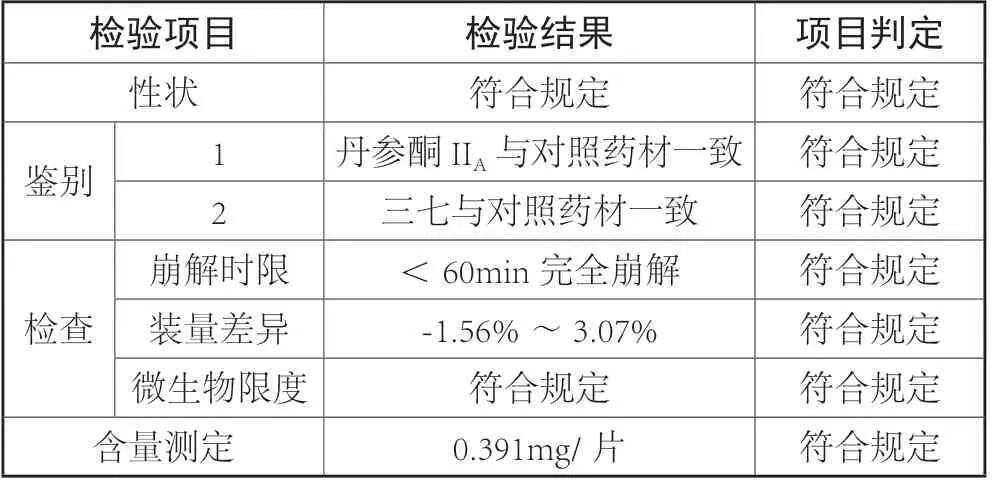
表1
三批复方丹参片的片重差异、重金属、砷盐、含量测定的检查符合药典的规定,经薄层鉴别证实复方丹参片中含有丹参、冰片和三七。通过线性、精密度、重复性实验方法验证该定量体系简便,准确,重现性好,可用做复方丹参片的质量控制。[4]
复方丹参片在临床上应用广泛,但是不同的生产企业生产出来的产品质量也不尽相同,其中三七和冰片的含量也存在较大的差异。丹参由于产地、时间、来源等的差异,即使同一企业的的丹参不同批次的产品也会存在差异。又由于冰片具有挥发性,其保存不当也会回复方丹参片的质量造成影响。因此,研究复方丹参片的质量标准及其重要,提高其质量标准势在必行。
