益气解毒方水提物对人结肠癌HCT-116细胞凋亡及其NF-κB信号通路相关蛋白表达的影响
2021-12-23罗欢魏行云刘灵邹攀何迎春江志超
罗欢 魏行云 刘灵 邹攀 何迎春 江志超

〔摘要〕 目的 研究益气解毒方水提物对结肠癌HCT116细胞凋亡及B细胞淋巴瘤-2相关X蛋白(Bax)、X连锁凋亡抑制蛋白(XIAP)、生存素(Survivin)和NF-κB信号通路相关蛋白表达的影响。方法 采用噻唑蓝(MTT)比色法检测不同浓度(1,0.5,0.25,0.125 g·L-1)益气解毒方水提物对HCT116细胞活性的影响;采用Hoechst 33342 染色法及流式细胞术检测其对HCT116细胞凋亡的影响;采用蛋白免疫印迹法(Western blot)检测其对HCT116细胞凋亡相关蛋白Bax、XIAP、Survivin及NF-κB通路相关蛋白NF-κB、IκK、IκB的影响。结果 MTT结果提示益气解毒方水提物能抑制HCT116细胞活性,呈时间-剂量关系(P<0.01);与对照组比较,Hoechst 33342染色及流式细胞术结果显示益气解毒方水提物处理后,凋亡率升高(P<0.01);XIAP、Survivin表达下降(P<0.01),Bax表达上升(P<0.05,P<0.01),NF-κB、IκK、IκB表達均下降(P<0.05,P<0.01)。结论 益气解毒方水提物可抑制结肠癌HCT116细胞增殖,诱导其凋亡,其机制可能与抑制NF-κB信号通路相关蛋白NF-κB、IκK、IκB表达,下调XIAP、Survivin表达,上调Bax表达有关。
〔关键词〕 益气解毒方;结肠癌;NF-κB;信号通路;细胞凋亡
〔中图分类号〕R273 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.12.008
Effect of Aqueous Extract of Yiqi Jiedu Formula on Human Colon Cancer HCT-116 Cells Apoptosis and NF-κB Signaling Pathway Related Protein Expression
LUO Huan1, WEI Xingyun1, LIU Ling1, ZOU Pan1, HE Yingchun2,3, JIANG Zhichao3,4*
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Hunan Provincial Key Laboratory for the Prevention and Treatment of Ophthalmology and Otolaryngology Diseases with Traditional Chinese Medicine, Changsha, Hunan 410208, China; 3. Hunan Provincial Ophthalmology and Otolaryngology Diseases Prevention and Treatment with Traditional Chinese Medicine and Visual Function Protection Engineering and Technological Research Center, Changsha, Hunan 410208, China;
4. Hunan Provincial Brain Hospital, The Second People’s Hospital of Hunan Province, Changsha, Hunan 410007, China)
〔Abstract〕 Objective To investigate the effect of aqueous extract of Yiqi Jiedu Formula on colon cancer HCT116 cells apoptosis and B-cell lymphoma-2 related X protein (Bax), X-linked inhibitor of apoptosis protein (XIAP), Survivin and the influence of NF-κB signaling pathway related protein expression. Methods The thiazole blue (MTT) colorimetric method was used to detect the effect of different concentrations (1, 0.5, 0.25, 0.125 g·L-1) of aqueous extract of Yiqi Jiedu Formula on the cell viability of HCT116; Hoechst 33342 staining method and flow cytometry were used to detect its effect on HCT116 cell apoptosis; Western blot was used to detect its effect on HCT116 cell apoptosis-related proteins Bax, XIAP, Survivin and NF-κB pathway related proteins NF-κB, IκK, IκB. Results Aqueous extract of Yiqi Jiedu Formula could inhibit the activity of HCT116 cells in a time-dose relationship (P<0.01). Compared with the control group, Hoechst 33342 staining and flow cytometry results showed, after treatment with aqueous extract of Yiqi Jiedu Formula, the apoptosis rate increased (P<0.01); the expression levels of XIAP and Survivin decreased (P<0.01), the expression levels of Bax increased (P<0.05, P<0.01), the expression levels of NF-κB, IκK and IκB decreased (P<0.05,
P<0.01). Conclusion Aqueous extract of Yiqi Jiedu Formula can inhibit the proliferation of colon cancer HCT116 cells and induce their apoptosis. The mechanism may be related to inhibiting the expression of NF-κB signaling pathway related proteins NF-κB, IκK and IκB, down-regulating the expression of XIAP and Survivin, and up-regulating the expression of Bax.
〔Keywords〕 Yiqi Jiedu Formula; colon cancer; NF-κB; signal pathway; apoptosis
结直肠癌(colorectal cancer, CRC)已成为临床上最常见的消化道恶性肿瘤之一,癌症患者致死率在世界范围内位列第二[1]。尽管目前在手术、化疗、放疗以及靶向治疗等治疗手段上取得一定进展,但放化疗的毒副作用、耐药性,靶向药物的安全性等问题仍未解决,故寻找安全、有效、不良反应小的治疗药物是结直肠癌治疗中亟待解决的问题。益气解毒方是田道法教授多年实践的经验用方,由黄芪、黄连、党参、白花蛇舌草、天花粉、茯苓、甘草组成,具有益气解毒、扶正祛邪、生津润燥之功效,能有效抑制体内鼻咽癌瘤体的生长[2],延长患者生存期,提高患者生存质量。前期研究表明,益气解毒方可有效抑制鼻咽癌细胞增殖[3-4]、迁移[5-6],诱导凋亡[7]和自噬[8],还可调节免疫活性,增强巨噬细胞的免疫功能[9]。本课题组前期研究提示[10-11]益气解毒方对鼻咽癌细胞凋亡信号通路NF-κB途径具有抑制作用,进一步诱导了病变鼻咽上皮细胞的凋亡活性,且NF-κB通路的活化水平与结直肠癌的发展进程也密切相关[12]。中医学认为肺开窍于鼻,而“肺与大肠相表里”,在生理病理上相互影响,课题组预实验研究表明,益气解毒方能抑制结肠癌HCT116细胞活性。但其作用强度及机制尚不明确,本实验以结肠癌HCT116细胞为研究对象,观察益气解毒方水提物(Yiqi Jiedu Formula, YQ)对结肠癌HCT116细胞凋亡及凋亡相关蛋白Bax、XIAP、Survivin和NF-κB信号通路相关蛋白的影响,初步探讨其作用机制,为临床结肠癌的治疗提供实验和理论依据。
1 材料
1.1 细胞株
人结肠癌细胞HCT116,购自北京北纳创联生物技术研究院,批号19071806。
1.2 药物与试剂
益气解毒方药物组成:黄芪15 g,黄连10 g,党参10 g,白花蛇舌草20 g,天花粉15 g,茯苓10 g,甘草6 g,购于湖南中医药大学第一附属医院中药房。将中药粉碎后浸泡过夜,加10倍量蒸馏水回流提取2次,沸腾后保持1 h,合并提取液后真空泵抽滤,于旋转蒸发仪浓缩药液后,置于冷冻干燥机干燥得水提物,密封保存。适量水提物加入无菌培养基配制终质量浓度为25 g·L-1益气解毒方母液,使用0.22 μm的微孔滤膜过滤除菌,于-80 ℃冰箱保存。RPMI 1640 培养基(美国Cytiva公司,批号AF29546230),胎牛血清(美国Gibco公司,批号42A0378K),Annexin V-FITC/碘化丙啶(propidium iodide, PI)细胞凋亡检测试剂盒(美国BD公司,批号556547),Hoechst 33342(上海翊圣生物科技有限公司,批号 40731ES10),兔抗Bax、Survivn、XIAP、IκK,鼠抗NF-κB、IκB、β-actin,山羊抗兔、抗鼠二抗(美国CST公司,批号分别为5023,2808,14334,8943,6956,
4814,4970,7074,7076)。
1.3 仪器
ELX800酶标仪(美国BioTek公司);倒置相差生物显微镜(日本Olympus公司);CO2培养箱(美国赛默飞世尔公司);荧光双染流式细胞仪(美国Nexcelom公司);高速冷冻离心机(德国Eppendorf 公司);CytationTM5细胞成像多功能检测系统(美国BioTek公司)。
2 方法
2.1 细胞培养
将结肠癌HCT116细胞培养于含10%胎牛血清的RPMI-1640培养基中,置于37 ℃、5% CO2的恒温培养箱内培养,适时进行传代,取对数生长期细胞待用。
2.2 用MTT法检测细胞增殖
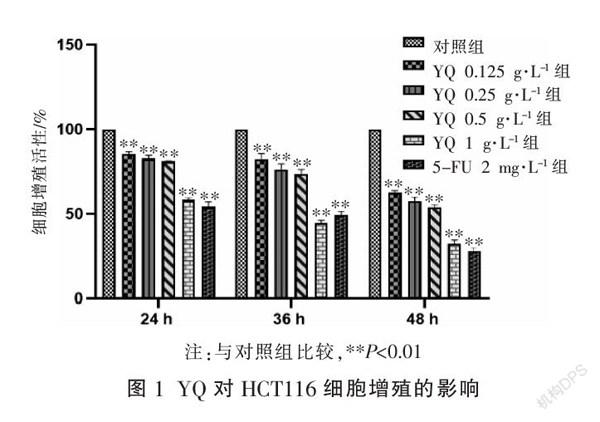
当结肠癌HCT116细胞处于对数生长期时,用不含EDTA胰蛋白酶消化,细胞计数以5×103个/孔种于96孔板中,待12 h后细胞贴壁,弃尽原培养基,分组如下:对照组、不同浓度(1,0. 5,0. 25,0.125 g·L-1)益气解毒方水提物(Yiqi Jiedu Formula, YQ)组、5-氟尿嘧啶(5-FU)2 mg·L-1组。分别在作用24、36、48 h后每孔加入100 μL MTT溶液,37 ℃放置4 h,弃除所有液体后加入DMSO,避光震荡10 min,用酶标仪在490 nm波长处检测吸光值,计算出细胞增殖抑制率。
2.3 Hoechst 33342染色法观察细胞凋亡形态
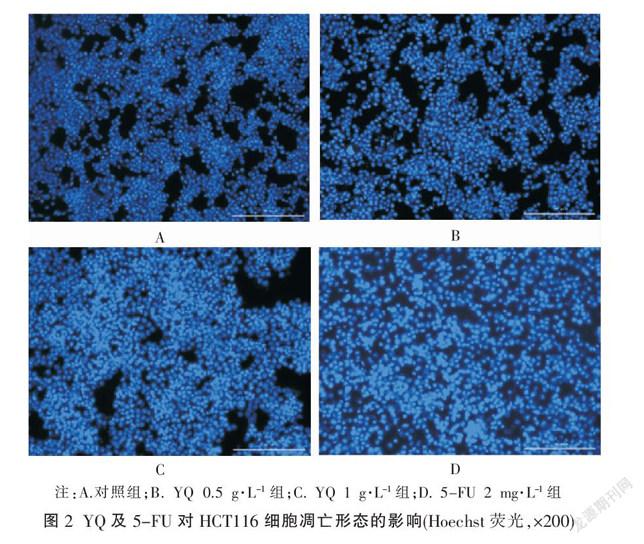
结肠癌HCT116细胞处于对数生长期时,常规方法消化,细胞计数以2×105个/孔种于6孔板中,分组如下:对照组、不同浓度(1,0.5 g·L-1)YQ组、5-FU 2 mg·L-1组待细胞贴壁后,加入不同浓度YQ,每个浓度设置3次复孔。处理48 h后,用PBS洗涤2次,每孔加入1 mL 10 mg·L-1的Hoechst 33342染色液,置于培养箱中避光孵育20 min,再用PBS洗涤3次,于CytationTM 5觀察拍照。重复3次。
2.4 流式细胞术检测细胞的凋亡情况
当结肠癌HCT116细胞处于对数生长期时,常规方法消化,细胞计数以5×105个/孔种于60 mm培养皿中,分组同“2.3”。继续培养48 h后,常规消化,收集细胞放入离心机中,以100×g的相对离心力进行离心,5 min后收集细胞,用4 ℃预冷的PBS洗涤细胞2次,每管加入100 μL 1×Binding Buffer进行重悬后,分别加入5 μL FITC和10 μL PI,混匀后室温避光染色15 min,再加100 μL 1×Binding Buffer终止染色,30 min内上机检测细胞凋亡情况。
2.5 蛋白免疫印迹法(Western bolt)检测细胞中Bax、XIAP、Survivin、NF-κB、IκK、IκB蛋白表达
取对数生长期细胞,常规方法消化,种于100 mm培养皿中,分组同“2.3”处理细胞48 h。收集细胞,用预冷的PBS清洗2次,滤纸将残留PBS吸出后,各皿加入含1% PMSF的裂解液80 μL,在冰上裂解30 min,于4 ℃下以13 000×g的相对离心力离心10 min并取上清液收集蛋白,按照BCA蛋白定量试剂盒说明书测定蛋白浓度,取90 μg上样,再经电泳后转至PVDF膜上,脱脂牛奶封闭1 h,孵一抗过夜后孵育二抗1 h,显影,分析。
2.6 统计方法
采用SPSS 25.0进行统计分析,每组实验重复3次,实验数据用“x±s”表示,计量资料服从正态分布,采用单因素方差分析,满足方差齐性,多重比较用LSD检验,方差不齐采用非参数检验。若计量资料不服从正态分布,则采用秩和检验。以P<0.05为差异有统计学意义。
3 结果
3.1 YQ对HCT116细胞增殖活性的影响
MTT法检测结果显示,不同浓度YQ处理 HCT116 细胞24、36、48 h后,与对照组相比,HCT116细胞增殖活性均受到抑制,且效应随着时间增强,呈剂量依赖性(P<0.01)。见图 1。
3.2 Hoechst 33342染色觀察YQ干预48 h后HCT116细胞形态
干预48 h后,对照组的细胞核呈均匀一致的淡蓝色,荧光微弱,偶有亮蓝色细胞核;不同浓度YQ处理后,颗粒状亮蓝色细胞明显增多,细胞核呈不规则形态,有明显的凋亡特征;5-FU处理后,细胞核荧光强度增强,有明显的凋亡。见图2。
3.3 流式细胞术检测YQ干预48 h后HCT116细胞凋亡率
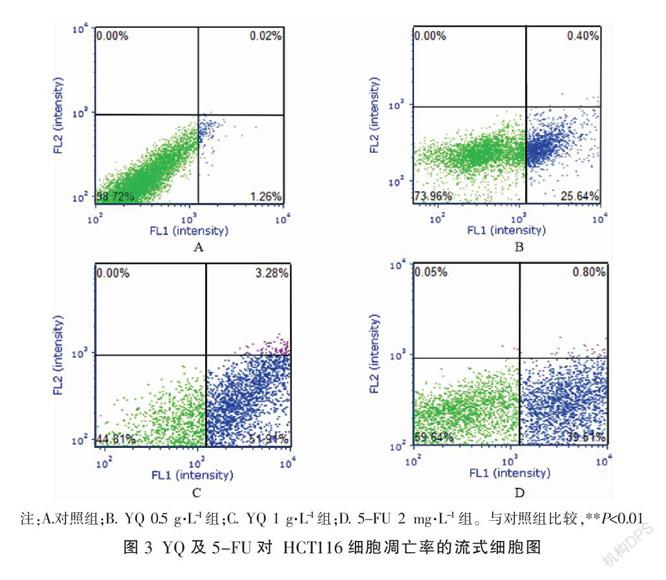
结果显示,对照组与YQ 1.0 g·L-1组、YQ 0.5 g·L-1组、5-FU 2 mg·L-1组细胞凋亡率分别为(1.36±0.32)%、(56.67±1.04)%、(25.70±2.86)%、(40.37±1.79)%,与对照组比较,不同浓度YQ组处理HCT116细胞48 h后,细胞凋亡率均显著上升(P<0.01)。见图3-4。
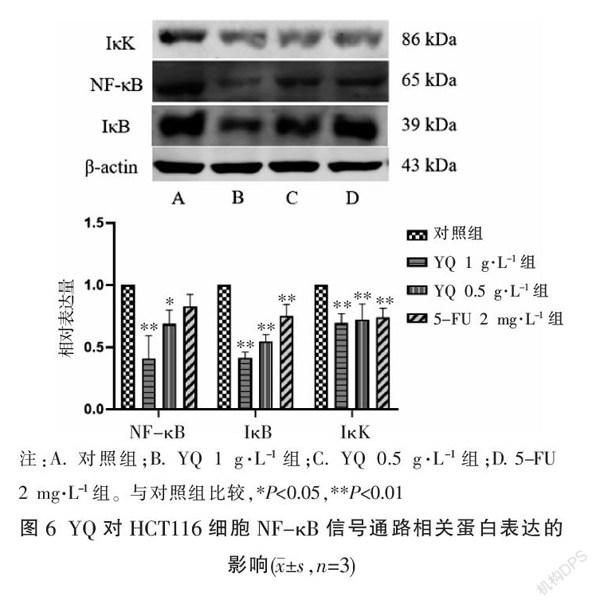
3.4 YQ对HCT116细胞凋亡相关蛋白Bax、XIAP、Survivin及NF-κB信号通路相关蛋白表达的影响
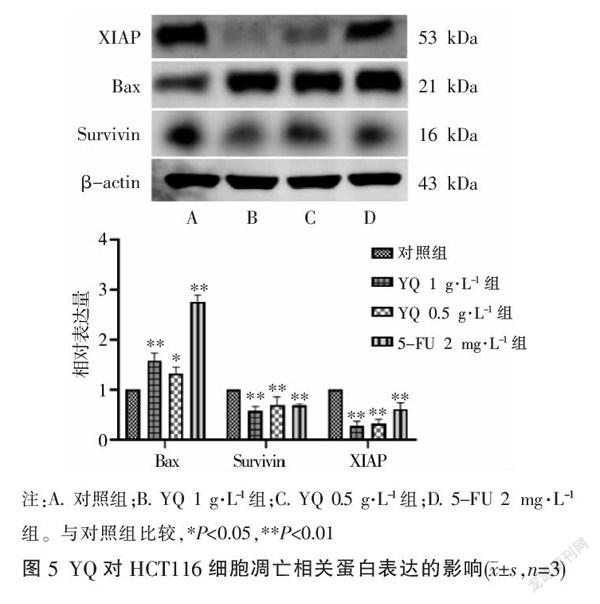
与对照组比较,经YQ干预后,Bax蛋白表达显著上调,Bax蛋白表达显著上调(P<0.05,P<0.01),XIAP、Survivin、IκB、NF-κB、IκK蛋白表达显著下调(P<0.05,P<0.01)。见图5-6。
4 讨论
结直肠癌归属于中医学“脏毒”“积聚”“肠蕈”等,病位在肠,与脾、肝、肾密切相关,病性总属本虚标实,正气亏虚为其本,邪实积聚为其标,进一步加重气血不畅,癌毒蕴结而成,故临床上中医药治疗结肠癌多采用扶正祛邪的组方策略,在延长生存期、提高患者生活质量方面可能存在一定优势[13]。
癌症的生长速率取决于肿瘤细胞的增殖活性和死亡率,细胞凋亡的功能缺陷可能导致细胞活性异常,凋亡与肿瘤的发生发展密切相关[14]。为探索益气解毒方对结肠癌细胞凋亡的作用,本研究先采用MTT法观察发现益气解毒方不同浓度对HCT116细胞的体外增殖活性均有抑制作用,且作用呈剂量依赖性(P<0.01)。为进一步验证益气解毒方对结肠癌细胞凋亡的影响,采用Hoechst 33342染色法及流式细胞术等检测凋亡较为理想的方法。Hoechst 33342染色结果显示,对照组呈均匀一致的淡蓝色,益气解毒方干预后细胞呈颗粒状亮蓝色,同时伴有细胞边界不齐、细胞核碎裂等凋亡特征。Annexin V-FITC/PI双染后通过流式细胞仪检测细胞凋亡情况,结果显示,与对照组相比,细胞凋亡率显著上升(P<0.01)。XIAP在结肠癌中高表达[15],可通过结合抑制Caspase蛋白活性阻止细胞凋亡[16-17];Bax为细胞凋亡的关键调节分子,促进癌细胞凋亡[18];Survivin具有明显的介导细胞增殖,阻断凋亡信号传导的作用,与肿瘤细胞的增殖凋亡关系密切[19-20]。本实验蛋白免疫印记法结果显示,益气解毒方可下调结肠癌HCT116细胞XIAP、Survivin表达(P<0.01),上调Bax蛋白表达(P<0.05,P<0.01),提示这可能是益气解毒方诱导结肠癌HCT116细胞凋亡的机制之一。
NF-κB指的是Rel家族的核转录因子,其通常在结直肠癌中处于过表达状态[21],通常情况下NF-κB与IκB结合以复合物的形式存在于胞质中,当NF-κB信号通路被激活,其具有负向调控活性的IκB被IκK磷酸化,随后NF-κB从复合物中释放并易位至细胞核,通过激活众多靶基因的转录,介导免疫、炎症、凋亡、增殖、血管生成及肿瘤侵袭转移等生物学过程[22]。研究表明,活化的NF-κB信号通路可上调Survivin、XIAP,下调促凋亡蛋白Bax的表达,从而发挥减少细胞凋亡的作用,促进结直肠癌发展进程[23]。本研究显示,益气解毒方作用于结肠癌细胞后,NF-κB、IκK、IκB蛋白表达均显著下调(P<0.05,P<0.01),说明益气解毒方可下调NF-κB信号通路相关蛋白表达水平,对结肠癌HCT116细胞凋亡信号通路NF-κB途径具有抑制作用。
综上所述,本研究表明,YQ有抑制结肠癌HCT116细胞增殖活性,促进凋亡的作用,其机制可能与上调Bax,下调XIAP、Survivin、NF-κB、IκK、IκB的表达有关,本研究结果为后续益气解毒方抗结肠癌的临床研究奠定了一定的实验基础和理论支持。
参考文献
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2018, 68(6): 394-424.
[2] 唐发清,田道法,邓富良,等.中药益气解毒颗粒对鼻咽癌裸鼠移植瘤蛋白质表达的影响[J].中南大学学报(医学版),2004,29(5):577-582.
[3] 范婧莹,刘 洁,刘晓丹,等.益气解毒方通过Wnt/β-catenin信号通路对鼻咽癌CNE2细胞增殖的影响[J].湖南中医药大学学报,2020,
40(5):535-539.
[4] 熊 雨,刘 洁,邹 攀,等.益气解毒方中苯丙素类化合物对鼻咽癌细胞增殖效应的影响[J].湖南中医药大学学报,2021,41(5):701-706.
[5] 陈 艳,杨 婷.益气解毒方对鼻咽癌细胞标志物T淋巴瘤侵袭转移诱导因子1及Ras相关C3肉毒素底物1表达的影响[J].中国中医药信息杂志,2018,25(5):46-49.
[6] HE LAN, ZHOU F L,PAN Z,et al. Yi Qi Jie Du Formula and Salinomycin Combination Treatment Mediates Nasopharyngeal Carcinoma Stem Cell Proliferation, Migration and Apoptosis via CD44/Ras Signaling Pathway[J]. Digital Chinese Medicine,2020,3(4): 297-308.
[7] 胡 晶,刘 洁,徐冰雁,等.MAPK/ERK信号通路在益气解毒方水提物诱导鼻咽癌细胞凋亡中的作用[J].中国药理学通报,2019,35(11):1613-1621.
[8] 蔺 婷,戴 娜,罗晶婧,等.益气解毒方通过PI3K/AKT/mTOR信号通路诱导鼻咽癌细胞自噬的研究[J].中华中医药杂志,2020,35(3):1484-1488.
[9] 廖 雪,蔺 婷,罗晶婧,等.益气解毒方水提物对RAW264.7细胞免疫功能的影响[J].肿瘤基础与临床,2015,28(6):473-476.
[10] 廖 雪.益气解毒方抗鼻咽癌药效物质基础及作用机制研究[D]. 长沙:湖南中医药大学,2016.
[11] 邹 攀,程 博,钟文良,等.基于网络药理学和生物信息学研究益气解毒方治疗鼻咽癌的分子机制[J/OL].中成药:1-7[2021-12-03].http://kns.cnki.net/kcms/detail/31.1368.R.20210707.1634.002.html.
[12] LUO C X, ZHANG H. The role of proinflammatory pathways in the pathogenesis of colitis-associated colorectal cancer[J]. Mediators of Inflammation, 2017, 2017: 5126048.
[13] 张 彤,何文婷,杨宇飞.中医药治疗Ⅳ期结直肠癌中医证候及用药规律文献研究[J].中医杂志,2017,58(11):966-970.
[14] GOLDAR S, KHANIANI M S, DERAKHSHAN S M, et al. Molecular mechanisms of apoptosis and roles in cancer development and treatment[J]. Asian Pacific Journal of Cancer Prevention, 2015, 16(6): 2129-2144.
[15] LEIPHRAKPAM P D, LAZENBY A J, CHOWDHURY S, et al. Prognostic and therapeutic implications of NHERF1 expression and regulation in colorectal cancer[J]. Journal of Surgical Oncology, 2020, 121(3): 547-560.
[16] ABBAS R, LARISCH S. Targeting XIAP for promoting cancer cell death-the story of ARTS and SMAC[J]. Cells, 2020, 9(3): 663.
[17] CHEN C, LIU T S, ZHAO S C, et al. XIAP impairs mitochondrial function during apoptosis by regulating the Bcl-2 family in renal cell carcinoma[J]. Experimental and Therapeutic Medicine, 2018, 15(5): 4587-4593.
[18] ASHKENAZI A, FAIRBROTHER W J, LEVERSON J D, et al. From basic apoptosis discoveries to advanced selective BCL-2 family inhibitors[J]. Nature Reviews Drug Discovery, 2017, 16(4): 273-284.
[19] 李 丹,劉延庆.Survivin与胃癌的中西医研究进展[J].中国实验方剂学杂志,2018,24(19):124-130.
[20] LYU H, HUANG J C, HE Z M, et al. Epigenetic mechanism of Survivin dysregulation in human cancer[J]. Science China Life Sciences, 2018, 61(7): 808-814.
[21] 杨亚玲,周 宁,黄 丹.早期结直肠癌组织中PGC-1α、NF-κB p65的表达及与临床病理特征和预后的相关性分析[J].解放军医药杂志,2020,32(7):31-34.
[22] SOLEIMANI A, RAHMANI F, FERNS G A, et al. Role of the NF-κB signaling pathway in the pathogenesis of colorectal cancer[J]. Gene, 2020, 726: 144132.
[23] 罗 欢,何 兰,何迎春,等.核因子-κB(NF-κB)与核因子E2相关因子2(Nrf2)信号通路交互对结直肠癌防治及中药研究的启示[J].中国临床药理学杂志,2021,37(10):1266-1271,1276.
