真武汤对慢性心力衰竭大鼠心肌细胞ERK5及线粒体自噬关键蛋白的影响
2021-12-23别明珂曾昭文陈新宇
别明珂 曾昭文 陈新宇
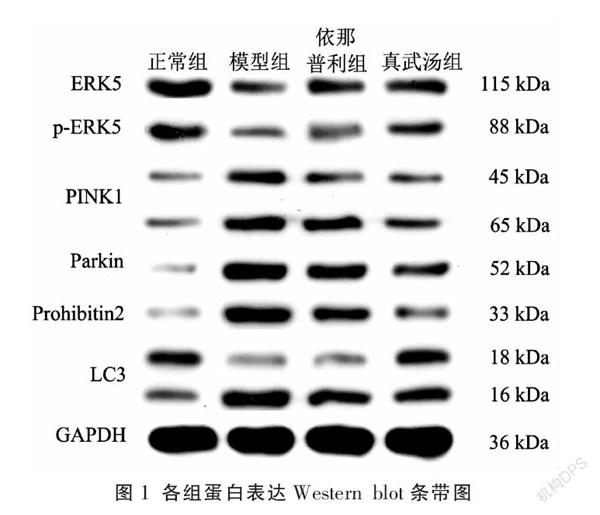
〔摘要〕 目的 探討真武汤对慢性心力衰竭(chronic heart failure, CHF)大鼠心肌细胞细胞外信号调节激酶5(extracellular signal regulated kinase 5, ERK5)蛋白及线粒体自噬关键蛋白(PINK1、Parkin、Prohibitin2、LC3-Ⅱ/LC3-Ⅰ)的影响。方法 SPF级SD大鼠52只,随机抽取13只为正常对照组,剩余39只注射阿霉素(1.5 mg/mL溶液,2.0 mL/kg体质量)6周造模。在首次注射阿霉素20 天后,对造模大鼠进行心脏彩超检查,以评估造模的均衡性。按左室射血分数将造模大鼠进行分层,并按随机区组设计分为模型组、依那普利组和真武汤组,每组13只。药物干预4周后,采用Western blot法检测各组大鼠心肌细胞ERK5、p-ERK5蛋白及线粒体自噬关键蛋白(PINK1、Parkin、Prohibitin2、LC3-Ⅱ/LC3-Ⅰ)表达水平。结果 造模6周后,模型组ERK5蛋白表达水平明显低于正常对照组,线粒体自噬关键蛋白(PINK1、Parkin、Prohibitin2、LC3-Ⅱ/LC3-Ⅰ)表达水平明显高于正常对照组(P<0.05);各治疗组经药物干预4周后,线粒体自噬关键蛋白(PINK1、Parkin、Prohibitin2、LC3-Ⅱ/LC3-Ⅰ)表达水平较模型组均有下降趋势,ERK5蛋白表达水平较模型组均有上升趋势(P<0.05),其中真武汤组与依那普利组比较,差异无统计学意义(P>0.05)。结论 真武汤可能通过上调心肌细胞p-ERK5表达水平,同时下调线粒体自噬关键蛋白的表达水平,从而发挥治疗CHF作用。
〔关键词〕 慢性心力衰竭;真武汤;细胞外信号调节激酶5;线粒体自噬;心肌细胞
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.12.005
Effects of Zhenwu Decoction on ERK5 and Key Proteins of Mitochondrial
Autophagy in Rats with Chronic Heart Failure
BIE Mingke1, ZENG Zhaowen2, CHEN Xinyu3*
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The Second Affiliated Hospital of Integrated Traditional Chinese and Western Medicine of Hunan University of Chinese Medicine, Changsha, Hunan 410300, China;
3. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China)
〔Abstract〕 Objective To investigate the effects of Zhenwu Decoction on extracellular signal regulated kinase 5 (ERK5) and key proteins of mitochondrial autophagy (PINK1, Parkin, Prohibitin2, LC3-Ⅱ/LC3-Ⅰ) in myocardial cells of rats with chronic heart failure (CHF). Methods A total of 52 SPF degree SD rats were enrolled into the study, 13 rats were randomly selected as normal control group, and the remaining 39 rats were injected with doxorubicin (1.5 mg/mL solution, 2.0 mL/kg body mass) for 6 weeks for modeling. The model rats were subjected to a cardiac ultrasound examination in order to assess the equilibrium established in the animal model on the 20th day after the first doxorubicin injection. Model rats were underwent CHF model stratification according to left ventricular ejection fraction, and then were divided into 3 groups (model group, enalapril group and Zhenwu Decoction group) using a random block design, with 13 rats in each group. After treated with drugs for 4 weeks, the expression levels of ERK5, p-ERK5 and key proteins of mitochondrial autophagy (PINK1, Parkin, Prohibitin2, LC3-Ⅱ/LC3-Ⅰ) in cardiac myocytes of rats in each group were detected by Western blot. Results After 6 weeks of modeling, the expression of ERK5 in the myocardial cells of the model group was significantly lower than that of the normal control group, while the expression levels of key proteins of mitochondrial autophagy (PINK1, Parkin, Prohibitin2, LC3-Ⅱ/LC3-Ⅰ) were significantly higher than that of the normal control group (P<0.05); after 4 weeks of drug intervention in each treatment group, the expression of key proteins of mitochondrial autophagy (PINK1, Parkin, Prohibitin2, LC3-Ⅱ/LC3-Ⅰ) had a downward trend compared with the model group, and the expression of ERK5 protein had an upward trend compared with the model group (P<0.05). There was no significant difference between the naplepril group and Zhenwu Decoction group (P>0.05). Conclusion Zhenwu Decoction may exert therapeutic effects on CHF by upregulating the expression level of p-ERK5 and downregulating the expression levels of key proteins of mitochondrial autophagy in cardiomyocytes.
〔Keywords〕 chronic heart failure; Zhenwu Decoction; extracellular signal regulated kinase 5; mitochondrial autophagy; cardiomyocytes
慢性心力衰竭(chronic heart failure, CHF)是各种心血管疾病的终末期表现和最主要的死亡原因[1]。随着老龄化进程的加速,CHF患病率显著升高[2]。研究[3]发现,心肌细胞线粒体自噬失衡而引起的心肌细胞死亡是CHF过程中的重要机制。正常范围的线粒体自噬能够及时清除受损的线粒体,对心肌细胞具有保护作用;病理状态下,心肌细胞线粒体自噬失衡,自噬小体过度激活,可直接诱导心肌细胞死亡,加重CHF病情[4]。
中医药在CHF的干预上具有独特优势,中医药不仅能够缓解临床症状、降低药物不良反应,同时能够降低CHF患者各项生化指标、减轻心肌细胞坏死程度、改善心肌重构,整体提高生存质量[5]。真武汤出自东汉张仲景《伤寒论》,具有温阳利水之功效。2014年中医诊疗专家共识[6]针对CHF的中医治疗将真武汤作为推荐方之一。
课题组前期研究[7]显示,MAPK/ERK5通路在CHF的进展过程中起到心肌保护作用。真武汤可通过拮抗肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS)而降低CHF大鼠血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)水平,而AngⅡ可下调p-ERK5的表达。心肌细胞线粒体自噬与CHF密切相关,ERK5与线粒体自噬均可被氧化应激、细胞毒性、缺血缺氧等外界刺激同时激活[8-9]。目前,关于真武汤治疗CHF的研究,多为临床研究或网络药理学方面,实验研究机制较为单一,真武汤对心肌细胞线粒体自噬蛋白的调控有待进一步研究。据此,本实验通过构建CHF大鼠模型,探讨真武汤对CHF大鼠ERK5及线粒体自噬关键蛋白的影响。
1 材料
1.1 实验动物
SPF级健康6周龄雄性SD大鼠52只(由湖南斯莱克景达实验动物有限公司提供,动物许可证批号:SCXK(湘)2016-0002),体质量(200±20) g。在自由饮食、光/暗周期为12 h/12 h(光照时间为6:00~18:00)、背景噪声为(40±10) db、温度(20±3) ℃条件下饲养1周以适应环境。本研究伦理审查由湖南中医药大学动物实验中心批准,饲养及实验地点为湖南中医药大学第一附属医院SPF级实验室。
1.2 主要药物与试剂
真武汤(湖南中医药大学第一附属医院新绿药)按照谢鸣主编的《方剂学》[10]教材的推荐剂量:炮附子9 g,白术6 g,白芍9 g,茯苓9 g,生姜9 g,用蒸馏水溶化而成。盐酸阿霉素(深圳万乐药业有限公司,批号:1703E1);马来酸依那普利片(扬子江药业集团江苏制药股份有限公司,批号:H32026567);PINK1抗体(批号:23274-1-AP)、Prohibitin2抗体(批号:12295-1-AP)、LC3抗体(批号:14600-1-AP)均购自美国Proteintech公司;Parkin抗体(批号:ab179812)、ERK5抗体(批号:ab40809)、p-ERK5抗体(批号:ab5686)均购自英国Abcam公司。
1.3 主要仪器
台式冷冻离心机(深圳黑马医学仪器有限公司,型号:TGL-18R);电泳仪(美国Bio-rad公司,型号:164-5050);转膜仪(型号:DYCZ-40A)、电泳槽(型号:DYCZ-24EN)均购自北京六一生物科技有限公司;电子天平(上海民桥精密科学仪器有限公司,型号:FA-N);精密pH计(中国雷磁分析仪器厂,型号:E-201-C);普通冰箱(中国荣事达电子电器集团,型号:BCD-245F);彩色多普勒超声诊断仪(美国西门子公司,型号:ACUSONSequoia 512);电磁炉(美的集团,型号:MC-EP186);切片机(金华市益迪医疗设备有限公司,型号:YD-202III);包埋机(常州市中威电子仪器有限公司,型号:BMJ-Ⅲ);旋涡混合器(海门市其林贝尔仪器制造有限公司,型号:QL-901);电动玻璃匀浆器(日本新芝公司,型号:DY89-1)。
2 方法
2.1 造模及分组
SPF级SD大鼠52只先饲养1周以适应环境,随机抽取13只作为正常组。1周后对除正常组以外的所有大鼠用阿霉素进行造模[11]。首先用生理盐水将阿霉素配制成1.5 mg/mL溶液,以2.0 mL/kg体质量进行腹腔注射,每周1次,连续注射6周,累积每只大鼠注射阿霉素总量18 mg/kg,每次造模前重新称重,作为该次用药剂量的计算标准。
为评估动物模型建立的均衡性[11],将余下39只大鼠在首次注射阿霉素后第20天(第3次注射阿霉素后第6天),进行心脏彩超检查。根据大鼠左室射血分数(left ventricular ejection fraction, LVEF)先进行分层,然后通过随机区组设计平均分為3组,每组13只,分别为模型组、依那普利组和真武汤组。
2.2 给药
自实验开始造模的第21天开始,除正常组外,所有大鼠继续用配置好的阿霉素溶液进行腹腔注射,每周1次,连续3周;同时真武汤组予以真武汤4.4 g/(kg·d),用水配成混悬液灌胃,给药剂量参考《药理实验方法学》[12],根据成人与大鼠体表面积进行换算(D成人=K·D大鼠),换算系数K为6.25。依那普利组予以马来酸依那普利片1.8 mg/(kg·d),用水配成混悬液灌胃,正常组和模型组均予以等量蒸馏水灌胃,每天2次,各组连续灌胃4周。
2.3 指标记录及检测
2.3.1 一般情况 给药后,每周测定大鼠体温、体质量,详细记录进食数量和饮水情况。
2.3.2 心脏彩超检查 所有实验大鼠在称重后依次分批麻醉,备皮,然后取平卧位固定于手术台上,将彩超探头置于胸骨左侧心尖部,并指向右上方心底部,找到左室长轴切面,然后用M型超声计算出LVEF及左室缩短分数(left ventricular fractional shortening, LVFS),连续测量5次,然后取平均值,所有测量由同一个操作者完成。
2.3.3 血清学指标检测 血清NT-proBNP表达的检测采用酶联免疫吸附测定法。取各组大鼠腹主动脉血,将采集的血静置10 min后以用离心机按转速3000 r/min离心15 min,离心半径6.75 cm,接着用移液枪吸取上层血清,置于EP管中,并进行标记、编号,放置于-20 ℃冰箱待检。检测具体操作按试剂盒标准说明进行。
2.3.4 蛋白表达水平检测 采用Western blot法检测,首先将100 μg样品总蛋白加入5×Loading buffer混匀,接着置于沸水中煮5 min,再置于冰盒中速冷,经蛋白变性后开始电泳。在电泳结束后设定转膜电流为300 mA。转膜完毕后,将膜取出放入1×TBST冲洗5 min。然后将膜浸入1×TBST配制5%脱脂奶粉中,室温封闭1.5 h。取出膜,置于一杂交袋中,分别加入ERK5抗体(稀释比例1∶10 000)、p-ERK5抗体(稀释比例1∶1000)、PINK1抗体(稀释比例1∶700)、Parkin抗体(稀释比例1∶2000)、Prohibitin2抗体(稀释比例1∶800)、LC3抗体(稀释比例1∶2000),GAPDH抗体(稀释比例1∶3000),4 ℃过夜。孵育结束,1×TBST洗3次,每次15 min。用1×TBST稀释HRP标记的二抗(稀释比例1∶6000),将稀释后的二抗与膜共同孵育90 min。孵育结束,1×TBST再次冲洗3次,每次15 min。ECL显色曝光、扫描、保存。运用Quantity one专业灰度分析软件,将各个目的蛋白与GAPDH的灰度值的比值进行统计分析。
2.3.5 组织形态学观察 取心脏左室面组织在光镜下观察其细胞形态,将固定后的心肌组织进行脱水、透明、包埋、切片、染色等程序,封片后于400倍光镜下观察染色效果并拍照。
2.4 统计学方法
所有数据结果采用SPSS 21.0统计软件进行分析,计量资料用“x±s”表示,多样本均数比较采用单因素方差分析检验,先用Levene检验方法对实验数据进行方差齐性检验,方差齐时,采用LSD法进行两两比较;方差不齐时,采用Tamhane’ T2法。以P<0.05为差异有统计学意义。
3 结果
3.1 各组一般情况观察
正常组:大鼠精神状态正常,对各种刺激反应灵敏,皮肤黏膜红润有光泽,全身毛发润泽,进食、二便正常,饲养过程中体质量逐渐增加。大鼠未出现死亡。
模型组:大鼠精神怠倦,对外界反应迟钝,皮肤黏膜苍白,毛发不荣,进食量明显减少,体质量前期较正常组增长缓慢,中期停止增长,后期有一定下降,有不同程度腹腔积液,少数严重腹腔积液,偶有大便不成形。大鼠实验过程中死亡3只,考虑阿霉素细胞毒性原因。
依那普利组和真武汤组:大鼠精神状态、刺激反应以及皮毛光泽度较正常组大鼠差,较模型组稍好,皮毛欠光泽,体质量增加减慢,多数大鼠有轻度腹腔积液。两组大鼠各死亡2只,对死亡大鼠进行解剖,未发现肺部液体残留,考虑阿霉素细胞毒性原因。
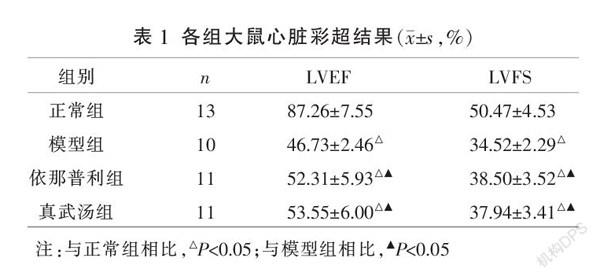
3.2 各组大鼠心脏彩超测量结果
与正常组相比,其余各组LVEF、LVFS均显著降低(P<0.05);与模型组比较,各治疗组LVEF、LVFS均显著升高(P<0.05);依那普利组与真武汤组比较,差异无统计学意义(P>0.05)。见表1。
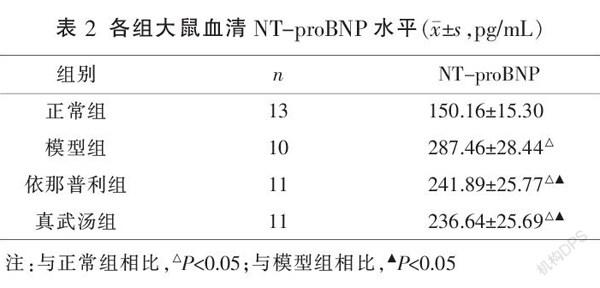
3.3 各组大鼠血清NT-proBNP水平比较
与正常组相比,其余各组血清NT-proBNP水平均有不同程度增高(P<0.05);与模型组比较,各治疗组血清NT-proBNP的水平均上升(P<0.05);依那普利组与真武汤组比较,差异无统计学意义(P>0.05)。见表2。
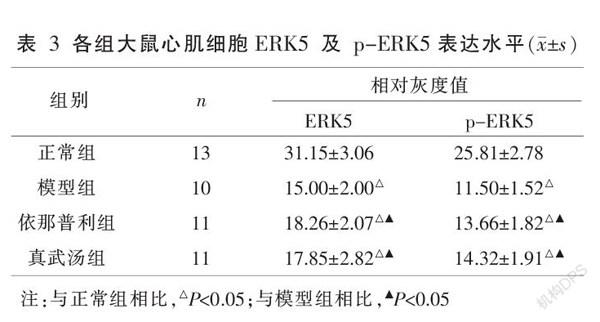
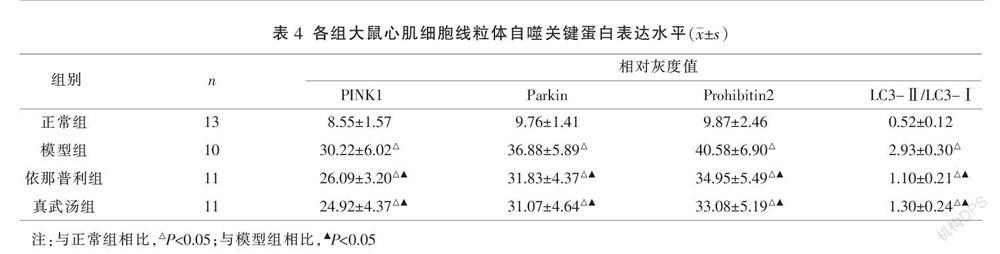
3.4 各组大鼠心肌细胞ERK5、p-ERK5及线粒体自噬关键蛋白表達水平比较
各造模组心肌细胞ERK5、p-ERK5表达水平明显低于正常组,而线粒体自噬关键蛋白表达水平明显高于正常组(P<0.05);各治疗组p-ERK5表达较模型组明显上升,而线粒体自噬关键蛋白表达水平较模型组显著下降,且差异具有统计学意义(P<0.05);真武汤组与依那普利组心肌细胞ERK5、p-ERK5及线粒体自噬关键蛋白表达水平比较,差异无统计学意义(P>0.05)。见表3-4、图1。
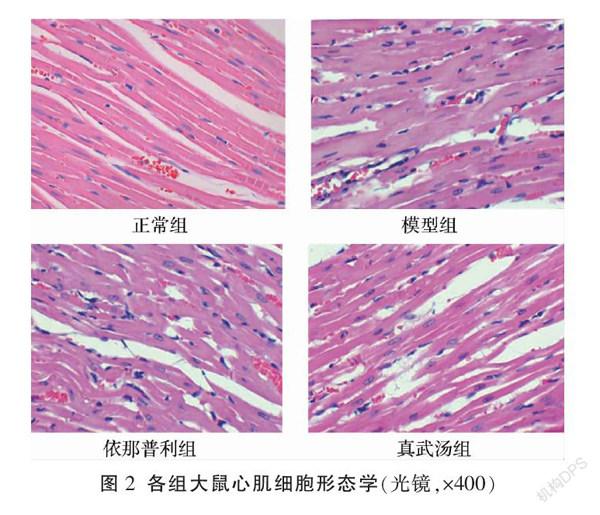
3.5 各组大鼠心肌细胞形态学变化
正常组大鼠心肌纤维排列整齐,横纹清晰,间质无充血、无炎细胞浸润;模型组大鼠心肌纤维排列紊乱,细胞水肿明显,横纹不清晰;依那普利组大鼠心肌纤维稍紊乱,细胞稍水肿,横纹欠清晰;真武汤组大鼠心肌纤维排列尚整齐,横纹欠清晰,细胞间隙增宽。见图 2。
4 讨论
CHF患者5年的病死率可达50%,10年病死率超过90%,作为一种复杂的临床症状群,严重危害全世界人民的生命健康[13-14]。线粒体自噬与CHF的发生发展息息相关,正常水平的线粒体自噬对心肌细胞具有保护作用,过度的线粒体自噬,可使线粒体消耗增加,导致心肌细胞脱落以及CHF的发生[15]。ERK5能维持正常心血管系统的内皮完整性,拮抗内皮细胞的凋亡,促进血管再生[16]。CHF病理状态下p-ERK5表达显著下调,同时伴随心肌细胞线粒体自噬明显增强,整体表现为心肌细胞过度丢失而使得CHF加重。临床观察[17]和基础实验[18]均已证明,在CHF发病过程中,过量活性氧的释放可激活炎性因子网络,进而影响p-ERK5表达,加重心肌损伤。ERK5与心肌细胞线粒体自噬均可被相同的外界刺激激活(主要为氧化应激和缺血缺氧)。
CHF在中医理论中可归属于“心悸”“喘证”“心水”范畴,以心悸、气喘、肢体水肿为主要表现。其根本病机为心气不足、心阳亏虚,以心气虚衰为本,水饮内停为标,患者多见素体阳虚,因外邪、情志、过劳而复伤心体,心气不足,无以行血,血不利而为水,水津循环不畅,停留周身[19]。真武汤出自《伤寒论》,是治疗阳虚水泛证的经典方。其组成为:制附子、白术、茯苓、生姜、白芍,共5味中药,秉承扶阳之要旨。其中,附子具有回阳救逆、补火助阳之功;茯苓淡渗利湿、健脾宁心;白术温补中焦以绝水之源;生姜走而不守,与附子相伍加强温阳散寒之力,又助茯苓、白术以温散水气;芍药味酸收敛,制约诸药之刚燥。全方共奏温阳利水之功,使阳复阴化,切中病机。
在中医药临床实践中,真武汤被广泛用于治疗CHF[20-21]。然而CHF发病机制复杂,目前已发现其受到氧化应激、心血管炎症、血管内皮损伤、RAAS激活、心室重塑、遗传因素等多种机制的共同作用,中药具有多靶点、多途径的特点,真武汤治疗CHF的作用机制有待进一步研究。前期研究[22]中,课题组发现温阳振衰颗粒可通过调控线粒体自噬对CHF具有治疗作用。基于此,对同样具有温阳化气作用的真武汤治疗CHF的作用机制进行探讨。
实验后,各模型组大鼠 LVEF、LVFS 值明显降低,血清NT-proBNP水平明显升高,提示心衰模型复制成功。CHF模型大鼠经真武汤干预后,LVEF、
LVFS显著升高,血清NT-proBNP水平明显下降,验证了真武汤对CHF具有治疗作用。与正常组比较,经阿霉素诱导的CHF模型大鼠心肌细胞p-ERK5表达水平显著下降,而线粒体自噬关键蛋白表达水平均显著升高(P<0.05)。与模型组比较,经过连续4周的药物干预,p-ERK5表达水平有了显著上升,而线粒体自噬关键蛋白表达水平明显下降(P<0.05)。
综上所述,真武汤能够提高p-ERK5表达水平,调控心肌细胞线粒体自噬的程度。通过上调ERK5表达,进而抑制线粒体自噬水平,可能是真武汤治疗CHF的重要机制之一。
参考文献
[1] 葛均波,徐永健,王 辰.内科学[M].9版.北京:人民卫生出版社,2018:166-174.
[2] 陈伟伟,高润霖,刘力生,等.《中国心血管病报告2017》概要[J].中国循环杂志,2018,33(1):1-8.
[3] MOE G W, MARíN-GARCíA J. Role of cell death in the progression of heart failure[J]. Heart Failure Reviews, 2016, 21(2): 157-167.
[4] LAI L, CHEN J Z, WANG N F, et al. MiRNA-30e mediated cardioprotection of ACE2 in rats with Doxorubicin-induced heart failure through inhibiting cardiomyocytes autophagy[J]. Life Sciences, 2017, 169: 69-75.
[5] 邓 鹏,胡 丹,刘中勇,等.慢性心力衰竭的中医药治疗研究进展[J].江西中医药大学学报,2017,29(1):121-124.
[6] 毛静远,朱明军.慢性心力衰竭中医诊疗专家共识[J].中医杂志,2014,55(14):1258-1260.
[7] CHEN X Y, CAI H Z, CHEN Q Y, et al. Effects of Wenyangzhenshuai Granule on ERK1/2 and ERK5 activity in the myocardial tissue in a rabbit model of adriamycin-induced chronic heart failure[J]. International Journal of Clinical and Experimental Medicine, 2015, 8(11): 20732-20741.
[8] 刘 聪,李文杰,谢 静.真武汤对心力衰竭大鼠血清AngⅡ及ALD的影响[J].中华中医药学刊,2015,33(6):1374-1376.
[9] GENG J, ZHAO Z, KANG W Q, et al. Hypertrophic response to angiotensin II is mediated by protein kinase D-extracellular signal-regulated kinase 5 pathway in human aortic smooth muscle cells[J]. Biochemical and Biophysical Research Communications, 2009, 388(3): 517-522.
[10] 謝 鸣.方剂学[M].3版.北京:人民卫生出版社,2016:303.
[11] 蔡虎志,王笑莹,陈青扬,等.温阳振衰颗粒对慢性心衰模型大鼠心肌CREB表达的影响[J].中成药,2018,40(4):943-946.
[12] 徐叔云.药理实验方法学[M].3版.北京:人民卫生出版社,2002,826-827.
[13] 王 翔,易省阳.慢性心力衰竭诊断及治疗新进展[J].中华实用诊断与治疗杂志,2015,29(1):10-12.
[14] PITT B, PFEFFER M A, ASSMANN S F, et al. Spironolactone for heart failure with preserved ejection fraction[J]. The New England Journal of Medicine, 2014, 370(15): 1383-1392.
[15] DORN G W II. Parkin-dependent mitophagy in the heart[J]. Journal of Molecular and Cellular Cardiology, 2016, 95: 42-49.
[16] HAYASHI M, KIM S W, IMANAKA-YOSHIDA K, et al. Targeted deletion of BMK1/ERK5 in adult mice perturbs vascular integrity and leads to endothelial failure[J]. The Journal of Clinical Investigation, 2004, 113(8): 1138-1148.
[17] 王 洲.慢性心衰患者血漿ERK5/CREB蛋白表达水平与心功能分级的相关性研究[D].衡阳:南华大学,2018.
[18] WANG G P, TANG C L, YAN G J, et al. Gene expression profiling of H9c2 cells subjected to H2O2-induced apoptosis with/without AF-HF001[J]. Biological & Pharmaceutical Bulletin, 2016, 39(2): 207-214.
[19] 张伯礼,吴勉华.中医内科学[M].北京:中国中医药出版社,2017:100-102.
[20] 李 琳,李欣春,胡志希,等.袁肇凯教授运用温肾强心法辨治慢性心力衰竭经验[J].湖南中医药大学学报,2019,39(7):860-862.
[21] 刘莉兰.真武汤加减方治疗慢性心力衰竭35例临床观察[J].湖南中医药大学学报,2010,30(3):70-72.
[22] 陈 广,吴晓霞,蔡虎志,等.温阳振衰颗粒对慢性心衰大鼠模型心肌细胞线粒体自噬关键蛋白的影响[J].时珍国医国药,2019,30(1):16-18.
〔收稿日期〕2021-03-05
〔基金项目〕国家自然科学基金项目(81173213);湖南省重点领域研发计划项目(2019SK2321);湖南省高等学校“双一流”建设项目;湖南中医药大学校级科研基金项目(ZYYDX201725)。
〔作者简介〕别明珂,男,在读博士研究生,研究方向:中医药防治心脑血管疾病研究。
〔通信作者〕*陈新宇,男,教授,主任医师,博士研究生导师,E-mail:chenxinyuchen@163.com。
