莪术二酮通过VEGF/VEGFR2信号通路对肝癌HepG2细胞微环境下HHSEC增殖的影响
2021-12-23曹如柔周坚王其美章茜王容容陈茂
曹如柔 周坚 王其美 章茜 王容容 陈茂



〔摘要〕 目的 探讨莪术二酮对肝癌HepG2细胞微环境下的人肝窦内皮细胞(human hepatic sinusoidal endothelial cells, HHSEC)增殖的抑制作用,并阐明其可能机制。方法 CCK-8法检测不同浓度(0.5%、1%、2%、4%、8%)的HepG2细胞上清液处理HHSEC后的细胞增殖率;HHSEC分为空白组、阳性对照组及莪术二酮低、中、高剂量组,分别予以M199培养基、含1 μg/L顺铂注射液的M199培养基、0.5、1、2 μg/L浓度的莪术二酮工作液培养。应用RT-PCR法和Western blot法检测不同浓度莪术二酮干预后HHSEC内的VEGF、VEGFR2 mRNA及蛋白表达情况。结果 2%、4%及8%的HepG2细胞上清液可促进HHSEC的增殖(P<0.05);在4% HepG2细胞上清液作用下,0.5、1、2 μg/L莪术二酮均可抑制HepG2细胞上清液对HHSEC的增殖作用(P<0.05),随着浓度的增加,HHSEC增殖率降低明显,不同浓度组间差异均有统计学意义(P<0.05)。在HepG2细胞微环境下,与空白组相比,莪术二酮高剂量组HHSEC中VEGF mRNA和蛋白表达明顯降低(P<0.01),莪术二酮中、高剂量组VEGFR2 mRNA和蛋白的表达均明显降低(P<0.01)。结论 莪术二酮对HepG2细胞微环境下的HHSEC具有抗增殖活性,其作用机制可能与抑制HepG2细胞微环境下HHSEC中VEGF和VEGFR2的表达有关。
〔关键词〕 肝癌;莪术二酮;VEGF/VEGFR2;HepG2细胞;人肝窦内皮细胞
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.12.004
The Effect of the Curdione on the Proliferation of HHSEC Under the Microenvironment of
HepG2 Cells via VEGF/VEGFR2 Signaling Pathway
CAO Rurou1, ZHOU Jian2*, WANG Qimei2, ZHANG Xi2, WANG Rongrong2, CHEN Mao2
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Department of Oncology,
The Affiliated Hospital of Hunan Academy of Chinese Medicine, Changsha, Hunan 410006, China)
〔Abstract〕 Objective To explore the inhibitory effect of curdione on the proliferation of human hepatic sinusoidal endothelial cells (HHSEC) in the microenvironment of liver cancer HepG2 cells, and to clarify its possible mechanism. Methods CCK-8 method was used to detect the cell proliferation rate of HepG2 cells supernatants of different concentrations (0.5%, 1%, 2%, 4%, 8%) after HHSEC treatment; HHSEC was divided into blank group, positive control group and curdione low, medium, and high-dose groups, and were cultured with M199 medium, M199 medium containing 1 μg/L cisplatin injection, and working solution of curdione at 0.5, 1, and 2 μg/L. RT-PCR and Western blot were used to detect the expression of VEGF and VEGFR2 mRNA and protein in HHSEC after the intervention of different concentrations of curdione. Results 2%, 4% and 8% of HepG2 cells supernatants can promote the proliferation of HHSEC (P<0.05); under the action of 4% HepG2 cells supernatants, 0.5, 1, 2 μg/L curdione can inhibit the proliferation effect of HepG2 cells supernatant on HHSEC (P<0.05). With the increase of concentration, the proliferation rate of HHSEC decreased significantly, and the differences between groups of different concentrations were statistically significant (P<0.05). In the microenvironment of HepG2 cells, compared with the blank group, the expression of VEGF mRNA and protein in HHSEC of the curdione high-dose group was significantly reduced (P<0.01), and the expression of VEGFR2 mRNA and protein in curdione middle and high-dose group were both decreased (P<0.01). Conclusion Curdione has anti-proliferative activity on HHSEC in HepG2 cells microenvironment, and its mechanism of action may be related to inhibiting the expression of VEGF and VEGFR2 in HHSEC in HepG2 cells microenvironment.
〔Keywords〕 hepatic carcinoma; curdione; VEGF/VEGFR2; HepG2 cells; human hepatic sinusoidal endothelial cells
原发性肝癌是一种常见的恶性消化道肿瘤,我国每年约有40万以上的原发性肝癌患者,占世界肝癌总人数的一半以上[1-2]。莪术二酮作为莪术中含量最高的倍半萜类物质,其药理作用广泛,具有抗血小板聚集、减轻化疗不良反应等活性,还能降低人乳腺癌HCC1937细胞的迁移和侵袭能力[3-5],但其抗癌机制尚未明确。血管内皮生长因子(vascular endothelial growth factor, VEGF)是促进血管生成的调节因子[6],其高表达对诱导肿瘤血管生成,加速肝癌的发生、增殖、转移起重要作用[7-8]。VEGF基因沉默可抑制肝癌细胞HepG2的迁移和侵袭的能力[9],提示了肿瘤微血管生成对肝细胞癌发生和发展的重要意義。故课题组推测莪术二酮抑制肝癌细胞生长的作用可能也与抑制肿瘤微血管生成有关,因此,本研究主要就莪术二酮干预肝癌细胞促进人肝窦内皮细胞(human hepatic sinusoidal endothelial cells, HHSEC)增殖的机制进行初步探讨。
1 材料
1.1 细胞株
人肝癌细胞株HepG2由湖南中医药大学中西医结合心脑疾病防治实验室赠予;HHSEC购自北京裕恒丰科技有限公司。
1.2 药物、试剂与仪器
莪术二酮(上海雅吉生物科技有限公司,批号:13657-68-6,纯度>98%);DMEM培养基(批号:AF29494674)、青链霉素(批号:J200029)、胰酶(批号:25200072)、胎牛血清(批号:SAG-01U-02)、M199培养基(批号:11875093)、BCA蛋白测定试剂盒(批号:SF249041)均购自美国Thermo Fisher公司;RT-PCR试剂盒(美国ABI公司,批号:A1A1169)。
SW-CJ-2F型垂直超净工作台(中国苏州安泰空气技术有限公司);HERAcell 240i型CO2培养箱(美国Thermo Fisher公司);EIX808U型全自动酶标仪(美国BioTek公司);powerpac型电泳仪、Mini Trans-Blot C型转膜仪(美国Bio-Rad公司);G:BOX Chemi XRQ型化学发光成像系统(美国Syngene公司)。
2 方法
2.1 细胞培养
人肝癌细胞株HepG2采用10%胎牛血清、100 IU/mL青霉素和 100 g/L链霉素的高糖DMEM培养基置于37 ℃、5% CO2培养箱中培养,隔天传代1次。
HHSEC采用5%胎牛血清、1%内皮细胞生长因子的M199培养基置于37 ℃、5% CO2的培养箱中培养,隔天换液1次,3天传代1次。
2.2 药物处理
将汇合度达95%以上的HepG2细胞培养基吸出,通过截留分子量为5000 Da的超滤管3000 r/min,离心半径5 cm,离心15 min,浓缩回收细胞上清液,每10 mL上清液浓缩成100 μL,用M199培养基稀释配制成含0.5%、1%、2%、4%、8% HepG2细胞上清液的M199工作液培养基。以10 mL M199培养基浓缩成100 μL作为空白组工作液,用不同浓度M199工作液培养基培养HHSEC,选取最佳浓度。将莪术二酮单体溶于DMSO,配制成1 μg/mL的母液,无菌微孔滤膜过滤,-20 ℃保存。实验时用2%的M199工作液培养基稀释成0.5、1、2 μg/L浓度的药液。
2.3 CCK-8检测莪术二酮对HHSEC增殖的影响
取对数生长期的HHSEC,制成单细胞悬液,均匀接种于96孔板,每孔1×104个细胞,于37 ℃、5% CO2培养箱中培养6 h后,弃旧培养基,HHSEC分为空白组、阳性对照组及莪术二酮低、中、高剂量组,每孔分别加入100 μL M199培养基、含1 μg/L顺铂注射液的M199培养基、0.5、1、2 μg/L浓度的莪术二酮工作液,每组设置5个复孔,置于37 ℃、5% CO2培养箱中培养24 h。按说明书每孔加入10 μL CCK-8试剂,37 ℃孵育2 h,用酶标仪测定450 nm波长处吸光度。
2.4 建立非接触式细胞共培养模型
参照非接触式体外血脑屏障模型[10],建立HepG2-HHSEC共培养模型。运用transwell 3412细胞培养池,在上孔中接种2.5×105个HepG2细胞,下孔中接种1×105个HHSEC,37 ℃、5% CO2培养箱中共培养24 h,进行后续实验。
2.5 RT-PCR法检测莪术二酮对HHSEC中VEGF、VEGFR2 mRNA表达的影响
细胞分组及培养同“2.3”项,按试剂盒说明书分别提取transwell 3412细胞培养池下孔中HHSEC总RNA、逆转录cDNA,RT-PCR分别检测VEGF、VEGFR2 mRNA的相对表达量。引物序列由华大基因公司合成,VEGF引物为:正向引物5'-GTGGACATCCGCAAAGAC-3',反向引物5'-AAAGGGTGTAACGCAACTAA-3';VEGFR2引物为:正向引物 5'-AAGAGATTTGT⁃TCCGGATGG-3',反向引物5'-CGGCAGATAGCT⁃
CAATTTCA-3'。
2.6 Western blot法检测莪术二酮对HHSEC中VEGF、VEGFR2蛋白表达的影响
细胞分组及培养同“2.3”项,按试剂盒说明书提取transwell 3412细胞培养池下孔中HHSEC的总蛋白,BCA法检测蛋白浓度。Western blot进行蛋白电泳、转膜及成像,经凝胶成像分析系统分析结果。
2.7 统计学分析
所有数据使用SPSS 18.0分析,结果以“x±s”表示,数据符合正态分布及方差齐性时,多组均数间比较采用单因素方差分析,组间两两比较采用LSD方法。数据不满足正态性时,使用非参数检验进行分析。P<0.05表示差异有统计学意义。
3 结果
3.1 HepG2细胞对HHSEC增殖的影响
在相同培养条件下,与0% HepG2相比,2%~8%的HepG2细胞上清液促进了HHSEC的增殖(P<0.05)。与2% HepG2细胞上清液相比,4%、8% HepG2细胞上清液均明显促进HHSEC的增殖(P<0.05)。选取4% HepG2细胞上清液加入M199培养基以促进HHSEC增殖。见图1。
3.2 莪术二酮对HepG2细胞微环境下的HHSEC增殖的影响
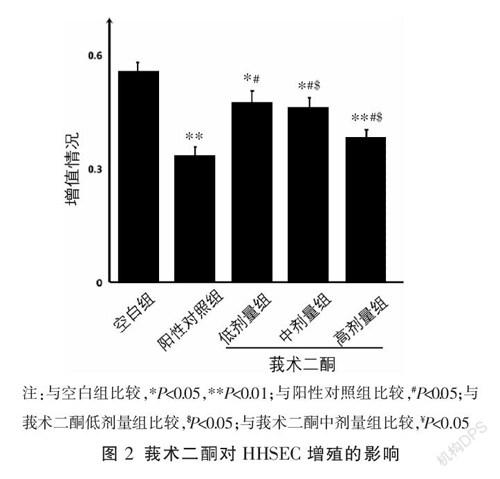
在相同的作用条件下,与空白组相比,阳性对照组及莪术二酮低、中、高剂量组均可抑制HHSEC的增殖(P<0.05);随着莪术二酮浓度的增加,HHSEC抑制率增加,不同浓度组间差异均有统计学意义(P<0.05)。与阳性对照组比较,莪术二酮低、中剂量组HHSEC抑制率升高(P<0.05),莪术二酮高剂量组抑制率差异无统计学意义(P>0.05)。见图2。
3.3 莪术二酮对HepG2细胞微环境下HHSEC中VEGF、VEGFR2 mRNA及蛋白表达的影响
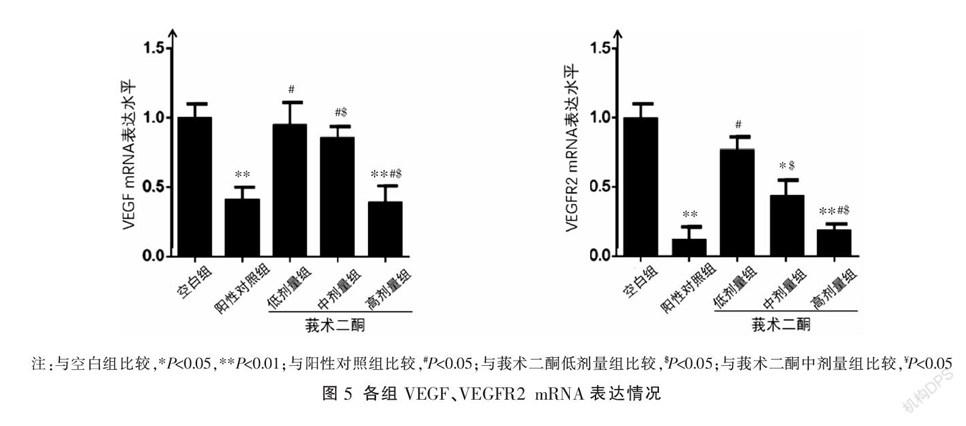
在HepG2细胞微环境下,与空白组比较,阳性对照组、莪术二酮高剂量组的HHSEC中VEGF、VEGFR2 mRNA和蛋白表达明显降低(P<0.01),莪术二酮中剂量组中VEGFR2 mRNA和蛋白表达降低(P<0.05),莪术二酮低剂量组中VEGF、VEGFR2 mRNA和蛋白表达轻度降低,差异无统计学意义(P>0.05);与阳性对照组比较,莪术二酮低、中剂量组VEGF mRNA及蛋白表达、莪术二酮低剂量组VEGFR2 mRNA及蛋白表达、莪术二酮中剂量组VEGFR2蛋白表达升高(P<0.05),莪术二酮高剂量组VEGF、VEGFR2 mRNA及VEGF蛋白表达降低差异无统计学意义(P>0.05),莪术二酮高剂量组VEGFR2蛋白表达升高(P<0.05)。随着莪术二酮浓度的增加,HHSEC中VEGF、VEGFR2 mRNA和蛋白表达均明显降低,除莪术二酮低剂量组与中剂量组VEGF蛋白表达比较无差异外,其余组间差异均有统计学意义(P<0.05)。见图3-5。
4 讨论
肝癌作为世界第四大恶性肿瘤,肝内血管丰富,新生血管形成能促进瘤体的生长,从而导致肿瘤组织增生及转移,引起疾病恶化[11]。目前,针对肝癌的治疗主要是通过外科或局部放化疗,损伤肿瘤组织的同时也严重影响了自身细胞,中药作为中医学的瑰宝,其在肝癌的防治中发挥着十分重要的作用,研究[12]表明,臭牡丹提取物可能通过提高Bax/Bcl-2蛋白表达水平而促进肝癌细胞凋亡。
中藥莪术味辛、苦,性温,归肝、脾经,具有破血行气、消积止痛、活血化瘀等功效。多应用于癥瘕痞块、瘀血经闭、胸痹心痛、食积气滞等病症。其药用活性成分主要为挥发油类成分、姜黄素类及多糖,具有抗肿瘤、抗炎镇痛、抗血小板聚集、抗血栓等作用[13],用于肿瘤的治疗疗效确切。莪术二酮作为其含量最高的倍半萜类物质,研究[14-15]表明其对肝癌HepG2细胞的增殖、凋亡有显著影响,而其是否引起肿瘤组织微环境的改变,降低血管生成目前并不明确。本研究探讨莪术二酮对HepG2肝癌细胞干预下HHSEC增殖作用的影响,试图阐明其对肝癌细胞微环境中血管新生的影响及其可能的作用机制。
本研究首先证实2%~8%的肝癌HepG2细胞的上清浓缩液均可促进HHSEC增殖,提示肝癌细胞可生成促进内皮细胞增殖的物质,该物质可能起到促进肝内血管生成的作用,而0.5、1、2 μg/L的莪术二酮明显抑制了该增殖效应,药物浓度越高,抑制效应越明显,呈正相关趋势。
VEGF是生理和病理情况下血管生成的主要调节者,VEGF与其受体VEGFR2的相互作用在肝癌微血管新生过程中均扮演着重要角色,是机体中最重要且最直接的促血管生成通路。通过复杂的信息传导通路直接促进肿瘤新生血管的生成,为肿瘤组织增殖、转移提供适合的微环境[16-20]。本研究结果显示莪术二酮抑制了HHSEC自身对VEGF的合成并降低了HHSEC中VEGFR2的表达,莪术二酮浓度越高,抑制作用越明显,并且莪术二酮高剂量组的抑制作用接近于顺铂,提示莪术二酮对HHSEC具有直接抑制作用,降低了肝癌微环境下HHSEC的增殖。
综上所述,莪术二酮对HepG2细胞微环境下的HHSEC具有抗增殖活性,其作用机制可能是直接抑制了HHSEC中VEGF和VEGFR2的表达。此外,该体外实验不仅为莪术二酮用于肝癌治疗提供了实验基础,同时也为肝癌临床药物研究提供了新的方向。
参考文献
[1] WALLACE M C, PREEN D, JEFFREY G P, et al. The evolving epidemiology of hepatocellular carcinoma: A global perspective[J]. Expert Review of Gastroenterology & Hepatology, 2015, 9(6): 765-779.
[2] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2018, 68(6): 394-424.
[3] FANG H, GAO B B, ZHAO Y L, et al. Curdione inhibits thrombin-induced platelet aggregation via regulating the AMP-activated protein kinase-vinculin/talin-integrin αIIbβ3 sign pathway[J]. Phytomedicine, 2019, 61: 152859.
[4] WU Z M, ZAI W J, CHEN W, et al. Curdione ameliorated doxorubicin-induced cardiotoxicity through suppressing oxidative stress and activating Nrf2/HO-1 pathway[J]. Journal of Cardiovascular Pharmacology, 2019, 74(2): 118-127.
[5] 孙学然,郑 岚.莪术二酮对乳腺癌HCC1937细胞迁移和侵袭的影响及机制[C]//第十七届全国中西医结合肿瘤学术大会论文集,上海,2019:125.
[6] 张大红,朱卫国,岳 顺.血管内皮生长因子在原发性肝癌组织中的表达及临床意义[J].细胞与分子免疫学杂志,2011,27(2):199-200,202.
[7] CHOI S H, CHUNG A R, KANG W, et al. Silencing of hypoxia-inducible factor-1β induces anti-tumor effects in hepatoma cell lines under tumor hypoxia[J]. PLoS One, 2014, 9(7): e103304.
[8] ASADA N, TANAKA Y, HAYASHIDO Y, et al. Expression of fibroblast growth factor receptor genes in human hepatoma-derived cell lines[J]. In Vitro Cellular & Developmental Biology Animal, 2003, 39(7): 321-328.
[9] 宋向芹,司秀文,张 芳,等.VEGF基因沉默对肝癌HepG2细胞侵袭和迁移的影响[J].山东医药,2012,52(46):42-43.
[10] 张乐裕,刘晨阳,于顾然.黄芪甲苷对Aβ1-42诱导的体外血脑屏障模型损伤的影响及机制探究[J].中草药,2018,49(17):4099-4105.
[11] 石鑫林,王继洲,姜洪池,等.影响肝癌患者肝移植术后复发的血管因素研究进展[J].器官移植,2019,10(6):727-730.
[12] 胡 琦,蒋佳红,李 游,等.臭牡丹含药血清对人肝癌MHCC97-H细胞周期和凋亡的影響[J].湖南中医药大学学报,2019,39(12): 1444-1448.
[13] 陈晓军,韦 洁,苏 华,等.莪术药理作用的研究新进展[J].药学研究,2018,37(11):664-668,682.
[14] LI J, BIAN W H, WAN J, et al. Curdione inhibits proliferation of MCF-7 cells by inducing apoptosis[J]. Asian Pacific Journal of Cancer Prevention, 2014, 15(22): 9997-10001.
[15] KONG Q, SUN F Y, CHEN X P. Impact of fixed-dose combination of germacrone, curdione, and furanodiene on breast cancer cell proliferation[J]. Cell Journal, 2013, 15(2): 160-165.
[16] 孙 晓,夏 蕾,何流漾,等.中性粒细胞在肿瘤免疫中的研究进展[J].中国免疫学杂志,2018,34(4):609-612.
[17] 张 琳,高 勇.复方红豆杉胶囊对Walker-256移植性肝癌大鼠HIF-1α、VEGF及PCNA表达的影响[J].陕西中医,2019,40(2):148-151,155.
[18] 陈兰羽,马继征,刘咏梅,等.基于HIF-1α介导的VEGF mRNA表达探讨膈下逐瘀汤抗肝纤维化血管新生的机制[J].中草药,2019,
50(2):449-456.
[19] 张雅莉,刁云云,张春泽.雷公藤甲素对人子宫颈微血管内皮细胞活性的抑制[J].中国肿瘤生物治疗杂志,2019,26(2):196-199.
[20] PEINADO H, ZHANG H, MATEI IR, et al. Pre-metastatic niches: organ-specific homes for metastases[J]. Nature Reviews Cancer, 2017, 17(5):302-317.
〔收稿日期〕2020-10-24
〔基金项目〕湖南省中医药研究院科研课题(201711)。
〔作者简介〕曹如柔,女,在读硕士研究生,研究方向:中西医结合防治恶性肿瘤。
〔通信作者〕*周 坚,男,副主任医师,硕士,E-mail:15973124870@163.com。
