瓦斯水合物密闭常温分解过程温度场分布特征*
2021-12-23陈文胜侯凤才刘传海王洪粱
陈文胜,侯凤才,吴 琼,刘传海,王洪粱
(1 黑龙江科技大学安全工程学院,黑龙江 哈尔滨 150022;2 黄河水利职业技术学院,河南 开封 475004)
煤矿瓦斯(煤层气)直接排空,会造成大气污染;但瓦斯中的甲烷气体是无污染、热值高的气体,故瓦斯经过提纯可以作为能源加以利用,也有利于保护环境节约能源,对国家能源的可持续发展具有重要意义。我国煤层气资源十分丰富,其中可开采量大约为10万亿m3,但大多分布在偏僻位置且地形复杂[1]。若采取常规的管道运输方式,经济成本较高且难以覆盖全面,导致储运比较困难。已有研究者文献[2-4]发现瓦斯可以在较为温和的温度-压力条件下形成固态形状的瓦斯水合物,且以水合物的形式对瓦斯进行储运,具有储气密度高、安全性高、储运条件温和、储运方式灵活、成本低等优势。因此,基于水合物储运技术进行瓦斯的储存与运输,是一种行之有效的办法[5]。在储运过程中,瓦斯水合物不易分解是安全储运的关键,因此,要研究瓦斯水合物分解规律。瓦斯水合物分解需要吸收热量,而温度是热的代表物理量,因此有必要研究瓦斯水合物分解过程中的温度分布特征。目前,国内外学者对水合物的分解规律进行了研究。文献[6-9]进行了降压模式的水合物分解试验,表明系统压力促进了水合物的分解;文献[10-12]研究了冰点以下甲烷水合物的分解规律,得出甲烷水合物自我保护效应的最佳温度。文献[13-14]对甲烷水合物的热稳定性进行了实验研究,得出甲烷水合物储存的合适温度。文献[15-17]以传热学角度分析了水合物的分解过程,讲述了气体水合物分解过程的热量传递机理研究进展,计算了水合物分解的分解热,明确了促进剂对水合物分解热的影响。
目前气体水合物的储存条件一般可分为高压常温和常压低温,国内外众多学者对常压低温储存即冰点以下气体水合物的分解研究较多,得出了许多有关分解速率等相关研究成果;而对高压常温储存即冰点以上气体水合物的分解研究较少,而水合物储运时虽然储存在容器类,但是用于储存水合物的容器是在常温环境中,常温环境势必会通过容器壁进行热量传递,进而影响水合物的储运,本研究对此进行了相关实验研究。本文利用装配多层位立体分布温度传感器的瓦斯水合物分解实验装置,探究冰点以上甲烷水合物的分解规律及分解过程的温度分布特征。
1 实验
1.1 实验系统
用于本实验的瓦斯水合实验装置主要包括水合反应器、恒温控制箱、气体压缩循环系统、数据采集系统等,如图1所示。该装置的核心设备是高压可视水合反应器,其配备了针对水合过程温度场的多层位径向温度传感器,沿水合反应器轴向分布三组,把高压可视水合反应器分成3层,每层布置5只高精度温度传感器,形成3行×5列的立体阵列分布,依次对其进行标号:下层为1~5号;中层为6~10号;上层为11~15号(如图2所示),可满足本次研究拟进行的温度场分布测定的目标。
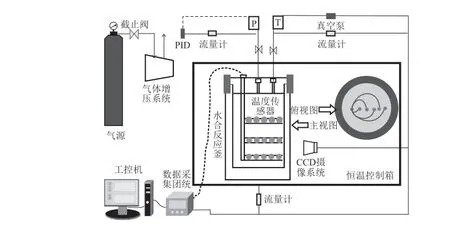
图1 瓦斯水合物分解实验装置Fig.1 Experiment of gas hydrate dissociation

图2 高压反应釜Fig.2 High-pressure cell
水合物的分解过程是热量交换的过程,所以实验体系的温度会随着水合物分解的进行而发生改变,因此利用本文实验装置配置的多层位温度传感器可以实时监测实验体系的温度场变化;同时利用压力传感器、高精度气体流量计及数据采集系统得到实验体系气相压力变化量,计算分解速率,进而对实验体系的温度场特征及分解速率进行比较,分析分解温度和促进剂的添加对甲烷水合物分解过程的影响。
1.2 实验步骤
利用该实验装置对SDS(0.5g/L)促进剂溶液体系体系I,THF(0.6mol/L)促进剂溶液体系Ⅱ进行甲烷水合物分解实验研究,实验所用气体为体积含量为99.99%的纯甲烷。反应的初始温度、压力条件分别为2℃、7MPa。具体步骤如下:
(1)用纯净水反复清洗反应釜并吹干;
(2)配置促进剂溶液,放入制冷系统使其冷却至2℃,然后注入反应釜内;
(3)打开温度、压力数据采集系统,监测釜内温度、压力;
(4)利用增压泵将实验气体压入反应釜内至7MPa;
(5)开始降温,将恒温箱温度调节到2℃;开始水合物合成;
(6)当反应体系温度计压力不再下降,水合物生成结束;
(7)将恒温箱温度调节至固定分解温度25℃,开始分解实验;
(8)当实验体系的温度及压力参数不再变化,分解结束。
2 实验结果及分析
2.1 实验结果
由实验装置配备的数据采集系统采集到的数据得到实验过程温度/压力-时间变化曲线,如图3~图6所示。
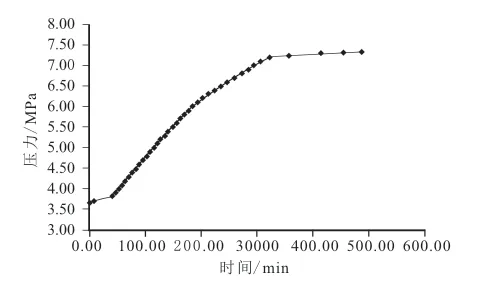
图3 体系Ⅰ分解压力与时间关系曲线 Fig.3 Relationship curves of dissociation pressure and time in system I
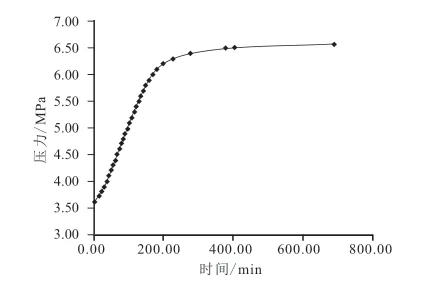
图4 体系Ⅱ分解压力与时间关系曲线Fig.4 Relationship curves of dissociation pressure and time in system Ⅱ
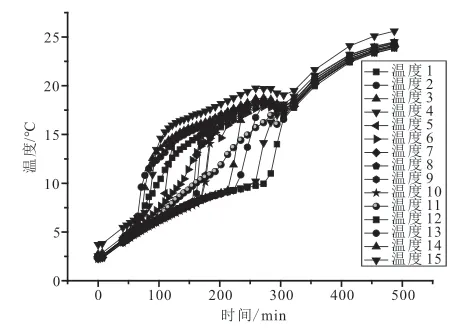
图5 体系Ⅰ分解温度与时间关系曲线 Fig.5 Relationship curve of temperature and time in system I

图6 体系Ⅱ分解温度与时间关系曲线Fig.6 Relationship curve of temperature and time in system Ⅱ
为了更好地研究反应体系的温度场分布,实验反应釜15个温度传感器分上、中、下三层,呈阵列分布,每层5个。大致分析上面2种反应体系温度-时间变化曲线图可得,实验体系上、中、下层各5个温度传感器测得的温度趋势大致走向一致,因此为了方便分析,采用上、中、下三层的平均温度来分析,由实验数据可得2种体系不同层面平均温度-时间变化曲线图,如图7、图8所示。
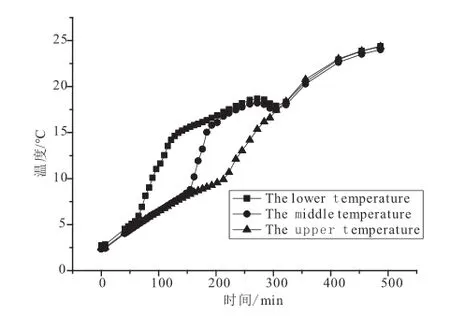
图7 体系Ⅰ不同层面温度与 时间关系曲线 Fig.7 Relationship curves of temperature with time of diff erent layer in system Ⅰ
2.2 比较分析
综合分析图3~图8:甲烷水合物的分解过程大致可分为早期的快速分解阶段、中期的缓慢分解阶段、后期的平稳分解阶段。早期快速分解阶段压力上升速度快,体系温度上升速率快,表现为大量甲烷分解气逸出;中期缓慢分解阶段压力上升缓慢,温度上升速率变缓慢,表现为产气量较小;后期平稳分解阶段压力不再变化,温度也基本不再变化,体系基本不再产气,微观表现为水合物的合成与分解呈动态平衡状态。
2.3 分解速率的确定
瓦斯水合物受热、降压或其它条件会进行分解,是水合物生成的逆过程,即
甲烷水合物分解过程中,甲烷水合物的分解量能反映出水合物分解的快慢,故为了便于分析,根据数据采集系统采集的数据,采用平均分解速率为参数进行分解过程的研究。本实验体系中气体为高压状态,因此采用可压缩气体状态方程:

甲烷水合物的分解量∆n根据公式(3)计算:
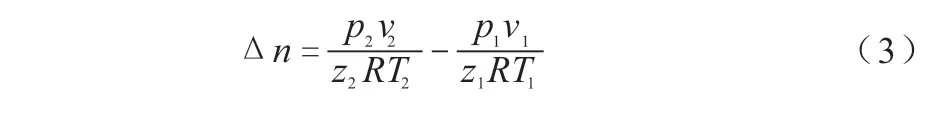
平均分解速率V为单位时间内水合物的分解量,可以表达为:

式中:V—平均分解速率,mol/min;P—反应釜内压力,MPa;v—反应釜气相体积,m3;T—反应釜气相温度,℃;Z—气体压缩因子,由软件计算得;R—气体常数,8.314;∆t—反应时间。
由公式(3)、(4)计算出三个阶段的分解速率,结果见表1和表2。
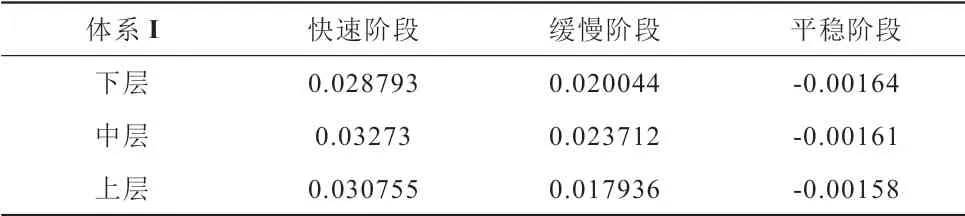
表1 体系Ⅰ不同阶段平均分解速率Table 1 Average decomposition rate of system Ⅰ at different stages

表2 体系Ⅱ不同阶段平均分解速率Table 2 Average decomposition rate of system Ⅱ at different stages
实验体系I,从图7可以得出,三个层面的温度上升趋势是先快速增加,接着缓慢升高,最后趋于平稳至恒定分解温度;但三层每个阶段的时间范围不一致,达到最高温度的时间也不一致,三层的分解速率明显不一样。
下层:0~122 min为快速分解阶段,分解过程温度曲线斜率最大,分解速率最快,此阶段的平均分解速率为0.0029mol/min,甲烷产气量快速增大;122~322 min为缓慢分解阶段,分解过程温度曲线斜率变缓,此阶段的分解速率为0.02mol/min,瓦斯产气量速率有所变缓;322~486 min分解过程曲线趋于平缓,为瓦斯水合物的平稳分解阶段,此阶段的分解速率为-0.00164mol/min,瓦斯水合物趋于稳定,基本不再产气,相应的压力和温度也基本不再有所变化至分解结束。
中层:0~184 min为快速分解阶段,分解过程温度曲线斜率最大,分解速率最快,此阶段的平均分解速率为0.032mol/min,瓦斯产气量快速增大;184~322 min为缓慢分解阶段,分解过程温度曲线斜率变缓,此阶段的分解速率为0.024mol/min,瓦斯产气量速率有所变缓;322~486 min分解过程曲线趋于平缓,为瓦斯水合物的平稳分解阶段,此阶段的分解速率为-0.00161mol/min,瓦斯水合物趋于稳定,基本不再产气,相应的压力和温度也基本不再有所变化至分解结束。
上层:0~272 min为快速分解阶段,分解过程温度曲线斜率最大,分解速率最快,此阶段的平均分解速率为0.0031mol/min,瓦斯产气量快速增大;272~322 min为缓慢分解阶段,分解过程温度曲线斜率变缓,此阶段的分解速率为0.018mol/min,瓦斯产气量速率有所变缓;322~486 min分解过程曲线趋于平缓,为瓦斯水合物的平稳分解阶段,此阶段的分解速率为-0.00158mol/min,瓦斯水合物趋于稳定,基本不再产气,相应的压力和温度也基本不再有所变化至分解结束。
在平稳阶段分解速率为负值,分析其原因,在此阶段,瓦斯水合物的分解和生成已达到平衡。压力有所增加,究其原因应是由于外界提供热量,密闭空间内气相吸收热量导致气体在密闭空间内膨胀,压力有所增加,但水合物已基本不再分解,因此导致分解速率为负值。
实验体系Ⅱ,从图8可以得出,和压力曲线相对应的是,三个层面的温度上升趋势是先快速增加,接着缓慢升高,最后趋于平稳到恒定分解温度;但三层每个阶段的时间范围不一致,达到最高温度的时间也不一致,三层的分解速率明显不一样。
下层:0~97min为快速分解阶段,分解过程温度曲线斜率最大,分解速率最快,此阶段的平均分解速率为0.037mol/min,瓦斯产气量快速增大;97~377 min为缓慢分解阶段,分解过程温度曲线斜率变缓,此阶段的分解速率为0.012mol/min,瓦斯产气量速率有所变缓;377~687 min分解过程曲线趋于平缓,为瓦斯水合物的平稳分解阶段,此阶段的分解速率为0.000287mol/min,瓦斯水合物趋于稳定,基本不再产气,相应的压力和温度也基本不再有所变化至分解结束。
中层:0~158 min为快速分解阶段,分解过程温度曲线斜率最大,分解速率最快,此阶段的平均分解速率为0.038mol/min,瓦斯产气量快速增大;158~377 min为缓慢分解阶段,分解过程温度曲线斜率变缓,此阶段的分解速率为0.004mol/min,瓦斯产气量速率有所变缓;377~687 min分解过程曲线趋于平缓,为瓦斯水合物的平稳分解阶段,此阶段的分解速率为0.000287mol/min,瓦斯水合物趋于稳定,基本不再产气,相应的压力和温度也基本不再有所变化至分解结束。
上层:0~200 min为快速分解阶段,分解过程温度曲线斜率最大,分解速率最快,此阶段的平均分解速率为0.033mol/min,瓦斯产气量快速增大;200~377 min为缓慢分解阶段,分解过程温度曲线斜率变缓,此阶段的分解速率为0.001mol/min,瓦斯产气量速率有所变缓;377~687 min分解过程曲线趋于平缓,为瓦斯水合物的平稳分解阶段,此阶段的分解速率为0.000263mol/min,瓦斯水合物趋于稳定,基本不再产气,相应的压力和温度也基本不再有所变化至分解结束。
笔者在文献[18]中,对甲烷水合物的生成过程的温度场分布特征进行了实验研究,研究表明:水合物生成过程中,反应体系的温度是先上升,达到最高值后下降。其中反应体系上层的温度上升速率最大,最先到达温度最高值,其次是中层、下层。
而在此次甲烷水合物分解过程实验中,反应体系的温度是先缓慢上升,随后快速升高,最后达到设定分解温度。其中,体系下层温度在快速升高阶段,上升速率最大,体系上层上升速率最小。实验体系Ⅰ、Ⅱ在快速分解阶段,每层温度达到最大温升速率即三层达到最大分解速率所用时间见表3。

表3 两体系每层达到最大分解速率时间Table 3 The time for each layer of two systems to reach the maximum decomposition rate
从表3可以得知,两种实验体系每层温度达到最大温升速率即三层达到最大分解速率所用时间都是下层﹤中层﹤上层,即下层最先达到最大分解速率,其次是中层,最后是上层。
分析认为,水合物生成过程是放热过程,因此,体系温度先升高,随着生成结束,温度也随之降低。甲烷水合物生成过程中,水合物是先在气-水界面生成,故反应体系的上层温度最先上升,上升速率最大,最先达到温度最高值;而后水合反应逐渐由表面向内部延伸,体系中层和下层温度也随之上升达到最大值。而甲烷水合物分解反应,是吸热反应,水合物分子结构中,甲烷分子要吸取外界供给的热量形成驱动力,从而摆脱分子吸附力,解析出来到气体空间中。在文中所述实验系统中,设定分解温度的恒温箱提供热量,热量通过金属反应釜传递给体系。体系上层是残余气体与体系接触界面,体系下层是金属反应釜的底部。而气体的热导率远远小于金属的热导率,因此体系下层的热量传递速率大于体系上层,导致下层的温度上升较上层快,随着分解反应的进行,分解反应结束,体系上中下三层温度最后趋于设定分解反应温度。
3 结论
(1)甲烷水合物分解速率先快速增大,随后缓慢增长,最后趋于平缓。
(2) 随着甲烷水合物的分解,反应体系的温度先极速升高,而后缓慢升高,最后达到设定分解温度。
(3)基于本文的实验系统,两种实验体系每层温度达到最大温升速率即三层达到最大分解速率所用时间都是下层﹤中层﹤上层,即下层最先达到最大分解速率,其次是中层,最后是上层。反应体系下层温度上升较上层快,最后三层趋于设定分解反应温度。
(4)研究结果有望对瓦斯水合物在常温下的储存有所借鉴。
