终末期肾病维持性血液透析患者高磷血症与异位钙化的临床研究△
2021-12-23李冠昉朱赞东
李冠昉 周 兵 朱赞东 李 丹
(韶关市第一人民医院肾病风湿科 韶关 512000)
目前透析治疗是终末期肾病主要的一种替代治疗方案,临床效果显著,其维持性治疗,能够提高患者的存活率,已广泛应用于临床[1],但长时间应用会因继发心血管疾病导致患者预后变差[2]。有研究表明肾病维持性血液透析者常引起钙磷代谢紊乱,表现为高磷血症引起异位钙盐过多沉积,使血管及心脏瓣膜钙化[3]。基于此,本研究通过研究2019年1月~2019年12月于本院血液透析中心行维持性血液透析的83例尿毒症患者,了解终末期肾病血液透析患者中高磷血症钙化情况及其影响因素分析,为我院透析中心出现的高磷血症患者提供个体化的治疗方案,为出现异位钙化情况的患者提供早期预防、诊断和治疗方案提供重要依据。
1 研究对象与方法
1.1 研究对象
本研究选取2019年1月~2019年12月于本院血液透析中心行维持性血液透析83例尿毒症患者作为研究对象。其中男53例,女30例;透析龄6~144个月,平均透析龄(52.56±4.34)个月;年龄30~76岁,平均年龄(55.47±15.8)岁;根据原发病因:慢性肾小球肾炎30例,慢性肾盂肾炎20例, 糖尿病肾病15例,高血压肾小球动脉硬化15例,肾病综合征2例,病因不明1例。根据2007年KDOQI指南推荐标准,将血磷水平为1.13~1.78mmol/L定义为正常组42例,血磷水平>1.78mmol/L定义为高磷组41例。研究对象纳入标准:(1)所有患者均符合中华医学会肾病分会中终末期肾病的诊断标准,并进行透析治疗;(2)透析方案均严格按照要求执行;(3)研究对象均表现不同程度的高磷、甲状旁腺功能亢进、心脏彩超检查发现心血管或心脏瓣膜钙化。排除标准:(1)肝肾功能不全者;(2)有恶性肿瘤病史者;(3)有其他影响钙磷代谢疾病者;(4)临床资料不完整者。
所有患者或家属均对本研究知情并同意签字,该研究经本院医学伦理委员会批准。
1.2 观察指标
1.2.1基本信息
记录患者一般情况信息,包括性别、年龄、体重等,以及患病情况和药物使用情况包括每周透析次数、时间等。
1.2.2临床观察指标
血磷、血钙测量:在患者透析之前,采用分离胶加促凝剂真空采血管来采集外周静脉血大约3~4ml,之后在采血后2h内送本院生化科,应用免疫透射比浊法来测定血钙、血磷。甲状旁腺激素:甲状旁腺激素血标本送广州艾迪康医学检验中心测定。心脏彩超:B超室内检查心脏及瓣膜情况。血压测量:血压测量采用静坐式,所有患者血压值取两次血压测量的平均值,收缩压≥140mmHg或舒张压≥90mmHg则属于高血压患者。甘油三酯与胆固醇:测量前需要患者空腹8~12h,抽取清晨空腹静脉血5ml,静置30min,现场3 000r/min离心10min后送到实验室测定。BMI为体重除以身高的平方,取患者站立,于距肚脐上缘1cm处进行腰围测量;身高、体重数据连续测量两次,取平均值,分别精确到0.5cm和0.5kg。
1.3 统计学分析
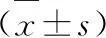
2 结果
2.1 研究对象的单因素分析
83例研究对象中,男53例,占比为63.85%,女30例,占比为36.14%;平均年龄(55.47±15.8)岁。单因素结果分析中,高磷血症组血钙浓度高于血磷正常组(t=2.77,P=0.007);高磷血症组PTH水平高于血磷正常组(t=8.232,P<0.001);高磷血症组胆固醇水平高于血磷正常组(t=17.943,P<0.001)、高磷血症组高血压患病高于血磷正常组(χ2=5.198,P=0.023)、高磷血症组心脏瓣膜钙化率高于血磷正常组(χ2=5.816,P=0.016),见表1。
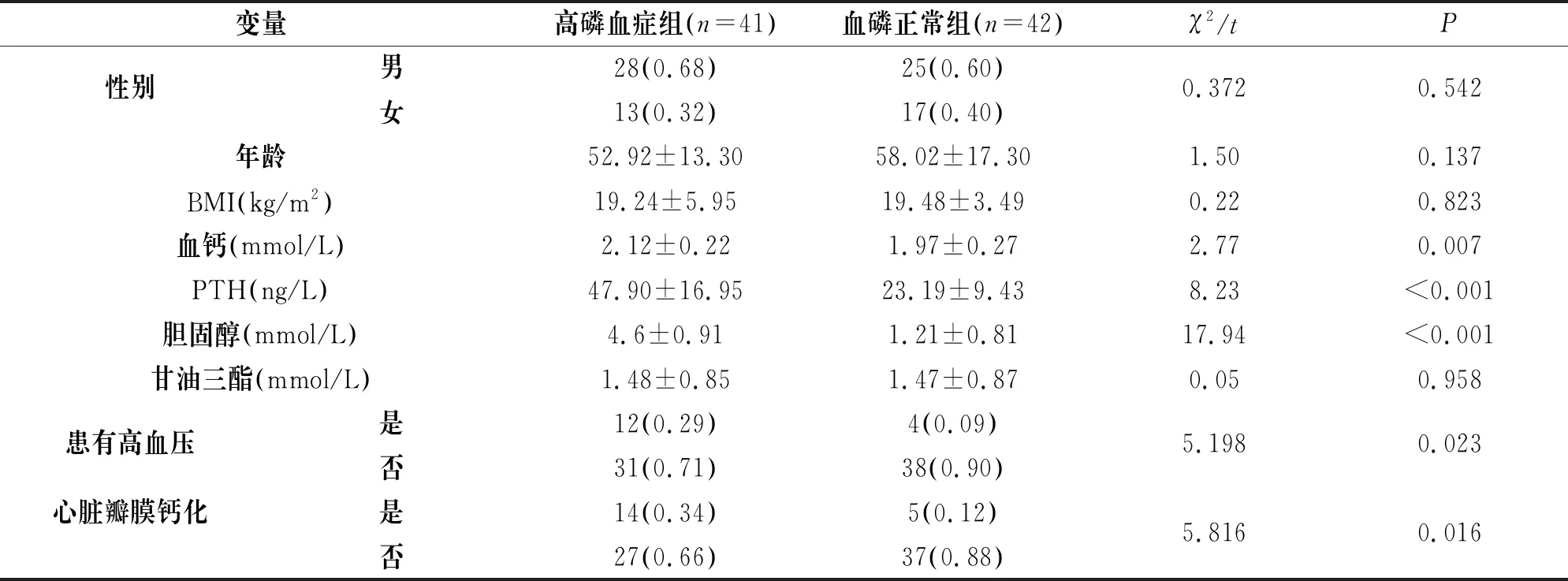
表1 高磷血症单因素分析
2.2 研究对象的多因素分析
多因素结果分析显示,血钙浓度每增加一个SD单位高磷血症患病风险增加1.224倍(95%CI为1.079~1.389);高血压患者患高磷血症风险是不患高血压者的5.347倍(95%CI为1.192~23.988);心脏瓣膜钙化者高磷血症患病风险为不是心脏瓣膜钙化者的4.691倍(95%CI为1.876~5.980);胆固醇每增加一个SD患病风险增加1.412倍(95%CI为1.042~1.912),见表2。
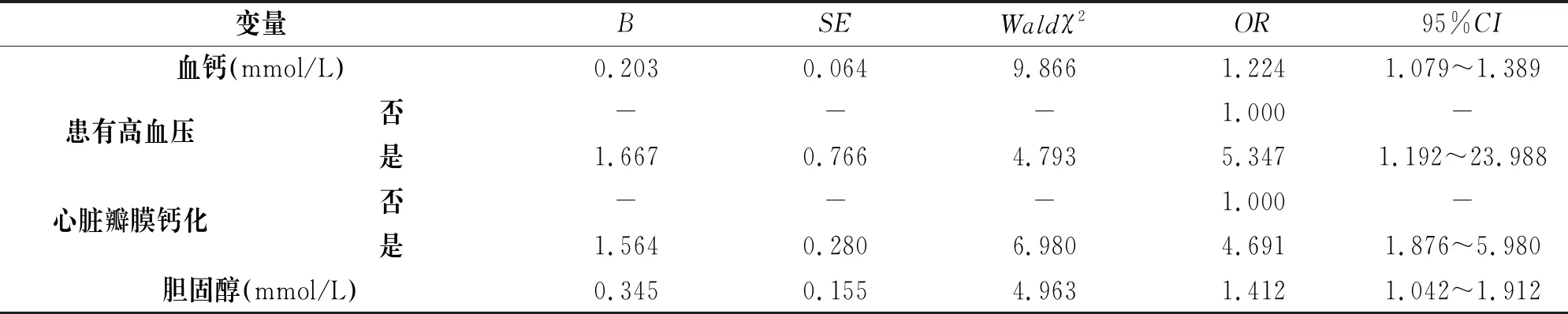
表2 高磷血症多因素Logistic回归分析
3 讨论
慢性肾病患者因维持性血液透析治疗,使钙磷代谢障碍造成磷在体内蓄积,继而引发高钙血症,增加患者死亡风险[4]。该研究通过分析83例高磷血症患者的钙化相关指标及其他影响因素,探究终末期肾病患者磷与钙代谢的关系及其他因素的影响,为临床患者诊疗提供依据。
研究结果表明,高磷血症组血钙浓度显著高于血磷正常组(P<0.05),且单因素分析发现高磷血症组心脏瓣膜钙化率约34%,表明维持性血液透析治疗后血磷水平升高导致的心脏瓣膜异位钙化显著增加,值得注意。在多因素分析中,血钙浓度增高、心脏瓣膜钙化使高磷血症患病风险分别增加1.224倍和4.691倍,该结果与郑晨等[5]研究结果相似,其发现血钙浓度升高可使患病风险增高1.721倍,另外血磷会使心脏瓣膜钙化风险提高16倍。至于两者间具体机制可能包括以下原因:(1)PTH、1,25(OH)2D3和CT激素水平变化影响钙磷代谢水平的改变[6~7];(2)CKD患者的高磷血症与心血管钙化显著相关,血磷每升高10mg/L,其冠状动脉、胸降主动脉和二尖瓣的钙化风险分别上升22%、33%和61%[8];(3)心血管疾病的发生和发展与高磷血症之间存在很强的正相关性,有研究发现在健康人群中,血磷处于正常范围偏高的水平者中心血管并发症及死亡的风险也显著增加。因此,钙磷代谢之间的关系需进一步研究[9~10]。
在本研究单因素分析中发现高磷血症组PTH水平显著增加,究其原因,维持性血透患者钙磷代谢紊乱继发甲状旁腺功能亢进,促进血液PTH水平升高,而且继发甲状旁腺功能亢进诱导骨转换活跃进而增加钙和磷释放进入血液循环的机会,增加心血管疾病的发生及死亡风险。也有研究发现,PTH与血磷水平呈正相关[11]。另外本研究中发现合并高血压患高磷酸血症的OR值为5.374,是高磷酸血症的独立危险因素。胡洁茹等[12]在3~5期慢性肾脏病患者高磷血症发病情况及危险因素分析中得出高血压患高磷酸血症的OR值约为4,与本研究具有相同的趋势结果。本研究中胆固醇水平在高磷血症组显著高于血磷正常组。目前研究认为高磷血症可以通过干扰SCAP/SREBP2信号通路促进VSMCs内源性胆固醇合成,从而使胆固醇水平明显增高[13]。
综上所述,终末期肾病高磷血症患者血钙水平、心脏瓣膜钙化、高血压是其独立危险因素,在患者治疗过程中应高度关注患者的磷、钙情况,及时监控心血管病变,注意增加血钙水平的药物使用情况,为患者的预后提供良好的保障。
