早产儿梗阻性脑积水外科治疗与预后的临床研究
2021-12-22刘云峰黄春玲童笑梅张扬曾琳原晋芳
刘云峰 黄春玲 童笑梅 张扬 曾琳 原晋芳
(1.北京大学第三医院儿科,北京 100191;2.北京大学第一医院神经外科,北京 100034;3.北京大学第三医院临床流行病学研究中心,北京 100191)
小胎龄、低体重早产儿通常因Ⅲ~Ⅳ度脑室周围- 脑室内出血 (periventricular-intraventricular hemorrhage,PIVH)(以下简称严重颅内出血)、中枢神经系统感染等严重脑损伤出现梗阻性脑积水(obstructive hydrocephalus)(以下简称脑积水),易造成周围脑实质损伤,远期神经系统后遗症发生率较高[1]。既往此类早产儿常因脑损伤严重,后遗症较多而放弃治疗。近年来神经外科技术的发展为脑积水治疗、改善预后起到了不可估量的作用。有关早产儿脑积水的早期处理方式与预后的关系报道较少。一项包含23例早产儿及15例足月儿脑积水研究显示,颅内出血和颅内感染是新生儿脑积水的主要病因,单纯颅内出血后脑积水较少需行永久分流术治疗。即使外科干预,脑积水缓解,也很有可能存在神经系统后遗症[2]。另有研究显示,12 例出血后脑积水早产儿早期外科干预,随访至15 月龄时,有半数神经发育正常[3]。目前对早产儿脑积水疾病早期是否外科干预及干预指征尚未达成共识。本研究拟通过回顾性总结我院早产儿脑积水外科处理与保守治疗对远期预后的影响情况,初步探讨早产儿脑积水外科治疗的优越性。为脑积水早产儿内外科综合管理提供参考依据。
1 资料与方法
1.1 研究对象
回顾性分析 2010 年 1 月至 2020 年 12 月在北京大学第三医院新生儿科住院、经超声确诊的脑积水早产儿为研究对象。依据是否进行外科干预分为保守治疗组和外科干预组。
本研究通过北京大学第三医院伦理委员会审核[(2021)医伦审第(102-01)号],豁免知情同意。
1.2 脑积水诊断标准
以颅脑超声影像学为依据,采用Levene[4]的侧脑室指数 (ventricular index,VI) 和 Sondhi 等[5]各脑室内径测量标准测量侧脑室前角宽度(anterior horn width, AHW)、 丘 枕 距 (thalamooccipital distance,TOD)及第三脑室宽度。VI数值大于P97,其他参数大于P95时考虑存在脑积水(图1)。

图1 脑室各径线测量超声示意图
1.3 脑积水的外科处理方法
外科干预指征[6]:有临床颅高压表现:前囟明显膨隆,张力进行性增高,头围进行性增大,>2 cm/周,频繁呼吸暂停等。超声影像:脑室VI值大于P97,AHW 及TOD 大于P95,并进行性增加,脑室张力感逐步加重。
外科术式:第一阶段:侧脑室外引流(external ventricular drainage,EVD),侧脑室-帽状腱膜下(ventriculosubgaleal,VSG) 分流,Ommaya 储液囊分流。第二阶段:脑室腹腔(ventriculoperitoneal,VP)分流。
1.4 神经发育预后
分别于矫正年龄足月、1 月、3 月、6 月、9月、12 月、1.5 岁、2 岁及以后,按期进行体格评估、神经发育检查,GESELL量表评估。动态进行颅脑超声或颅脑MRI 检查,观察脑室及周围脑实质的变化情况。不能到医院者电话随访神经发育情况。依据随访结果分为:颅脑影像结果正常,GESELL 量表各能区发育商(development quotient,DQ)≥75 分者为神经发育正常;颅脑影像结果异常、GESELL量表各能区DQ<75分者为神经发育异常;死亡。
1.5 资料收集
收集入组对象的胎龄、出生体重、脑积水原因、脑积水外科引流方式,以及感染、出血、引流管阻塞、电解质紊乱等引流并发症[7],有无VP分流。
1.6 统计学分析
应用SPSS 23.0 统计软件进行数据处理。非正态分布计量资料采用中位数(范围)表示,组间比较采用Wilcoxon秩和检验。计数资料采用例数和百分率(%)表示,组间比较采用卡方检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
11 年中在我院电子病例库共检索到早产儿12 189 例,其中发生脑积水早产儿54 例,发生率为4.43‰。失访5 例。最终纳入49 例脑积水早产儿,其中保守治疗组37例,外科干预组12例。两组胎龄、出生体重、性别构成、病因方面差异无统计学意义(P>0.05),见表1。

表1 脑积水早产儿一般情况及病因比较
2.2 外科治疗情况
分流方式:4 例行VSG 分流治疗,其中1 例因脑室内积血较重,先行EVD 2周,脑脊液逐步清亮后改行VSG 分流治疗;3 例直接行VSG 分流治疗。8 例行Ommaya 储液囊分流,其中2 例化脓性脑膜炎合并脑室炎出现脑积水,先行EVD,脑室内冲洗及脑室内给药治疗,后改Ommaya 储液囊分流;6例直接行Ommaya储液囊分流。见表2。
外科并发症:1 例Ommaya 储液囊分流期间继发感染,见表2。

表2 脑积水早产儿早期外科干预与预后情况分析
早产儿脑积水不同外科引流方式,后期VP 分流有所不同。8 例患儿后期行VP 分流,其中4 例VSG 分流患儿中,1 例行 VP 分流,3 例无需 VP 分流治疗;8例行Ommaya储液囊分流患儿中,7例行VP 分流,1 例无需VP 分流治疗。两种引流方式后期VP 分流率组间比较差异无统计学意义(25%vs 88%,P=0.067)。
2.3 治疗方式、病因与神经发育预后关系
保守治疗组中19 例(51%)因家长拒绝外科治疗或放弃治疗而死亡,其中前6 年死亡12 例,后5年死亡7例。18例存活者随访年龄中位数48个月(7 个月至10 岁6 个月);其中神经发育正常者11例,神经发育异常者7例。
外科干预组全部存活,神经发育正常者5 例;神经发育异常者7例。外科干预组存活率高于保守治疗组(P=0.001)。
37 例严重颅内出血导致脑积水早产儿中,外科干预组神经发育正常比例高于保守治疗组(P<0.05)。10 例中枢神经系统感染导致脑积水早产儿中,保守治疗组和外科干预组均留有不同程度神经系统后遗症,差异无统计学意义(P>0.05),见表3。
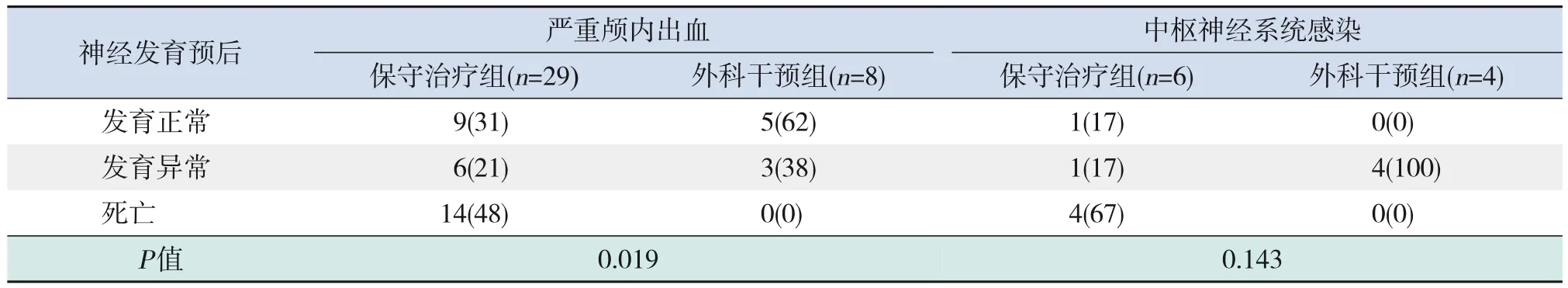
表3 脑积水早产儿不同病因、干预方式与神经发育预后的关系 [例(%)]
3 讨论
早产儿PIVH 的发病率为30%~40%,胎龄越小,PIVH 越严重,脑积水的发生率越高,80%的Ⅲ~Ⅳ度 PIVH 导致脑积水[8]。小于 32 周的极小早产儿感染发生率较高,脑膜炎也是脑积水的重要病因。感染后的炎症因子局部刺激引起蛛网膜、蛛网膜下腔、蛛网膜绒毛、软脑膜及神经根周围间隙等部位的纤维增生、黏连,甚至发生闭塞,引起脑脊液回流和吸收障碍,亦可加重脑积水[9]。本研究病例中多为小于32 周的极早产儿,体重小于1 500 g 的极低出生体重儿,Ⅲ~Ⅳ度PIVH 占75%(37/49),中枢神经系统感染占20%(10/49),二者仍是导致脑积水的重要病因,与文献报道[2]一致。本研究脑积水发病率达4.43‰,提示脑积水在早产儿中并不少见。对此类早产儿尤其需要更多关注。
目前对于梗阻严重、脑积水进展迅速者,外科引流干预是最有效的治疗方法,最大限度减轻脑积水并发症。关于外科分流的指征和时机,目前尚无统一标准。临床多以存在颅内压增高表现,超声检查提示脑室进行性扩张,脑室内压力增高,周围脑实质水肿,作为外科干预的指征。脑室测量中,将VI>P97、AHW>6 mm、TOD>24 mm作为外科引流指征[10]。曾有研究将 VI>P97时引流称为早期引流,VI>P97+4 mm 时引流称为晚期引流。该研究显示,早期引流者后期VP 分流率明显低于晚期引流者,其临床神经系统后遗症发生率也明显低于晚期引流者[11]。因此,本研究病例均采用VI+AHW+TOD指标作为外科干预指征。同时临床观察脑积水增长的速度及颅内压增高的程度,患儿耐受手术的程度决定引流时机。既直接反映脑室扩张严重情况,又能尽早干预,减轻对脑实质的进一步损害,是对早产儿脑积水外科引流指征的进一步探索。
早产儿生后早期各种并发症较多,不易耐受直接的VP 分流。因此,脑积水第一阶段处理均选择简单易行,损伤较小的外科干预措施作为VP 分流前的过渡[12]。目前外科第一阶段引流方式分为EVD 及侧脑室分流两种,后者又多采用VSG 分流与Ommaya储液囊分流两种方式。EVD不仅可以引流出造成脑脊液循环阻塞的血凝块或感染后的炎性渗出物,合并脑室炎的患儿更可以通过EVD 管路,注入药物治疗脑室炎[13-14]。此种引流方式脑室与外界持续相通,引流期间管路的维护及相关管理较为复杂,感染风险极高,不易长期引流,多数不超过 2 周[7]。VSG 分流与 Ommaya 储液囊分流是临床最为实用、安全、可床旁操作的简易分流方式[15]。VSG 分流,脑室液由帽状腱膜下间隙吸收,可以持续引流,保持脑室内压力恒定,避免潜在感染和电解质紊乱的风险。但帽状腱膜腔隙有限,脑脊液产生较多时,不能及时有效完全吸收,导致引流失败。Ommaya 储液囊可以根据脑室压力变化,灵活增减脑脊液抽吸量。但易造成感染、电解质紊乱等并发症。选择何种分流方式,目前尚无统一标准,与神经外科水平及技术熟练度有关[16]。本研究12例外科干预病例,经历了11年的时间,根据当时的技术条件和病情选择不同的外科治疗方法。1例大量的脑室内出血病例,先行EVD 治疗,后行侧脑室分流,有效减轻了后期梗阻的程度。另有2例合并脑室炎,行EVD治疗可以同时侧脑室给药治疗炎症。因此,建议如有严重的脑室内出血或脑室炎合并脑积水患儿,可先行EVD 治疗,引流脑室内血液及侧脑室给药,再依据脑室扩张速度改为VSG分流或Ommaya储液囊分流。
侧脑室分流易出现多种并发症,如感染、引流管堵塞、电解质紊乱等。侧脑室分流的感染率从0%~22%不等[17],而中枢神经系统感染导致脑积水病例中,外科引流出现感染并发症的概率较高[18]。但 Meta 分析显示,VSG 分流和脑室储液囊装置分流感染率、堵管率、后期VP分流率及神经发育预后无明显差异[19]。本研究4例行VSG分流,8 例行Ommaya 储液囊分流,术后感染发生率8%(1/12),无其他并发症。由此提示,积极有效的分流管理,可显著减少外科并发症的发生。
脑积水第二阶段是否需要VP 分流取决于中脑水管的梗阻程度。研究显示,尽管早期外科干预仍有78%~89%脑积水早产儿,中脑水管不能再通,后期需要永久分流手术[20]。本研究有8 例(67%)患儿后期行VP 分流,分流率低于文献报道[20]。分析原因可能与部分患儿引流时机较早,并VP分流前积极进行EVD治疗,引流出脑室内的内容物,减轻阻塞程度有关。Meta分析显示,VSG分流与Ommaya 储液囊分流患儿,后期VP 分流发生率无明显差异[19]。本研究中VSG分流与Ommaya储液囊分流后期VP 分流率相比较,因样本量较小,差异虽无统计学意义,但可以看出VSG 分流患儿后期需行VP 分流的比例明显低于Ommaya 储液囊分流患儿(25%vs 88%)。分析原因并非与引流术式有关,而可能与脑积水原发病构成不同有关。颅内出血导致的脑积水后期需要VP 分流者仅为50%(4/8),多是因引流出凝血块或红细胞破坏分解的蛋白样物质等阻塞物,中脑水管再通所致。中枢神经系统感染导致的脑积水后期需要VP 分流者为100%(4/4),原因是由于炎症引起脑室内炎性渗出物较多,不仅可以阻塞脑脊液循环通路引起回流障碍,还可局部刺激引发蛛网膜、软脑膜炎,继发纤维组织增生黏连致闭塞,引起脑脊液吸收障碍,梗阻不易解除。最终需要永久性VP 分流。但因样本量较少,需要增加样本量,进一步研究得出确切结论。
既往由于医疗条件的限制,很多脑积水患儿因预后差而放弃治疗。研究显示,颅内出血导致的脑积水,如伴有脑实质损伤,后期出现脑性瘫痪的概率高达55.9%,病死率可达26%~47%[21]。在PIVH 患者中,Ommaya 储液囊和EVD 联合治疗可促进脑室内血凝块清除,缓解脑实质压力,降低脑积水并发症发生,临床效果良好[22]。本研究11 年中49 例患儿,严重颅内出血导致脑积水不经外科治疗病死率高达48%。但近5年放弃治疗的患儿数较前6年明显减少,与医疗技术的发展、治疗脑积水的方法逐渐改进有关。而外科积极干预有效降低了病死率,且神经发育预后比例明显好于保守治疗组,与文献报道[22]一致。建议此类患儿应加强外科干预,改善预后。
单中心研究显示,中枢神经系统感染早产儿,合并脑积水者常因合并脑室炎、脑室周围白质软化,其预后明显差于无脑积水患儿(31.3% vs 75.4%)[23]。本研究可以看出,中枢神经系统感染导致脑积水患儿,积极外科干预虽可提高早产儿存活率,但仍出现不同程度神经系统后遗症。
综上所述,32 周且1 500 g 以下极早产儿严重颅内出血及中枢神经系统感染易导致脑积水。积极外科干预可有效增加存活率,改善颅内出血导致的脑积水患儿的预后。本研究样本量较少,尚需增加样本量,深入研究,为脑积水早产儿的临床治疗提供更为可靠的科学依据。
利益冲突声明:所有作者均声明不存在利益冲突。
