LRP1-pPyk2-MMP9通路在高氧诱导新生大鼠肺损伤中的作用
2021-12-22郑亚斐朱海艳王维胡晶晶包天平田兆方
郑亚斐 朱海艳 王维 胡晶晶 包天平 田兆方
(南京医科大学附属淮安第一医院新生儿科/淮安市小儿呼吸诊疗重点实验室,江苏淮安 223300)
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿常见的慢性肺部疾病,由肺损伤和未成熟肺的修复之间的不平衡引起[1]。此外,BPD还会对神经系统和其他系统器官造成损害[2]。由于目前BPD 缺乏有效的治疗方法,因而针对其发病机制的研究以便实现精准治疗一直是新生儿学的热点话题。
低密度脂蛋白受体相关蛋白1(low-density lipoprotein receptor-related protein 1,LRP1) 是本课题组在前期临床试验中通过数据非依赖采集质谱技术,从BPD 患儿与非BPD 患儿的血浆中筛选并得到验证的差异表达蛋白[3]。这提示LRP1可能涉及BPD 发病机制。LRP1 是一种普遍存在的I型跨膜受体,可介导多种途径的信号转导,涉及蛋白酶降解、炎症调节、细胞生长、细胞存活和迁移等[4];还可结合内吞40 多种结构和功能不同的配体,包括载脂蛋白、蛋白酶、蛋白酶抑制复合物和细胞外基质蛋白,如基质金属蛋白酶(matrix metalloproteinases,MMPs)和尿激酶型纤溶酶原激活物[5]。MMPs是一种锌依赖的蛋白水解酶,具有消化细胞外基质蛋白的能力,在生理和病理条件下都在细胞外基质重塑中发挥重要作用[6]。MMPs不仅参与炎症和致癌过程的启动和调节,还参与胚胎发育和器官成熟(包括肺)[7],其在BPD进展中具有的作用已得到公认[8-9],近年来MMP9 在BPD的作用受到重视[10-11]。酪氨酸激酶2(prolinerich tyrosine kinase 2,Pyk2)是一种富含脯氨酸的非受体酪氨酸激酶,可由细胞内钙水平升高而激活,还可被多种其他信号激活,如毒蕈碱型乙酰胆碱受体M1、蛋白激酶C、生长因子、活性氧等[12],pPyk2是其磷酸化形式。目前已有文献报道在血管平滑肌细胞[13]和成纤维细胞[14]中存在LRP1-pPyk2-MMP9信号通路。相关实验结果表明,pPyk2 与 LRP1β 链发生作用,且 pPyk2 和 MMP9 的特异性荧光在动脉粥样硬化斑块的血管细胞中重叠[13]。另外,共聚焦显微镜图像显示,pPyk2、MMP9 和LRP1 共定位于心肌梗死后的心肌成纤维细胞中[14]。但目前尚未有 LRP1-pPyk2-MMP9 通路参与BPD 发病的相关报道。因此,本研究旨在通过高氧诱导新生大鼠BPD 模型研究LRP1-pPyk2-MMP9信号通路的变化,为BPD的发病机制的研究提供新思路。
1 材料与方法
1.1 实验分组
Sprague-Dawley 大鼠饲养于南京医科大学附属淮安第一医院SPF级动物房,严格执行实验动物管理条例。将出生时间相差半小时以内的新生大鼠16只,雌雄不限,体重6~8 g,随机分配至空气对照组(吸入氧浓度=21%,空气组)、高氧模型组(吸入氧浓度>95%,高氧组),每组8 只。本实验取得南京医科大学附属淮安第一医院动物实验伦理委员会批准。高氧组新生大鼠按本实验室方法于生后即置于>95%氧浓度环境中持续暴露7 d 建立高氧肺损伤模型[15],空气组仅暴露于同室空气环境中,适时补充饲料和水,更换垫料。空气暴露和高氧暴露的母鼠每24 h 互换,以免母鼠因氧中毒影响新生鼠的哺乳喂养,交换母鼠过程轻拿轻放,防止母鼠激惹发生食子现象,记录大鼠生长情况。
1.2 标本收集
两组大鼠均于生后第8天称重后腹腔注射10%水合氯醛(4 mL/kg)麻醉,采用心脏取血法留取血1~2 mL。颈正中暴露气管,剪开一小口插入导管并固定,向导管内缓缓注入1 mL预冷0.9%氯化钠溶液反复回抽3 次,回收率80%~90%,留取支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)。快速剪开胸腔,取出双侧肺脏,肉眼观察后,用PBS冲洗;左上肺制成肺组织匀浆,右上肺组织以4%多聚甲醛固定,石蜡包埋后连续切片,厚度为5 μm,供免疫组化和组织学检查用。
1.3 肺组织病理检查
苏木精-伊红(hematoxylin-eosin staining,HE)染色后观察肺组织病理学改变,以辐射状肺泡计数(radical alveolar counts,RAC)评估肺泡发育程度,在100倍光镜视野下,随机选取5个视野,计数肺泡数并取其均值。
1.4 ELISA法测定血清可溶性LRP1和MMP9水平
采血后室温下静置2 h,再置4℃冰箱3~4 h,待血液凝固血块收缩后,4 000 r/min 离心10 min,取上清,保存于-80℃冰箱中。取BALF 于1 h 内4 000 r/min 离心10 min,取上清,保存于-80℃冰箱中。采用可溶性LRP1(soluble LRP1,sLRP1)(江苏酶免实业有限公司)、MMP9(武汉三鹰生物技术有限公司)ELISA试剂盒,按照产品说明书检测血清及BALF中相应指标的浓度。
1.5 Western blot检测蛋白水平
肺组织匀浆用BCA 法测定蛋白浓度,待测样品以10%SDS-聚丙烯酰胺凝胶进行电泳分离,然后把胶上的蛋白电转移到醋酸纤维膜上,5%无脂奶粉封闭,分别与兔抗鼠GAPDH 多克隆抗体一抗(Gentex,美国)(稀释度为1∶5 000)、兔抗鼠LRP1单克隆抗体一抗(Abcam,英国)(稀释度为1∶5 000)、兔抗鼠Pyk2单克隆抗体一抗(Abcam,英国)(稀释度为1∶5 000)、兔抗鼠pPyk2多克隆抗体一抗(Affinity,美国)(稀释度为1∶2 000)、兔抗鼠MMP9多克隆抗体一抗(Proteintech,美国)(稀释度为1∶2 000)孵育杂交,4℃过夜洗膜后,再加辣根过氧化物酶标记的二抗,室温孵育1 h,洗膜后进行显色,曝光于X线胶片上,在图像分析系统计算目的蛋白条带灰度值与内参蛋白条带灰度值的比值,代表目的蛋白的相对表达量。
1.6 Real-Time PCR法检测mRNA相对表达量
TRIzol 法抽提2 组大鼠肺组织总RNA(美国Invitrogen公司),采用逆转录聚合酶链反应法检测LRP1 mRNA、MMP9 mRNA的表达变化,逆转录试剂盒及聚合酶链反应试剂盒购自日本Takara 公司。荧光定量聚合酶链反应体系为20 μL,2×SYBR Premix Ex Taq Ⅱ 10 μL,上下游引物 (10 μmol/L)各 0.8 μL, ROX 0.4 μL, cDNA 2.0 μL, dH2O 6.0 μL。反应条件为95℃预变性30 s;95℃变性5 s,60℃退火20 s,40 个循环;溶解曲线为95℃15 s,60℃60 s,95℃15 s。扩增引物序列LRP1-F: 5'-CCACTATGGATGCCCCTAAAAC-3', LRP1-R:5'-GCAATCTCTTTCACCGTCACA-3';MMP9-F:5'-CCCTGCGTATTTCCATTCAT-3', MMP9-R: 5'-AAACCCCACTTCTTGTCAGC-3'; GAPDH-F: 5'-CCTTCATTGACCTCAACTACATGG-3', GAPDH-R:5'-CTCGCTCCTGGAAGATGGTG-3'。
1.7 统计学分析
采用SPSS 20.0 统计学软件对所有数据进行统计学比较分析,计量资料以均数±标准差()表示,两组间比较采用两样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠生长状况
空气组大鼠活动良好、反应灵敏、毛发光泽、肤色红润,无异常表现。高氧组大鼠反应迟钝、精神萎靡、活动减少,毛发发涩、无光泽,皮肤苍白、干燥,口周发绀,氧依赖表现明显,体重增长较空气组缓慢(P<0.05),见表1。
表1 两组大鼠生后各时间点体重比较 (,g)
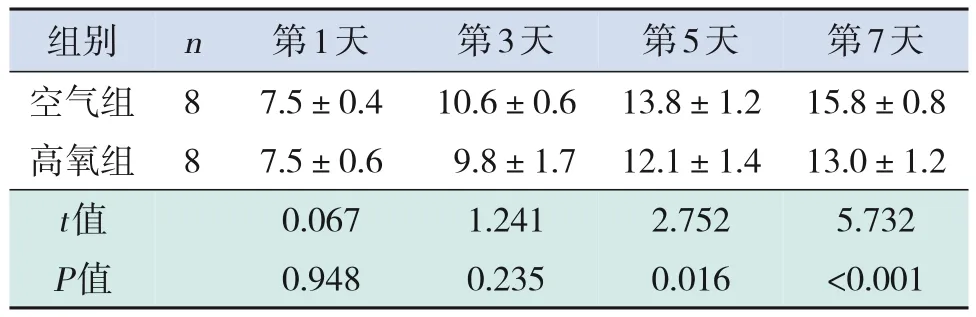
表1 两组大鼠生后各时间点体重比较 (,g)
images/BZ_106_1284_764_1431_827.pngimages/BZ_106_1431_764_1504_827.pngimages/BZ_106_1504_764_1689_827.pngimages/BZ_106_1689_764_1874_827.pngimages/BZ_106_1874_764_2059_827.pngimages/BZ_106_1284_945_1431_1063.png空气组高氧组8 8images/BZ_106_1431_945_1504_1063.pngimages/BZ_106_1504_945_1689_1063.png7.5±0.4 7.5±0.6images/BZ_106_1689_945_1874_1063.png10.6±0.6 9.8±1.7images/BZ_106_1874_945_2059_1063.png13.8±1.2 12.1±1.4第7天15.8±0.8 13.0±1.2 5.732<0.001
2.2 大鼠肺组织病理变化
HE 染色结果显示,空气组大鼠肺组织结构完整;高氧组可见肺泡数减少,肺泡大小不均一,肺泡间隔水肿增厚及纤维化(图1)。空气组RAC值 (19.1±2.0) 大 于 高 氧 组 (13.2±1.7)(t=6.321,P<0.05)。提示BPD小鼠模型构建成功。
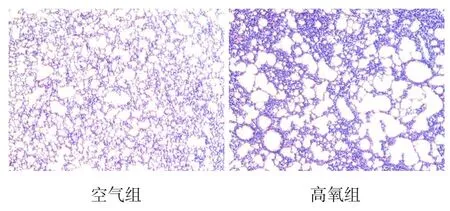
图1 两组大鼠肺组织病理切片
2.3 两组大鼠sLRP1及MMP9水平变化
高氧组大鼠血清及BALF 中sLRP1、MMP9 水平均高于空气组(P<0.05),见表2~3。
表2 两组大鼠血清中sLRP1及MMP9水平比较 (,pg/mL)
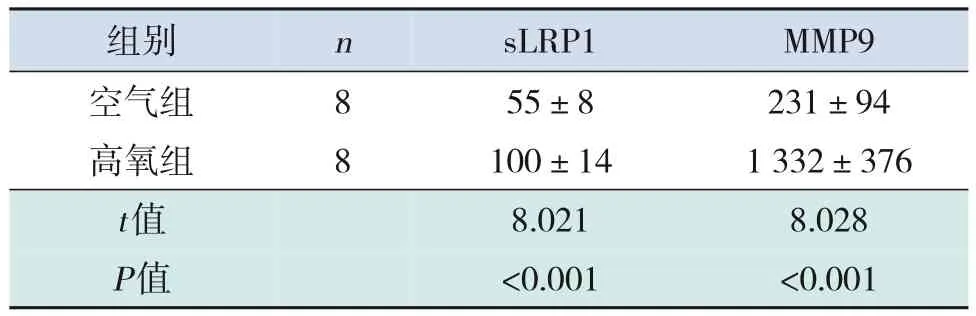
表2 两组大鼠血清中sLRP1及MMP9水平比较 (,pg/mL)
注:[sLRP1] 可溶性低密度脂蛋白受体相关蛋白1;[MMP9]基质金属蛋白酶9。
231±94 1 332±376images/BZ_106_1284_2764_1549_2826.pngimages/BZ_106_1549_2764_1686_2826.pngimages/BZ_106_1686_2764_1965_2826.png8 8images/BZ_106_1965_2764_2243_2826.pngimages/BZ_106_1284_2945_1549_3063.png空气组高氧组images/BZ_106_1549_2945_1686_3063.pngimages/BZ_106_1686_2945_1965_3063.png55±8 100±14images/BZ_106_1965_2945_2243_3063.png
表3 两组大鼠BALF中sLRP1及MMP9水平比较 (,pg/mL)
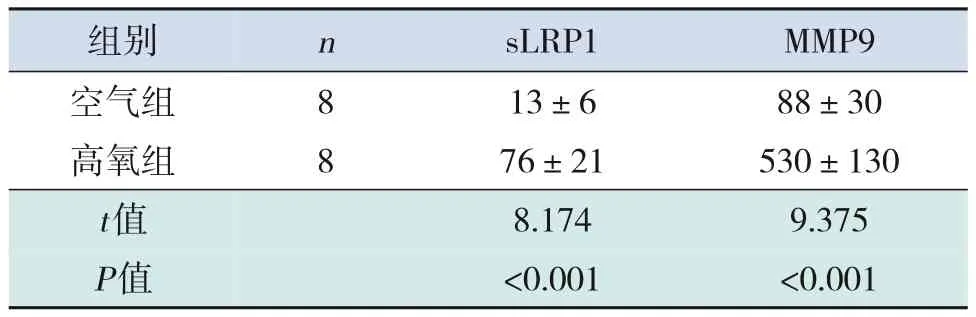
表3 两组大鼠BALF中sLRP1及MMP9水平比较 (,pg/mL)
注:[sLRP1] 可溶性低密度脂蛋白受体相关蛋白1;[MMP9]基质金属蛋白酶9。
MMP9 88±30 530±130 9.375<0.001images/BZ_107_237_471_465_534.pngimages/BZ_107_465_471_642_534.pngimages/BZ_107_642_471_919_534.png8 8images/BZ_107_237_652_465_770.png空气组高氧组images/BZ_107_465_652_642_770.pngimages/BZ_107_642_652_919_770.png13±6 76±21
2.4 Western blot 法检测两组大鼠肺组织匀浆蛋白表达变化
LRP1、MMP9 蛋白在高氧组的表达水平明显高于空气组(P<0.05)。pPyk2蛋白在高氧组的表达水平较空气组也明显升高(P<0.05),但Pyk2蛋白水平在两组间比较差异无统计学意义(P>0.05)。见图2、表4。

图2 Western blot法检测两组大鼠肺组织匀浆LRP1、pPyk2、MMP9蛋白表达电泳图
表4 两组大鼠肺组织匀浆蛋白相对表达量比较 ()
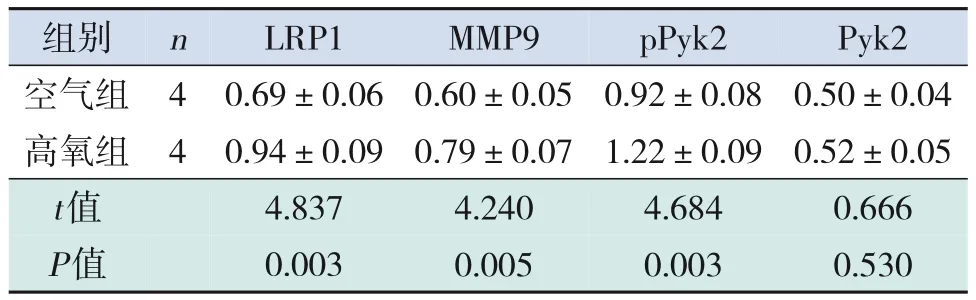
表4 两组大鼠肺组织匀浆蛋白相对表达量比较 ()
注:[LRP1]低密度脂蛋白受体相关蛋白1;[MMP9]基质金属蛋白酶9;[pPyk2]磷酸化酪氨酸激酶2;[Pyk2]酪氨酸激酶2。
Pyk2 0.50±0.04 0.52±0.05 0.666 0.530images/BZ_107_237_2017_374_2073.pngimages/BZ_107_374_2017_438_2073.pngimages/BZ_107_438_2017_627_2073.png4 4images/BZ_107_627_2017_817_2073.pngimages/BZ_107_817_2017_1006_2073.pngimages/BZ_107_237_2187_374_2300.png空气组高氧组images/BZ_107_374_2187_438_2300.pngimages/BZ_107_438_2187_627_2300.png0.69±0.06 0.94±0.09images/BZ_107_627_2187_817_2300.png0.60±0.05 0.79±0.07images/BZ_107_817_2187_1006_2300.png0.92±0.08 1.22±0.09
2.5 RT-PCR 法检测两组大鼠肺组织匀浆sLRP1及MMP9的mRNA水平变化
高氧组LRP1 mRNA 和MMP9 mRNA 的相对表达量均高于空气组(P<0.05),见表5。
表5 两组大鼠LRP1及MMP9的mRNA水平比较 ()
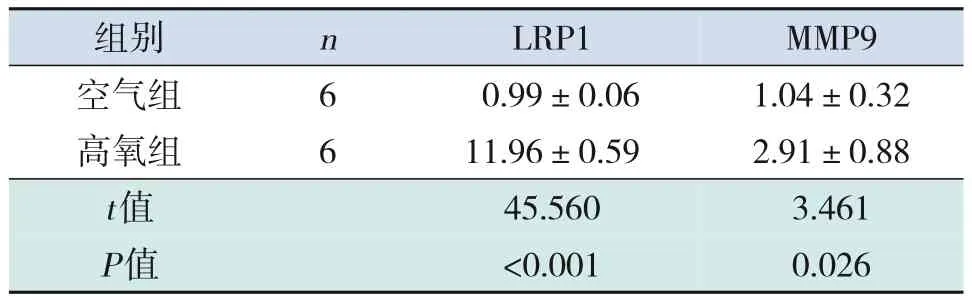
表5 两组大鼠LRP1及MMP9的mRNA水平比较 ()
注:[LRP1]低密度脂蛋白受体相关蛋白1;[MMP9]基质金属蛋白酶9。
MMP9 1.04±0.32 2.91±0.88 3.461 0.026images/BZ_107_239_2891_480_2947.pngimages/BZ_107_480_2891_635_2947.pngimages/BZ_107_635_2891_929_2947.png6 6images/BZ_107_239_3061_480_3174.png空气组高氧组images/BZ_107_480_3061_635_3174.pngimages/BZ_107_635_3061_929_3174.png0.99±0.06 11.96±0.59
3 讨论
BPD 易发生在接受机械通气的早产儿中,并可能最终导致长期肺部疾病[16]。然而,BPD 的发病机制尚未完全了解,可能与肺泡和血管肺发育停滞、纤维化和慢性炎症有关[17]。目前研究已发现,MMPs在BPD进展中发挥着核心作用,主要影响BPD 肺发育停滞和组织重塑纤维化过程[18],其中MMP9受到了高度重视。
本研究发现在高氧组出现肺组织间质水肿,肺泡腔可见水肿液形成、炎症细胞浸润及肺泡出血;血清和BALF 中MMP9 水平均较空气组明显升高,肺组织匀浆中MMP9 蛋白表达也增加,与Tambunting 等[19]研究相符。MMP9 在 BPD 中的功能已被研究[20],但其涉及的相关通路尚未明确。最新研究发现,MMP9的活性不仅受到其组织抑制剂 的 调 节[21], 还 通 过 ERK1/2[22]、 NF-κB[23]、STAT3[24]、TRPV4[25]、ADAM17[26]等蛋白介导在肺相关疾病中发挥作用。近年来,有人提出MMP9可能还与LRP1密切相关[27]。
LRP1目前在肺部疾病中的作用受到广泛关注,在人类全基因组关联研究中,LRP1 的单核苷酸多态性与人类肺功能相关[28],在平滑肌细胞中LRP1的失调影响基线肺功能和气道反应性[29];肺泡巨噬细胞上LRP1的表达介导其吞噬作用并调节炎症介质的释放[4];成纤维细胞中LRP1表达的失调可能导致收缩性肌成纤维细胞无限制扩张,从而导致纤维化的发展[30]。另外,有文献表明,LRP1与血管形成和新生血管有关[31]。LRP1通过蛋白水解从细胞表面脱落释放出sLRP1。sLRP1可促进巨噬细胞炎症介质的表达;还可竞争性结合细胞外蛋白,阻止它们的内吞作用[32]。本研究发现,肺组织匀浆中LRP1 mRNA 及LRP1 蛋白表达均增加;高氧组血清和BALF 中sLRP1 水平均较空气组升高,而我们前期临床研究中的BPD患儿血清sLRP1水平升高,这提示LRP1 在高氧诱导的肺损伤及BPD发病中可能具有重要作用。
本研究还发现LRP1 与MMP9 表达水平呈正相关,有研究认为LRP1不仅介导MMP9的内吞作用,还作为膜受体传递细胞内信号,诱导MMP9 表达[33]。但是LRP1 在高氧诱导肺损伤中调控MMP9的具体机制尚未清楚。
本研究结果显示,在高氧组中肺组织匀浆pPyk2 表达增加。Pyk2 在多种疾病中发挥重要作用:在气道高反应性疾病中,Pyk2 磷酸化水平升高,会导致囊性纤维化气道平滑肌功能异常[34];Pyk2 可通过激活缺氧诱导因子而加重肺动脉高压[35];在缺血再灌注后,Pyk2 激活原存活信号分子,防止活性氧过度增加,从而对缺血再灌注损伤起到保护作用[36]。Revuelta-López 等[13]证实了在缺氧相关的血管疾病中存在LRP1-pPyk2-MMP9信号通路,LRP1 可通过增加细胞内钙水平,上调富含脯氨酸的Pyk2磷酸化,诱导MMP9表达增加。其研究结果表明心肌梗死后心肌成纤维细胞LRP1水平在MMP9表达上调及心室重构相关机制中发挥重要作用[14],并强调 LRP1-pPyk2-MMP9 轴参与了血管细胞迁移过程[37]。
综上所述,本研究发现在高氧诱导新生大鼠肺损伤中,肺组织LRP1表达上调,Pyk2磷酸化水平增加,MMP9水平升高,提示LRP1-pPyk2-MMP9通路可能参与了BPD 的发病机制,但本文未对这条通路上下游行进一步干预研究,如基因敲除或过表达等,未来针对这条通路的研究可能为BPD的发病研究提供新的思路。
