肾上腺髓质素对高氧肺损伤的保护作用研究
2021-12-22张敏成利花殷晓桐罗好蔡成
张敏 成利花 殷晓桐 罗好 蔡成
(上海交通大学附属儿童医院/上海市儿童医院新生儿科,上海 200062)
多种因素导致支气管肺发育不良(bronchopulmonary dysplasia,BPD)的发生,目前已知与早产的相关性最强,肺泡发育受损是BPD的典型特征,但尚不清楚其具体的分子机制[1]。BPD 的病理过程包括氧化应激、炎症反应和细胞凋亡。Kuwasako 等[2]于 1993 年从人体嗜铬细胞瘤中分离并提取肾上腺髓质素(adrenomedullin,ADM),ADM 是一种血管活性多肽。ADM 具有舒张血管、利尿、排钾、拮抗肾上腺素系统及抑制血管平滑肌细胞迁移增殖等生物学作用[3]。肺是合成和代谢ADM 的主要场所,主要由平滑肌细胞和内皮细胞分泌,随着缺氧时间的延长,内皮细胞的损伤逐渐增加,ADM 的含量逐渐减少[4]。ADM 主要通过降钙素受体样受体(calcitonin receptor-like receptor,CRLR)发挥作用,而受体活性修饰蛋白(receptor activity-modifying proteins,RAMP) 1、2、3 会改变 CRLR 的反应性和亲和力[5]。例如 CRLR/RAMP1 形成 CGRP-I 或 CGRP-II应答细胞;RAMP2 或RAMP3 与CRLR 共同表达时可激发ADM 的反应性[6]。有研究通过新生小鼠实验证明,小鼠生后14 d 左右ADM、CRLR 及RAMP2 的表达量最多[7]。细胞外信号调节激酶(extracellular regulated kinase,ERK)能将多种细胞外信号通过磷酸化转到核内,激活转录活化,参与细胞的生长发育、增殖分化、细胞凋亡及细胞形态的维持[7]。ADM主要通过ERK1/2信号途径诱导肺血管内皮细胞的增殖,并促进其生长和存活,进而改善肺部血管的生成[8]。蛋白激酶B(protein kinase B,PKB)是一种丝氨酸/苏氨酸蛋白激酶,是信号转导的关键介质,PKB 通过转导细胞外信号调控细胞增殖、迁移、抗凋亡和维持代谢稳态等过程[9-10]。Kim 等[11]通过实验发现,在内皮细胞的质膜上,ADM 与CRLR/RAMP2 或CRLR/RAMP3 受体结合,激活PKB 信号通路,进而促进内皮细胞增殖、迁移和管状结构形成。
ERK/PKB 信号通路是 ADM 在 BPD 中发挥保护作用的关键通路,而ERK/PKB作为ADM通路下游的指标,在激活细胞增殖、减少氧化应激反应等过程中均发挥重要的调节作用,但具体的分子机制至今仍未完全阐明。假设ERK 和PKB 的表达受ADM 调控,就能深入了解ADM、ERK、PKB 在BPD 发生发展中的防御机制,为早产儿BPD 的防治提供新的理论依据及策略方向。故本研究旨在通过高氧暴露、沉默ADM 的表达探讨ERK 及PKB在人肺微血管内皮细胞(human pulmonary micro‐vascular endothelial cells,HPMEC)中的表达变化,为早产儿BPD 的发病机制与临床防治提供理论依据。
1 材料与方法
1.1 细胞和主要试剂
HPMEC[8,12-14]由 美 国 模 式 培 养 物 集 存 库(American type culture collection,ATCC)提供,产品目录号:CRL-3244。ADM 小分子干扰RNA(small interfering RNA,siRNA)和ADM 阴性对照siRNA 由上海捷瑞生物工程有限公司设计并合成。LipofectamineTM2000 购自美国 Life Technology 公司,TRIzol Reagent 购 自 美 国 Ambion 公 司 ,PrimeScriptTMRT reagent Kit (for real time) 及SYBR®Premix Ex Taq™ II(Tli RNaseH Plus) 均购自日本TAKARA公司。
1.2 HPMEC高氧暴露模型的建立与实验分组
将HPMEC接种于50 mL培养瓶中,待HPMEC在37℃、5%CO2饱和湿度培养箱中生长至接近融合状态时,随机分为空气组和高氧组。空气组仍置于5%CO2培养箱中培养;高氧组将贴壁纯化后的细胞加入新培养液后置于3 L/min 92%O2+5%CO2高纯混合气中培养[15-17],24 h后立即用封口胶密封培养瓶,置于37℃、5%CO2培养箱中培养,通氧前后观察细胞生长情况和形态变化,在培养结束时用CYS-1数字式测氧仪检测培养瓶中氧浓度,低于90%的标本弃去。
1.3 细胞转染
转染前24 h,在24 孔板中,每孔加入500 μL无抗完全培养基并接种0.5×105~2×105个细胞,待细胞融合度为80%~90%时进行转染。用250 μL无血清细胞培养基稀释1.5 μg 质粒DNA,轻轻吹吸3~5次混匀。轻轻颠倒混匀转染试剂,用250 μL无血清细胞培养基稀释5.0 μL LipofectamineTM2000,轻轻吹吸3~5 次混匀,室温下静置5 min。混合转染试剂和质粒DNA稀释液,轻轻吹吸3~5次混匀,室温下静置20 min。培养板上的细胞弃去培养基,加入不含血清和抗生素的DMEM 培养基500 μL,每孔细胞加上述500 μL 转染试剂和质粒DNA 混合液,轻轻摇晃混匀后,置于细胞培养箱37℃、5%CO2条件下培养4~6 h。取出培养板,小心吸去每孔液体后,加1 mL 新鲜的完全培养基,37℃、5%CO2条件下继续培养24~72 h。可在荧光显镜下观察和进行后续实验。
1.4 验证siRNA抑制ADM效果及可能机制
将细胞分为空白对照组、阴性对照组和ADM siRNA组,空白对照组未施加任何处理,阴性对照组和ADM siRNA 组细胞分别转染ADM 阴性对照siRNA 和 ADM siRNA 后,检测 ADM mRNA 及其蛋白的表达水平,观察siRNA对ADM的抑制效果。
将细胞分为未干扰组和干扰组,未干扰组未施加任何处理,干扰组细胞转染ADM siRNA 后,检测ADM、ERK1/2、PKB 的mRNA 及其蛋白表达水平。
1.5 RT-qPCR检测mRNA的表达水平
收集各组HPMEC,经不同的实验条件处理后,采用TRIzol 法根据说明书进行总RNA 的提取和鉴定。0.2 mL RNase free EP管中配制混合液,冰上操作。37℃ 15 min,85℃ 5 s,4℃ 60 min 得到的cDNA 加入180 μL ddH2O 稀释备用。可直接用于2nd-strand cDNA 的合成或PCR 扩增,-20℃保存。PCR 扩增时cDNA 的推荐最大使用量为原液1 μL。PCR管中配制PCR反应混合液,冰上操作。混匀,每个样品做3个重复对照。PCR反应条件:95℃预变性30 s;95℃ 5 s,60℃ 34 s,40~45个循环;解离曲线95℃15 s,60℃60 s,95℃15 s;上机扩增检测。利用2-ΔΔCt法计算相对表达量。引物由上海捷瑞生物工程有限公司设计并合成(表1)。实验独立重复3次。
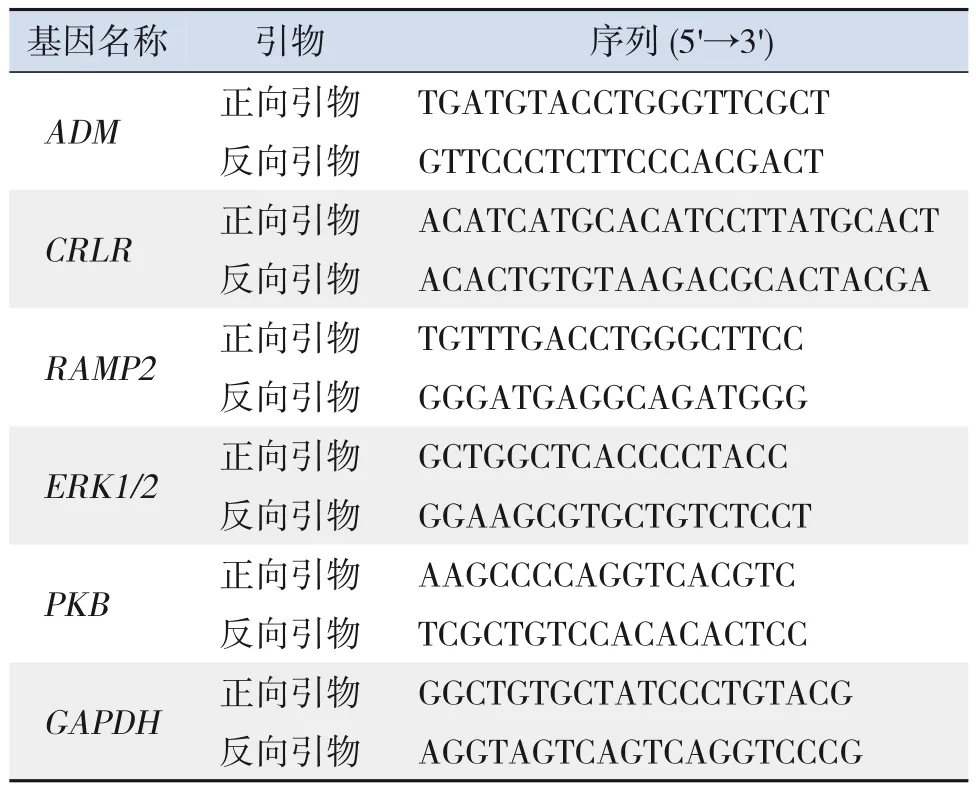
表1 引物序列
1.6 Western blot法检测蛋白的表达
细胞蛋白抽提及定量、SDS-PAGE电泳、蛋白质转移、蛋白质显像均按照试剂操作说明书进行。新鲜配制封闭液:在TBST 中加入脱脂奶粉至终浓度为5%(w/v),封闭时,将膜浸入到封闭液中,室温下振荡1 h;加入稀释好的一抗抗体,4℃过夜;TBST洗膜3次(每次5 min);加入稀释好的二抗抗体 (1∶5 000),室温1 h 振荡孵育;TBST 洗膜3次(每次5 min)。洗好膜以后,取出ECL发光试剂,取适量各溶液混合,将膜放入曝光仪器中,滴加发光液,曝光3次,每次5 min,选择3次曝光的重叠值。蛋白表达结果以目的蛋白与内参蛋白的比值表示。实验独立重复3次。
1.7 统计学分析
采用SPSS 23.0 统计软件对数据进行统计学分析,正态分布计量资料采用均值±标准差()表示,两组间比较采用两样本t检验;多组间比较采用单因素方差分析,组间两两比较采用SNK-q法。P<0.05为差异有统计学意义。
2 结果
2.1 空气组和高氧组中ADM及其相关信号通路分子表达
与空气组相比,高氧组ADM、CRLR、RAMP2、ERK1/2、PKB 的mRNA 及其蛋白表达均显著上调,两组间表达差异有统计学意义(P<0.05)。见表2~3和图1。
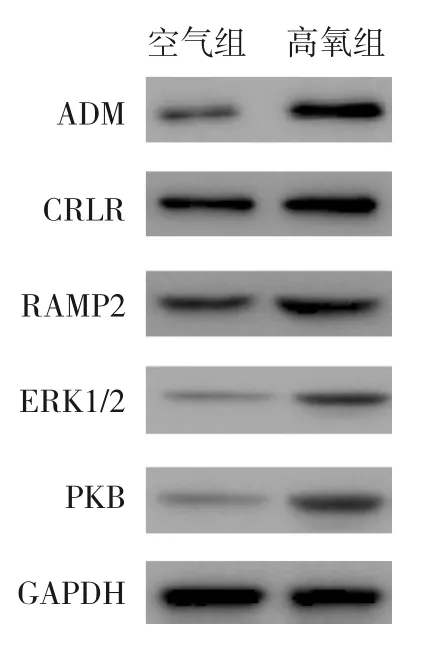
图1 Western blot法检测空气组和高氧组蛋白表达电泳图
表2 空气组和高氧组ADM及其相关信号通路分子的mRNA表达比较 ()
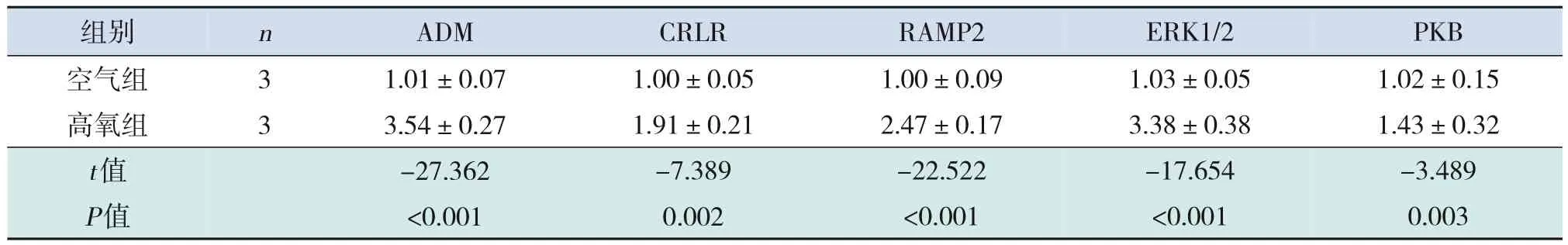
表2 空气组和高氧组ADM及其相关信号通路分子的mRNA表达比较 ()
注:[ADM]肾上腺髓质素;[CRLR]降钙素受体样受体;[RAMP2]受体活性修饰蛋白2;[ERK]细胞外信号调节激酶;[PKB]蛋白激酶B。
images/BZ_99_237_2840_496_2903.pngPKB 1.02±0.15 1.43±0.32-3.489 0.003 3 3images/BZ_99_496_2840_642_2903.pngimages/BZ_99_642_2840_962_2903.pngimages/BZ_99_962_2840_1282_2903.pngimages/BZ_99_1282_2840_1602_2903.pngimages/BZ_99_1602_2840_1923_2903.pngimages/BZ_99_237_3021_496_3139.png空气组高氧组images/BZ_99_496_3021_642_3139.pngimages/BZ_99_642_3021_962_3139.png1.01±0.07 3.54±0.27images/BZ_99_962_3021_1282_3139.png1.00±0.05 1.91±0.21images/BZ_99_1282_3021_1602_3139.png1.00±0.09 2.47±0.17images/BZ_99_1602_3021_1923_3139.png1.03±0.05 3.38±0.38
表3 空气组和高氧组ADM及其相关信号通路分子的蛋白表达比较 ()
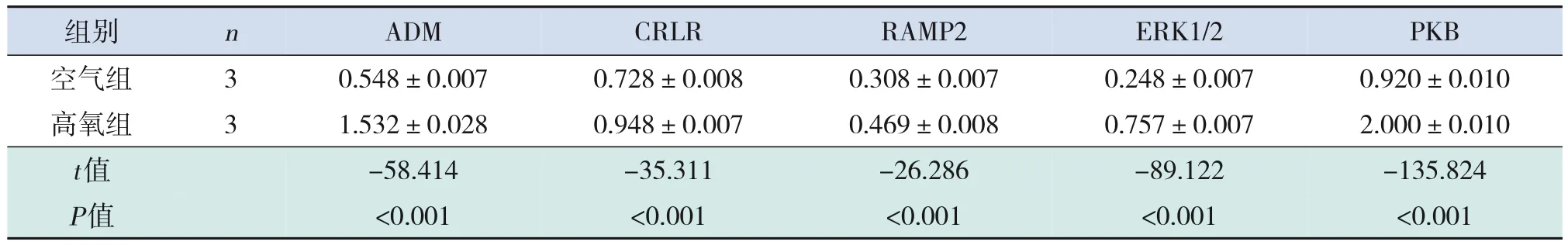
表3 空气组和高氧组ADM及其相关信号通路分子的蛋白表达比较 ()
注:[ADM]肾上腺髓质素;[CRLR]降钙素受体样受体;[RAMP2]受体活性修饰蛋白2;[ERK]细胞外信号调节激酶;[PKB]蛋白激酶B。
images/BZ_100_237_414_455_476.pngPKB 0.920±0.010 2.000±0.010-135.824<0.001 3 3images/BZ_100_455_414_596_476.pngimages/BZ_100_596_414_926_476.pngimages/BZ_100_926_414_1255_476.pngimages/BZ_100_1255_414_1584_476.pngimages/BZ_100_1584_414_1914_476.pngimages/BZ_100_237_594_455_712.png空气组高氧组images/BZ_100_455_594_596_712.pngimages/BZ_100_596_594_926_712.png0.548±0.007 1.532±0.028images/BZ_100_926_594_1255_712.png0.728±0.008 0.948±0.007images/BZ_100_1255_594_1584_712.png0.308±0.007 0.469±0.008images/BZ_100_1584_594_1914_712.png0.248±0.007 0.757±0.007
2.2 空白对照组、阴性对照组、ADM siRNA 组ADM表达变化
空白对照组(1.026±0.067)、阴性对照组(1.082±0.090)、 ADM siRNA 组 (0.158±0.019)ADMmRNA 比较差异有统计学意义(F=561.702,P<0.001);空白对照组(1.088±0.091)、阴性对照组 (0.969±0.078)、 ADM siRNA 组 (0.554±0.069) ADM 蛋白比较差异有统计学意义(F=36.998,P<0.001)。与空白对照组、阴性对照组相比,ADM siRNA 组ADMmRNA 及其蛋白表达水平均显著下降(P<0.05)。见图2。

图2 Western blot 法检测空白对照组、阴性对照组、ADM siRNA组ADM 蛋白表达电泳图
2.3 未干扰组和干扰组ADM、ERK1/2 及PKB 表达变化
与未干扰组相比,干扰组ADM、ERK1/2、PKB的mRNA及其蛋白表达均明显下降(P<0.05)。见表4~5和图3。
表4 未干扰组和干扰组ADM、ERK及PKB的mRNA表达比较 ()
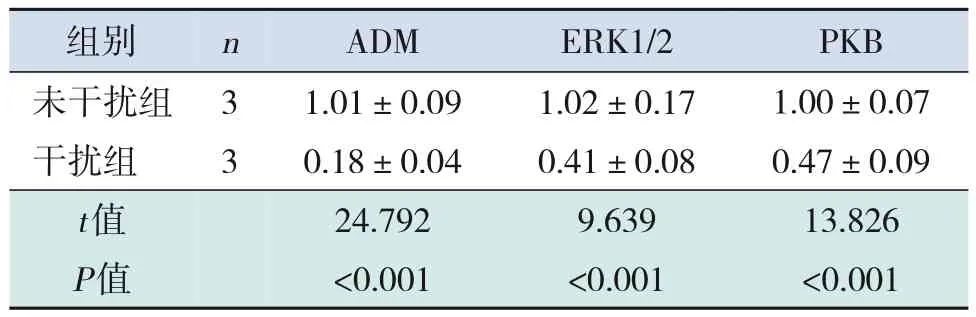
表4 未干扰组和干扰组ADM、ERK及PKB的mRNA表达比较 ()
注:[ADM]肾上腺髓质素;[ERK]细胞外信号调节激酶;[PKB]蛋白激酶B。
1.00±0.07 0.47±0.09images/BZ_100_1284_1432_1469_1495.pngimages/BZ_100_1469_1432_1541_1495.pngimages/BZ_100_1541_1432_1775_1495.png3 3images/BZ_100_1775_1432_2009_1495.pngimages/BZ_100_2009_1432_2243_1495.pngimages/BZ_100_1284_1613_1469_1731.png未干扰组干扰组images/BZ_100_1469_1613_1541_1731.pngimages/BZ_100_1541_1613_1775_1731.png1.01±0.09 0.18±0.04images/BZ_100_1775_1613_2009_1731.png1.02±0.17 0.41±0.08images/BZ_100_2009_1613_2243_1731.png
表5 未干扰组和干扰组ADM、ERK及PKB的蛋白表达比较 ()
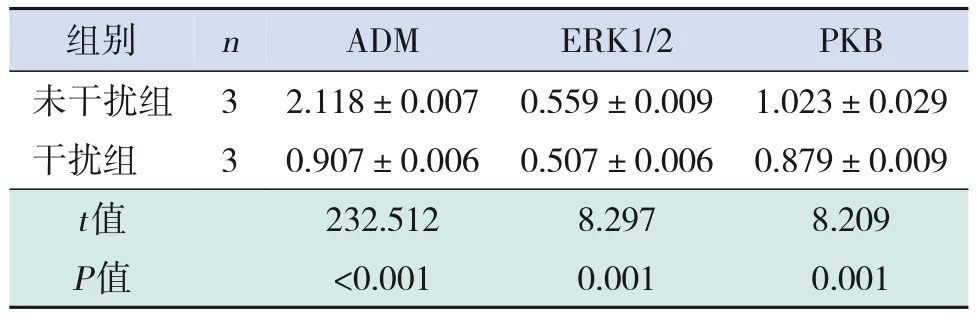
表5 未干扰组和干扰组ADM、ERK及PKB的蛋白表达比较 ()
注:[ADM]肾上腺髓质素;[ERK]细胞外信号调节激酶;[PKB]蛋白激酶B。
1.023±0.029 0.879±0.009images/BZ_100_1284_2043_1469_2105.pngimages/BZ_100_1469_2043_1541_2105.pngimages/BZ_100_1541_2043_1775_2105.png3 3images/BZ_100_1775_2043_2009_2105.pngimages/BZ_100_2009_2043_2243_2105.pngimages/BZ_100_1284_2223_1469_2341.png未干扰组干扰组images/BZ_100_1469_2223_1541_2341.pngimages/BZ_100_1541_2223_1775_2341.png2.118±0.007 0.907±0.006images/BZ_100_1775_2223_2009_2341.png0.559±0.009 0.507±0.006images/BZ_100_2009_2223_2243_2341.png

图3 Western blot 法检测未干扰组和干扰组ADM、ERK及PKB蛋白表达电泳图
3 讨论
随着现代医学的进步,氧疗已成为治疗早产儿的关键措施。氧气作为一种环境刺激,在肺的发育过程中发挥重要调节作用。但长期暴露于高氧环境会影响肺的发育,造成不可逆的损伤。目前BPD 发病率逐年增加。相关研究表明多种原因导致BPD的发生,但主要是活性氧(reactive oxy‐gen species,ROS) 和高氧环境的共同作用[18],肺泡和肺部血管生长停滞是BPD 的主要特征[19]。Wang 等[18]指出患有 BPD 的早产儿预后较差,呼吸道感染的概率大且再次入院率高,视网膜病变、学习障碍和高血压的风险也相对较高;另外随着年龄的增长,肺功能会逐渐下降。
本研究以高氧暴露下HPMEC 为细胞模型研究对象,研究中选用高氧暴露作为诱导损伤,这与大多数住院早产儿生后需要氧疗相一致。目前永生化的肺泡Ⅱ型上皮细胞(alveolar epithelialtypeⅡcell,AECⅡ)尚未建立,原代培养的AECⅡ不稳定,并不适合进行基因转染。人类HPMEC 是从人类肺组织中分离的微血管内皮细胞,保留了内皮细胞的许多特征。内皮细胞可介导血液和组织之间的相互作用,在血管生成、血流调节、血管通透性、伤口愈合、炎症、动脉粥样硬化和转移中发挥重要作用[20]。因此本研究选择HPMEC为研究对象,其原因是:(1)其增殖和成熟在肺泡的形成及肺的生长过程中起重要作用;(2)其功能障碍与BPD 发病密切相关;(3)ADM 及其信号受体在动脉内皮细胞中表达丰富[8]。
RNA干扰是一种进化保守的过程,在转录后,特定基因的表达被一种siRNA抑制,siRNA识别互补mRNA 并诱导其降解。目前,RNA 干扰被广泛用于抑制特定基因的表达,以达到实验和治疗的目的。在本研究中,暴露在高氧环境中ADM、CRLR、RAMP2、ERK1/2、PKB的mRNA及其蛋白表达显著增加;用siRNA 抑制ADM 后,ERK1/2与PKB的mRNA及其蛋白表达均显著下降;由此推测ERK1/2、PKB 可能为ADM 信号通路下游靶点,共同参与BPD的保护过程。
在本细胞研究模型中,与空气组相比,高氧组 ADM、CRLR 及 RAMP2 的 mRNA 及其蛋白表达均显著上调;与未干扰组相比,干扰组ADM mRNA 及其蛋白表达均明显下降。ADM 主要通过CRLR发挥作用,而RAMP2可改变CRLR的反应性和亲和力[6]。类似地,Menon 等学者[8]分别于生后3、7、14、28 d 取空气呼吸(常氧)小鼠肺组织发现,ADM 在生后14 d 的表达水平最高;然后将1日龄的野生型小鼠随机分为两组,分别暴露在常氧或高氧中14 d,高氧组小鼠在空气中恢复14 d,恢复期后在生后28 d检测,发现高氧暴露小鼠的径向肺泡计数显著降低,平均线性截距显著升高,表明与常氧暴露小鼠相比,高氧暴露小鼠肺泡数量减少,直径增大。上述结果表明高氧可刺激ADM 的产生,并且ADM 的受体CRLR 和受体活性修饰蛋白RAMP2表达相应升高,提示ADM参与高氧诱导肺损伤的过程,并可能通过改善肺泡的形成在高氧肺损伤中发挥保护作用。
在本研究中,高氧组中ERK 的mRNA 及其蛋白表达均明显高于空气组;用siRNA 抑制ADM 表达后,ERK 的mRNA 及其蛋白表达均明显下降;ERK1/2与ADM的表达大致呈正相关。ERK级联反应是传递细胞外因子信号的中枢通路,调控细胞增殖、分化和细胞周期等过程[21]。类似地,Semplicini 等[22]发现 ADM 可刺激肾上腺球状带细胞中ERK1和ERK2的磷酸化、显著增加ERKs的活性,从而增强大鼠肾上腺球状带细胞的增殖。也有研究发现ADM 通过激活MAPK/ERK 下游信号通路,可能是由于转录调节因子Prospero相关同源异形盒蛋白1诱导CRLR基因的表达,直接促进内皮细胞的生长和生存[23]。在肾透明细胞腺癌细胞(786-0)转染ADM siRNA 后,ADM 的表达水平显著降低,且细胞增殖能力、体外迁移和侵袭能力均受抑制;ADM 可显著提高786-0 细胞内磷酸化ERK1/2(p-ERK1/2)水平,用不同浓度ADM 处理786-0细胞后,p-ERK1/2水平无显著差异,但当用ADM 受体拮抗剂(ADM22-52)或MAPK 抑制剂(PD98059) 阻断 ADM-ERK 通路时,p-ERK1/2 表达降低[24]。综上所述,在两种不同的实验条件下,ADM 与ERK 的表达趋势均一致,由此我们推测高氧可刺激ADM 的产生,ADM 靶向于ERK 信号通路,通过激活ERK1/2 后在高氧肺损伤中发挥保护作用。
在本研究中,暴露在高氧环境下,PKB 的mRNA 及其蛋白表达均升高,且PKB 与ADM 的表达大致呈正相关;与未干扰组相比,干扰组PKB的mRNA及其蛋白表达均明显下降。磷脂酰肌醇3激酶(phosphoinositide 3 kinase,PI3K)及其下游靶向激酶PKB 在调节细胞功能中发挥重要作用。PKB 通过磷酸化和调节其他激酶、转录因子和其他细胞内调节蛋白的功能来影响细胞的活性[25]。Nishimatsu 等[26]发现 ADM 以时间依赖和剂量依赖的方式诱导PKB 磷酸化,这种磷酸化是Ca2+/钙调蛋白通路介导的,而PI3K/PKB 通路在血管内皮中发挥维持血管张力、减少细胞凋亡及死亡、修复内皮和调节血管生成等多种生物学作用。但Gao等[24]发现用ADM 处理786-0 细胞后,磷酸化PKB水平未显著升高。大量研究表明转录因子核因子-E2 相关因子 2 (nuclear factor-E2-related factor 2,Nrf2)/抗 氧 化 反 应 元 件 (antioxidant response element,ARE)是机体内重要的抗氧化信号通路,而PI3K/PKB 通路在Nrf2 的磷酸化过程中发挥重要作用[27-29]。由此推测Nrf2/ARE 信号通路可能参与ADM 保护高氧肺损伤的过程,但尚不清楚其具体机制。综上所述,PKB 与ADM 的表达大致呈正相关,我们由此推测高氧环境中会增加ADM的产生,而ADM 靶向于PKB 信号通路,通过激活PKB 后在BPD中发挥保护作用。
综上所述,高氧诱导BPD 的发生,ADM 是机体一种重要的活性肽,ERK/PKB 作为ADM 通路下游的靶点,ADM 可能通过调控CRLR/RAMP2 介导ERK/PKB 信号通路,在激活细胞增殖、减少氧化应激反应等过程中均发挥重要的调节作用,从而对BPD发挥保护作用。
本研究仍存在部分局限性,虽然ADM与ERK/PKB 信号通路存在正向调节作用,但我们尚未完全阐明其正向调控作用的具体机制,有待于进一步研究探讨。
