2种零维碳材料对Li-Mg-B-H体系储氢性能的影响
2021-12-22彭丹丹韩树民
彭丹丹,张 瑛,韩树民
(1.中国石油大学(北京)理学院,北京 102249;2.中国石油大学(北京)新能源与材料学院,北京 102249;3.燕山大学 环境与化学工程学院,河北 秦皇岛 066004)
氢能由于具有体积能量密度高、质量能量密度高、对环境无害等优点,已成为一种极具潜力的可替代传统化石能源的能量载体。对于氢能的开发,近些年一些研究人员已经做过很多尝试,但是如何开发一种安全、廉价和轻质的储氢材料仍旧是一个不小的难题[1-2]。近年来,轻质金属配位氢化物得到了广泛的关注,在这一系列的配位金属氢化物中,Li-Mg-B-H体系因质量储氢密度高(质量分数11.5%)、放氢路径简单以及良好的吸放氢可逆性成为研究的热点。然而,单纯的2LiBH4-MgH2复合储氢材料仍然存在着放氢温度高、放氢动力学性能差、可逆吸氢条件苛刻等缺点,严重限制了其在未来车载储氢中的应用和发展[3]。近几年,为了改善Li-Mg-B-H体系的储氢性能,研究人员以不同角度为切入点对其进行了改进,例如:添加催化剂[4-5],研究发现,过渡金属基催化剂由于其优良的电导性,有效缩短Li-Mg-B-H体系第二步放氢潜伏期等优点,对复合储氢材料的动力学性能有很大程度的提升[6]。研究还发现[7],引入多孔碳材料对于提升Li-Mg-B-H体系的放氢动力学也有积极的推动作用。然而,即使研究人员对Li-Mg-B-H体系的吸/放氢性能的提高做了很多研究,但是其距离车载氢能储氢复合材料的性能要求目标还有很大的距离。
近年来,为了进一步提高Li-Mg-B-H体系的吸放氢速率和吸氢可逆性,研究人员已经尝试应用了很多方法。各国学者通过引入不同种类的碳材料与镁基储氢材料进行复合,制备均匀分散的纳米镁基粒子。Imamura等[8]首次在镁基体系中引入石墨烯,得到的复合储氢材料的储氢性能有很大提高。近几年,多壁碳纳米管[9]、单壁碳纳米管[10]、活性炭[11]也被科研人员证明可以显著促进镁基储氢材料的吸/放氢性能。尽管碳材料的添加可以在一定程度上促进镁基体系中镁粒子的动力学及热力学性能,但是其经过多次循环反应后仍然会不可避免发生团聚现象。余学斌课题组Xia等[12]通过利用叔丁基镁以及石墨烯作为初始原料,利用自组装的方法使纳米镁基粒子均匀分散在石墨烯表层上,得到的MgH2/GR复合储氢材料表现出优异的吸/放氢性能,而且经过多次的吸/放氢循环后,其仍保持良好的循环性能。随后余学斌课题组Xia等[13]又进一步在制备的镁基材料的基础上,通过浸渍法引入LiBH4构建Li-Mg-B-H体系,构建的复合储氢材料的吸放氢性能得到了进一步提高。
笔者依据国内外Li-Mg-B-H体系的研究概况,以添加碳材料为切入点,致力于改善Li-Mg-B-H体系储氢性能的不足。以金属镁粉为初始原料,引入2种不同表面微观形貌的零维碳球材料,通过氢化燃烧的方法制备了高活性的镁基复合材料;然后进一步利用高能球磨的方法将其与LiBH4球磨复合,构建复合储氢材料 2LiBH4-MgH2@C。通过对2LiBH4-MgH2@C复合储氢材料的表征及测试,深入研究2种零维碳材料的添加对复合储氢体系性能的改善作用,并系统的探讨了其作用机理和反应机制。
1 实验部分
1.1 原料与仪器
原料:蔗糖(AR)、间苯二酚(AR)、甲醛水溶液(质量分数不小于37.0%)、碳酸钠(质量分数不小于99.5%)、司盘80 (AR)、金属Mg粉(质量分数99.5%)、LiBH4(质量分数95%),均为阿拉丁试剂(上海)有限公司产品;二氧化碳气体(体积分数不小于99.999%)、氢气(体积分数不小于99.999%)、氩气(体积分数不小于99.999%),均由秦皇岛开发区稀有气体开发部提供。
仪器:鼓风干燥箱,DHG-7090A,圣欣科学仪器公司产品;离心机,LG10-2.4A,北京京立公司产品;管式炉,SK-G05123K,天津市中环实验电炉公司产品;球磨机,Planetary Fritsch-Pulverisette 6,德国FRITSCH福里茨产品;手套箱,STX-3,南京大冉科技有限公司产品;PCT测试仪,Sievert,北京有色金属研究院产品。
1.2 2种不同形貌零维碳材料的制备
采用两步碳化法以及反相乳液聚合法制备了2种不同尺寸、不同表面形貌的零维碳材料。
首先以蔗糖为碳源,配制摩尔浓度为0.2 mol/L的蔗糖溶液,采用溶剂热法在鼓风干燥箱中190 ℃下反应5 h,自然冷却至室温后离心、过滤、洗涤、干燥,然后进一步在管式炉中高温碳化,950 ℃恒温处理4 h,冷却至室温,即得到零维结构的硬质碳球材料,标注为HCS。
采用反相乳液聚合法制备得到零维结构的碳气凝胶微球,以间苯二酚(R)和甲醛(F)为前驱体,按照摩尔比nR∶nF=2∶1的比例溶解在去离子水中,以碳酸钠为催化剂、司盘80作为乳化剂在40 ℃温度下搅拌40 h,然后离心、过滤、洗涤,最后用二氧化碳气体对其进行活化、扩孔处理[14],所得到的零维碳气凝胶微球标注为CA。
1.3 复合储氢材料的制备
将金属Mg粉分别与2种零维碳材料(HCS、CA)按照质量比5∶1的比例混合,在400 ℃以及4 MPa的氢压环境下氢化40 h后自然冷却至室温,初步得到MgH2@HCS、MgH2@CA镁基复合储氢材料。然后将制备得到的镁基复合储氢材料与LiBH4按照摩尔比1∶2进行球磨复合,构建Li-Mg-B-H体系,标记为2LiBH4-MgH2@HCS以及2LiBH4-MgH2@CA。为了进一步研究碳材料对Li-Mg-B-H体系储氢性能的影响,在相同条件下制备了纯的2LiBH4-MgH2参比样品。制备过程中所有样品的球磨时间均为5 h,球料质量比为30∶1,球磨机的转速设置为450 r/min,样品转移以及保存时都需要在手套箱(STX-3)中进行,避免样品被氧化。
1.4 复合储氢材料的结构表征及性能测试
复合储氢材料的吸/放氢性能主要利用Sievert校正的PCT (压力-组成-温度,北京有色金属研究院生产)测试仪测试。储氢材料的吸氢性能测试均在3 MPa的氢气压力下进行,放氢性能测试需要在设定温度下初始氢压为0.2 MPa的条件下进行。采用Rigaku Smaratlab型的X射线衍射仪(日本理学株式会社产品)研究储氢材料吸/放氢过程中物相的变化,测试角度为5°~90°,步长为0.02°,测试速率为4 °/min。采用S-4800型扫描电子显微镜(日本日立公司产品,测试电压为15~20 kV)观察零维碳材料以及复合储氢材料表面微观形貌。采用差热分析仪(DTG-60A,日本岛津公司)分析储氢材料的放氢热力学性能,测试温度范围为25~600 ℃,均采用4种不同的升温速率:5、10、15、20 ℃/min,测试过程中需辅以流动的氩气进行保护,防止测试中样品出现氧化现象。
2 结果与讨论
2.1 2LiBH4-MgH2@HCS/CA复合储氢材料结构表征
图1为2LiBH4-MgH2@HCS以及2LiBH4-MgH2@CA复合储氢材料球磨后的XRD图谱。从图1可以看出:添加了2种零维碳材料的复合储氢材料的XRD图谱基本一致,说明不同碳材料的添加并没有改变球磨后样品的相组成;球磨后2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA复合储氢材料样品的主相均为LiBH4和MgH2,同时,在2种复合储氢材料的XRD图谱上均有1个微弱的MgO衍射峰,这主要是因为在进行XRD测试过程中,复合储氢材料样品短暂的暴露在空气中引起的氧化所导致的[15]。此外,2种复合储氢材料的XRD图谱中均没有显示其他产物生成,说明在球磨过程中,LiBH4与MgH2@CA和MgH2@HCS均没有发生化学反应,只是简单地机械混合。2种复合储氢材料的XRD中并没有显示出2种零维碳材料(HCS、CA)的衍射峰,这是由于复合材料的XRD衍射峰经过归一化处理,而碳材料的衍射峰强相对于Mg和MgH2的而言太弱。此外,添加的零维碳材料为无定形态,所以在XRD图谱中并没有展现明显碳材料的衍射峰。

图1 球磨后2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA的XRD图谱Fig.1 XRD patterns of the 2LiBH4-MgH2@HCS and 2LiBH4-MgH2@CA after ball milling
为证明2种零维碳材料对复合储氢材料在动力学和热力学性能改善中的作用,对复合储氢材料进行SEM微观形貌分析,2LiBH4-MgH2、2LiBH4-MgH2@HCS、2LiBH4-MgH2@CA复合储氢材料在吸/放氢前后的SEM照片和2LiBH4-MgH2@CA 的EDX能谱图如图2、图3所示。从图2可以明显看出:2LiBH4-MgH2复合储氢材料在多次吸/放氢循环后出现了严重的团聚现象,团聚粒子尺寸从最初500 nm增大到1 μm左右;添加了零维碳材料的2LiBH4-MgH2@HCS、2LiBH4-MgH2@CA复合储氢材料经过多次吸/放氢后的形貌基本没有发生改变,说明2种零维碳材料在复合储氢体系中起机械支撑的作用。结合球磨后2LiBH4-MgH2@CA的EDX能谱分布图(见图3),可以看到C、B、O、Mg元素分散均匀,表明球磨后MgH2粒子以及LiBH4粒子均匀负载在碳材料上,由此表明2种零维碳材料的添加均有利于储氢粒子的附着与分散,而且2种复合储氢材料经过多次的吸/放氢循环后均能够保持完整的球形形貌,说明2种零维碳材料的添加均在复合储氢材料吸/放氢过程中对MgH2储氢粒子以及LiBH4储氢粒子起到了积极的分散作用。

图2 5次吸/放氢循环前后2LiBH4-MgH2、2LiBH4-MgH2@HCS、2LiBH4-MgH2@CA样品的SEM照片Fig.2 SEM images of pure 2LiBH4-MgH2, 2LiBH4-MgH2@HCS and 2LiBH4-MgH2@CA samples before and after 5 cycles of hydrogen absorption and desorption(a1),(b1),(c1)—2LiBH4-MgH2,2LiBH4-MgH2@HCS and 2LiBH4-MgH2@CA samples before hydrogen absorption and desorption;(a2),(b2),(c2)—2LiBH4-MgH2,2LiBH4-MgH2@HCS and 2LiBH4-MgH2@CA samples after 5 cycles hydrogen absorption and desorption
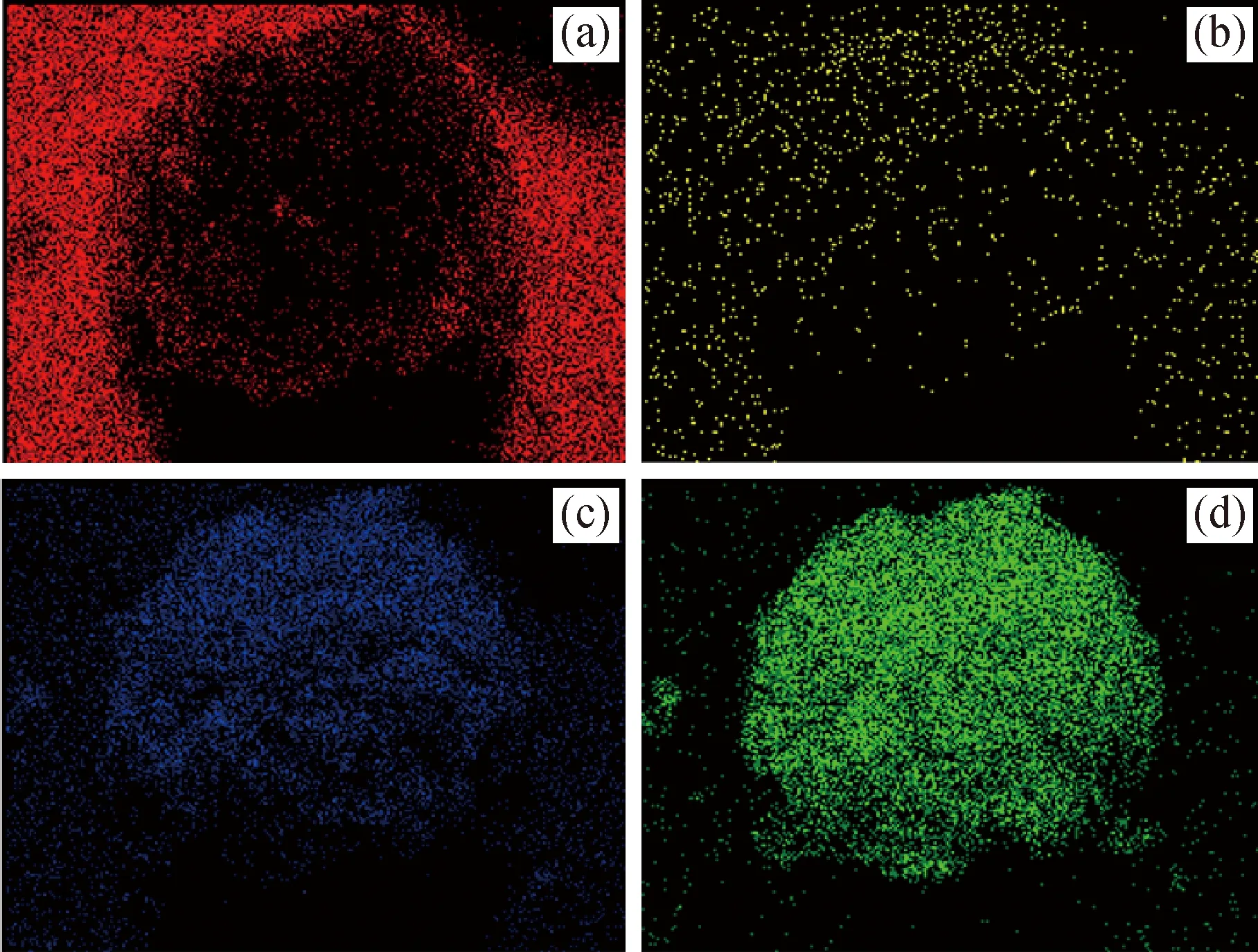
图3 球磨后2LiBH4-MgH2@CA样品的EDX元素分布图Fig.3 The EDX elemental mapping of 2LiBH4-MgH2@CA sample after ball milling(a)C;(b)B;(c)O;(d)Mg
2.2 2LiBH4-MgH2@HCS/CA复合储氢材料的热力学性能
通过程序升温放氢(TPD)测试研究了2LiBH4-MgH2、2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA复合储氢材料的放氢热力学性能,结果如图4所示。从图4可以看出:相对于未添加的2LiBH4-MgH2复合储氢材料,添加了2种零维碳材料的复合储氢材料的初始放氢温度均有所降低;2LiBH4-MgH2复合储氢材料在395 ℃左右开始放氢,而2LiBH4-MgH2@HCS复合储氢材料在340 ℃左右就开始放氢,相对于2LiBH4-MgH2复合储氢材料降低了55 ℃;2LiBH4-MgH2@CA复合储氢材料在100 ℃就开始缓慢放氢,相对于2LiBH4-MgH2复合储氢材料降低了295 ℃,其初始放氢温度大大降低。就放氢容量而言,2LiBH4-MgH2复合储氢材料的放氢容量为8.1%(质量分数,下同),而2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA这2种复合储氢材料的放氢容量都达到了9.1%左右,表明2种零维碳材料的添加不仅降低了储氢体系的初始放氢温度,还进一步提高了复合储氢体系的放氢容量,说明2种零维碳材料的添加对Li-Mg-B-H储氢体系的放氢性能均起到了积极作用。而且球形结构的碳气凝胶微球对Li-Mg-B-H体系的放氢容量性能的改善更为明显,主要归因于制备得到的零维碳气凝胶微球CA经过了CO2的活化过程,其比表面积进一步增大,提高了储氢颗粒的负载率[16],所以添加的零维碳气凝胶型材料CA比零维硬质碳球材料HCS表现出更优异的性能。

图4 2LiBH4-MgH2、2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA复合储氢材料程序升温放氢(TPD)曲线Fig.4 TPD curves of 2LiBH4-MgH2,2LiBH4-MgH2@HCS and 2LiBH4-MgH2@CA samples
活化能Ea按照公式(1)进行计算。Li-Mg-B-H体系放氢过程的总反应方程式如式(2)所示,但研究发现,实际的放氢过程是分步进行的,第一步MgH2的分解放氢过程如式(3)所示;第二步如式(4)所示,为LiBH4与前期放氢产物单质Mg进一步反应的放氢过程。这种分步放氢方式改变了单纯的LiBH4的放氢反应路径,生成LiH和MgB2,同时产生H2。其中MgB2的形成是LiBH4实现可逆的必要条件,也是整个Li-Mg-B-H体系放氢过程的决速步骤。
dln(α/Tm2)/d(1/Tm)=-Ea/R
(1)
式中:α代表升温速率,K/min;Tm代表放氢峰温度(热力学温度),K;R为摩尔气体常数,J/(mol·K)。
2LiBH4+MgH2→2LiH+MgB2+4H2↑
(2)
MgH2→Mg+H2↑
(3)
2LiBH4+Mg→2LiH+MgB2+3H2↑
(4)
图5为2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA复合储氢材料在不同升温速率5、10、15、20 ℃/min下的热重差热曲线及对其活化能的拟合曲线。从图5可以看出:2种复合储氢材料在400和450 ℃左右出现的最大放氢峰分别为第一步MgH2的分解放氢和第二步LiBH4的放氢过程。在第二步的放氢反应过程中LiBH4的最大放氢峰值温度分别为418、434、443以及452 ℃,活化能拟合计算得到放氢活化能为146.4 kJ/mol,和作者所在课题组以前实验测试计算得到的纯LiBH4的放氢活化能(156.7 kJ/mol)[17]相比,降低了约10.3 kJ/mol。2LiBH4-MgH2@CA复合储氢材料LiBH4的放氢峰值温度分别为416、433、444以及452 ℃,放氢反应活化能为144.2 kJ/mol,相较纯LiBH4的放氢活化能降低了约12.5 kJ/mol-1[17]。实验表明,2种零维碳球材料均能够使纯Li-Mg-B-H储氢体系的活化能降低,说明这2种零维碳材料与金属镁粉氢化燃烧过程原位生成的MgH2粒子比未加零维碳材料氢化的MgH2活性更高。在Li-Mg-B-H储氢体系中,经过第一步放氢反应生成的Mg粒子能更好的与LiBH4反应,有利于中间产物MgB2的成核及生长;同时零维碳材料的存在抑制了储氢粒子在吸/放氢过程中的团聚现象,进而有利于2种复合储氢材料放氢性能的提升。2种添加了零维碳材料复合储氢材料的初始放氢温度虽然有所不同,但是零维碳材料的添加对2种复合储氢材料放氢反应活化能的影响差别较小,说明不同表面形貌的碳材料虽然在放氢温度方面对储氢性能的影响差别较大,但是总体的反应活化能方面影响差别较小。
2.3 2LiBH4-MgH2@HCS/CA复合储氢材料的动力学性能
从动力学角度进一步分析零维碳材料的添加对Li-Mg-B-H体系储氢性能的影响,结果如图6所示。由图6可知,在400 ℃的条件下,2LiBH4-MgH230 min内的放氢容量达到2.1%,而2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA复合储氢材料相同时间内的放氢容量分别达到了4.5%和5.5%,说明2种零维碳材料的添加对Li-Mg-B-H体系的放氢性能均有积极的促进作用。从图6(b1)的等温吸氢曲线可以看出,2LiBH4-MgH230 min内的吸氢容量为3.5%,而2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA复合储氢材料30 min内的吸氢容量均能达到5.3%左右。进一步降低吸放氢温度,研究温度对储氢性能的影响,发现:在350 ℃的条件下,2LiBH4-MgH2的放氢动力学明显低于2种添加了零维碳材料的复合储氢材料,2LiBH4-MgH2在60 min内的放氢容量为1.8%,而2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA复合储氢材料在相同时间内的放氢容量分别达到3.3%和4.1%左右。从图6 (b2)的等温吸氢曲线可以看出,2种添加零维碳材料的2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA复合储氢材料的吸氢速率及吸氢容量均比2LiBH4-MgH2高,而且350 ℃条件下2种添加零维碳材料的复合储氢材料的吸氢速率虽然差别不大,但是在吸氢容量上表现出较400 ℃条件下更为明显的差别。以上研究结果说明,2种添加了零维碳材料的复合储氢材料的放氢速率及放氢容量均比2LiBH4-MgH2优异,尤其在低温放氢及低温吸氢过程中,2种零维碳材料的添加对Li-Mg-B-H 体系的改善表现更为突出。

k—The reaction rate coefficient图5 2LiBH4-MgH2@HCS、2LiBH4-MgH2@CA复合储氢材料样品的DTA曲线和在不同升温速率下的活化能拟合曲线Fig.5 DTA curves of pure 2LiBH4-MgH2@HCS and 2LiBH4-MgH2@CA after ball milling,Kissinger plots of the dehydrogenation of 2LiBH4-MgH2@HCS and 2LiBH4-MgH2@CA composite(a1),(a2)—Pure 2LiBH4-MgH2@HCS;(b1),(b2)—2LiBH4-MgH2@CA

图6 复合储氢材料样品在不同温度下等温放氢和等温吸氢曲线Fig.6 Isothermal hydrogen desorption profiles and hydrogen adsorption profiles of 2LiBH4-MgH2, 2LiBH4-MgH2@HCS and 2LiBH4-MgH2@CA at 400 ℃ and 350 ℃(a1)(a2)Isothermal hydrogen desorption profiles of 2LiBH4-MgH2,2LiBH4-MgH2@HCS and 2LiBH4-MgH2@CA at 400 and 350 ℃,respectively;(b1)(b2)Isothermal hydrogen adsorption profiles of 2LiBH4-MgH2,2LiBH4-MgH2@HCS and 2LiBH4-MgH2@CA at 400 and 350 ℃,respectively
2.4 2LiBH4-MgH2@HCS/CA复合储氢材料循环稳定性能
400 ℃时,2LiBH4-MgH2,2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA 3种复合储氢材料在5次吸/放氢循环过程的吸氢容量变化(以第1次的吸氢容量作为参比对照,设置氢气质量分数为100%)如图7所示。从图7可以看出,在经过5次吸/放氢循环后,2LiBH4-MgH2复合储氢材料的吸氢容量保持率为58.8%(质量分数,下同),说明储氢粒子在吸/放氢循环过程中会随着循环次数的增多出现团聚现象,由于储氢粒子与氢气接触的不完全性,导致2LiBH4-MgH2复合储氢材料的吸/放氢性能均有所降低。而2LiBH4-MgH2@HCS复合储氢材料的吸氢容量保持率为85.7%,2LiBH4-MgH2@CA复合储氢材料的吸氢容量保持率为88.6%,分别为2LiBH4-MgH2的1.4及1.5倍。以上研究结果说明:CA在吸放氢循环过程中展现出比HCS更好的分散性能,同时CA在制备过程中经过了活化扩孔处理,比表面积大,能够在反应过程中为储氢粒子提供更多的接触位点,有利于储氢粒子的锚定,进而与氢气接触反应,减少团聚现象;同时也提供了更多的孔结构缩短了放氢反应路径,有利于氢气的扩散。总之,2种添加了零维碳材料的复合储氢材料表现出较2LiBH4-MgH2更为优异的吸氢容量保持率,展现出更优异的吸/放氢循环稳定性。
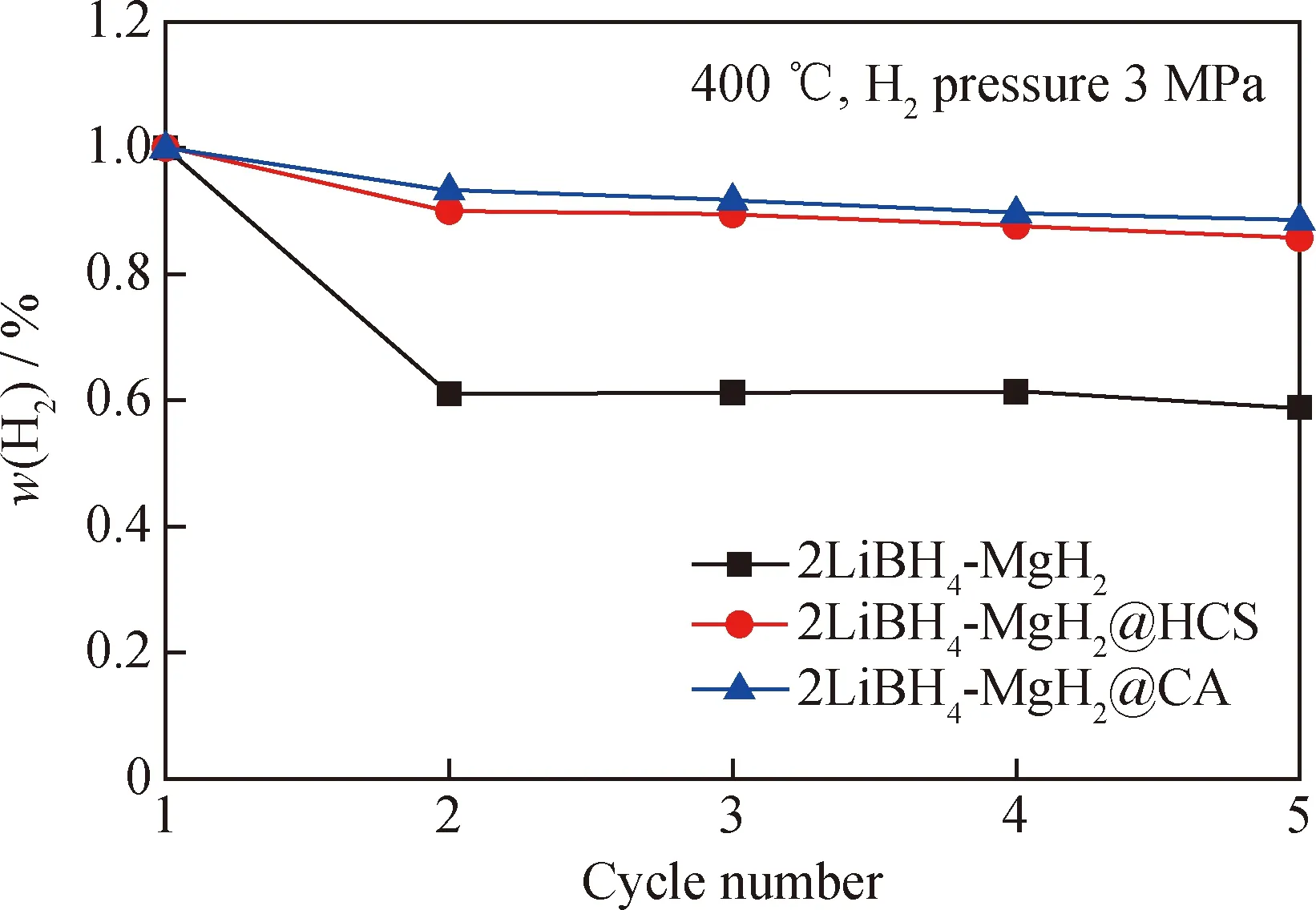
图7 2LiBH4-MgH2,2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA复合储氢材料在400 ℃时的吸氢容量循环曲线Fig.7 The hydrogen absorption capacity cycle curve of 2LiBH4-MgH2,2LiBH4-MgH2@HCS and 2LiBH4-MgH2@CA at 400 ℃
3 结 论
通过不同方法制备了2种不同表面结构的零维碳材料HCS和CA,研究发现:
(1)零维碳材料在与金属镁粉进行氢化的过程中,由于碳材料表面缺陷以及介孔结构,原位生成的MgH2纳米粒子能够封装入碳材料的孔道内部,并均匀地分散在碳材料的表面;
(2)制备得到的镁基粒子通过高能球磨与LiBH4复合构建Li-Mg-B-H体系,能更有效地促进LiBH4放氢反应的进行,进一步提高了复合储氢材料的吸放氢性能。
(3)此外,通过对 2LiBH4-MgH2@HCS和2LiBH4-MgH2@CA复合储氢材料的热力学、动力学以及循环稳定性研究发现,零维碳材料结构的存在不仅为反应粒子提供活性位点,促进储氢粒子的附着、锚定以及成核,同时能够在吸放氢过程中有效抑制储氢粒子的团聚现象,进而对复合储氢材料的储氢性能起到了积极的促进作用,增强其反应动力学及热力学性能。
