中华绒螯蟹14-3-3ζ基因cDNA全长克隆与序列分析
2021-12-22吴彦兵
肖 麒,吴彦兵,陈 炼,李 鹏
(1.南京师范大学生命科学学院,江苏 南京 210023) (2.南京林业大学生物与环境学院,江苏 南京 210037)
14-3-3蛋白质最早由Moore和Perez于1967 年在牛脑组织提取物中发现,根据蛋白经过DEAE cellulose(二乙氨乙基纤维素柱)层析中的片段数目以及其在凝胶电泳中的迁移率,将其命名为 14-3-3蛋白[1]. 14-3-3蛋白是一类广泛存在于真核生物中分子量较小(27 kDa~32 kDa)的酸性调控蛋白家族[2],主要以稳定的同源或异源二聚体形式存在于细胞质中,其单体由9个反向平行的α-螺旋组成,哺乳动物 14-3-3 蛋白二聚体的的X射线结构为U形,具有一个高度保守内部凹槽[3]. 这个内部凹槽是14-3-3与配体相互作用的结构域,能容纳来自单一蛋白质结合伴侣的两个区域或来自两个蛋白质结合伴侣的一个区域,用于调节14-3-3蛋白与靶蛋白结合[4]. 14-3-3蛋白分子有3个保守的碱性氨基酸组成,一个能与磷酸化磷酸基团形成离子键和氢键的口袋,这就解释了14-3-3蛋白能够与到含有磷酸化苏氨酸和磷酸化丝氨酸的蛋白质特异性结合的原因[5]. Ichimura等[6]首次对14-3-3蛋白家族的作用进行阐述,认为 14-3-3 蛋白与酪氨酸羟化酶激活物有关. 在有关酿酒酵母的蛋白质互作研究中证明14-3-3蛋白可以与271种不同的磷酸化的蛋白质相互作用,14-3-3蛋白与不同分子会产生不同的功能,比如:稳定蛋白质的活性或非活性磷酸化形式、改变构象、亚细胞定位以及蛋白的相互作用关系[7]. 因此,14-3-3蛋白可以与不同蛋白质结合从而参与多种磷酸化调节的信号通路,并在生物代谢[8]、信号转导[9]、细胞周期控制[10]、凋亡[11]、蛋白质运输、转录[12]、应激反应[13]等方面发挥着重要作用.
14-3-3蛋白是由不同基因编码产生,目前已知哺乳动物14-3-3蛋白有7个亚型,根据其在高效液相色谱(HPLC)的洗脱顺序,用希腊字母(β、ε、γ、η、σ、τ、ζ/zeta)进行命名,并且这些亚型的表达量在不同类型的组织中存在差异[14]. 其中,14-3-3ζ蛋白因其在人类癌症的形成和发展中所起的作用而广为人知[15].14-3-3ζ作为一个重要的原癌基因,可与细胞内多种分子相互作用,改变细胞信号传导、调控细胞周期和抑制细胞凋亡,在恶性肿瘤的形成、生长、侵袭及转移的过程中发挥了重要的生物学功能[16]. 大量研究也证实 14-3-3ζ在人类多种常见恶性肿瘤中呈高表达,且其高表达水平不仅与肿瘤的转移存在一定相关性,也与肿瘤耐药、预后等方面存在一定相关性[17]. 此外,14-3-3ζ可能在免疫响应中发挥着重要作用. 用脂多糖和肽聚糖等刺激三角涡虫(Dugesiajaponica)时,14-3-3ζ表达显著上调[18]. 通过RNA干扰技术证明14-3-3ζ可通过调节细胞骨架重塑参与埃及伊蚊(Aedesaegypti)和白纹伊蚊(A.albopictus)革兰氏阳性菌和革兰氏阴性菌的吞噬作用[19]. 实时定量PCR结果显示,14-3-3ζ基因在拟穴青蟹(Scyllaparamamosain)各组织器官均有表达,但在卵巢中的表达量显著高于其他组织,在卵黄发生中期14-3-3ζ的表达量显著高于增殖期,推测其在卵巢中发挥重要作用[20].但还未见关于中华绒螯蟹(Eriocheirsinensis)14-3-3ζ基因的相关研究报道. 本研究采用cDNA末端快速扩增(Rapid amplification of cDNA ends,RACE)技术从中华绒螯蟹体内克隆14-3-3ζ基因的cDNA全长序列,用生物信息学的方法对该基因的结构与功能进行了初步分析,并对中华绒螯蟹的14-3-3ζ基因进行了选择压力分析,研究结果可为后续深入研究该基因的作用提供资料.
1 材料与方法
1.1 实验动物
实验用中华绒螯蟹均采自江苏泰州兴化中堡镇,壳长(30±5)mm. 实验前在曝气水中暂养,水温为(20±2)℃,期间用虾蟹饲料喂养,每天换一次水,使其适应实验室的养殖环境. 取第三步足肌肉组织 100 mg 转移至含有1 mL Trizol 冻存管中,迅速用液氮冻存,用于提取总RNA.
1.2 总RNA抽提与逆转录
提取总RNA按RNeasy Mini Kit(Qiagen,Germany)说明书于生物安全柜上操作,提取的RNA分装后于-80 ℃保存. 取1 μL总RNA样本稀释50倍(即1 μL RNA样品加入49 μL RNase-free water)于BioPhotometer核酸和蛋白质定量仪(Eppendorf,Germany)上检测RNA的浓度和纯度(OD260/OD280),总RNA检验合格后用于后续实验. 采用Super SMARTTMPCR cDNA Synthesis Kit(Clontech,Palo Alto,USA)进行cDNA的合成,操作按试剂盒说明书进行.
1.3 引物设计
从 GenBank下载中华绒螯蟹近缘物种的14-3-3ζ的氨基酸序列后进行比对,找出上下游连续的保守位点,用 Primer Premier 5.0 设计cDNA末端快速克隆(RACE)反应的特异引物(见表1),引物由生工生物工程(上海)股份有限公司合成.

表1 14-3-3ζ基因cDNA片段扩增所用引物与扩增片段大小Table 1 Nucleotide sequences of primers used in cDNA fragments amplified of 14-3-3ζ gene and amplicon length size
1.4 14-3-3ζ基因cDNA全长扩增
按照 SMARTTMRACE cDNA Amplification Kit与Advantage®2 PCR Enzyme System(Clontech,Palo Alto,USA)试剂盒说明书,采用巢式PCR扩增中华绒螯蟹14-3-3ζ基因的5′末端序列. 以Primer primer 5.0 设计下游特异性引物GSP1-ζ5′,上游引物为试剂盒中的通用引物(universal primer,UPM)进行5′ RACE. 以第一次PCR产物为模板,用设计的下游引物GSP2-ζ3′和UPM 进行第二次PCR. RACE反应(50.0 μL)体系为:10×Advantage 2 PCR buffer 5.0 μL,50×dNTP Mix(2.5 mmol/L)1.0 μL,Milli-Q water(Toyobo,Japan)34.5 μL,10×Universal Primer A Mix(10 μmol/L)5.0 μL,5′RACE/3′RACE特异引物(10 μmol/L)1.0 μL,RACE-Ready cDNA 2.5 μL,50×Advantage 2 polymerase(Clontech,USA)1.0 μL. PCR反应参数:94 ℃预变性 3 min;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 3 min,25个循环;72 ℃ 延伸10 min;4 ℃保存. 扩增产物通过1.5%的琼脂糖凝胶电泳检测,用DNA回收试剂盒回收PCR产物中的目的片段. 将目的片段连入pMD19-T载体,转化到EscherichiacoliDH5α 感受态细胞后16 ℃连接过夜,通过蓝白菌斑检测挑选出阳性克隆送至生工生物工程(上海)股份有限公司进行序列测定.
1.5 14-3-3ζ基因序列的生物信息学分析
分别使用在线工具protparam(https://web.expasy.org/protparam/)、NetNGlyc(http://www.cbs.dtu.dk/services/NetNGlyc/)、NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)对中华绒螯蟹14-3-3ζ蛋白质序列的理化性质、糖基化位点和磷酸化位点进行分析和预测. 利用线上工具TMHM(http://www.cbs.dtu.dk/services/TMHMM/)和TMPRED(https://embnet.vitalit.ch/software/TMPRED_form.html)预测中华绒螯蟹14-3-3ζ蛋白质序列的跨膜结构区,SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP-4.1/)用于预测信号肽,14-3-3ζ蛋白质的亚细胞定位用PSORT II软件(https://psort.hgc.jp/form2.html)预测.
从NCBI蛋白质数据库中下载节肢动物,软体动物,扁盘动物和哺乳动物的14-3-3ζ蛋白质序列,利用MAFFT[21]软件的默认参数将这些蛋白质序列与中华绒螯蟹14-3-3ζ蛋白质序列进行比对. 使用MEGA 7[22]软件的邻接法构建无根的系统发生树,设置自展重复1000次. 利用SMART(http://smart.emblheidelberg.de/)鉴定网上下载的14-3-3ζ蛋白质序列与中华绒螯蟹14-3-3ζ蛋白质序列的结构域. 使用线上工具Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测中华绒螯蟹14-3-3ζ蛋白质的三维结构. 根据三维结构信息使用在线工具ESPript 3.0(http://espript.ibcp.fr/ESPript/cgi-bin/ESPr-ipt.cgi)绘制序列二级结构图. 从NCBI分别下载编码南美对虾(Penaeusvannamei)、拟穴青蟹(Scyllaparamamosain)、斑节对虾(Penaeusmonodon)、墨吉对虾(Penaeusmerguiensis)、端足虫(Hyalellaazteca)和球鼠妇Armadillidiumnasatum14-3-3ζ蛋白的mRNA CDS序列,经过上述相同的比对和构树方法分析后,利用CodeML中的分支模型(Branch model)检测中华绒螯蟹14-3-3ζ基因是否受到选择压力[23].
2 结果与讨论
2.1 中华绒螯蟹14-3-3ζ基因cDNA全长序列的克隆与分析
在RACE反应中,进行5′RACE和3′RACE PCR反应,通过测序分别获得583 bp和433 bp的基因片段. 经DNAStar Lasergene 7.1软件[24]对位拼接后获得1 081 bp的cDNA片段,经BLAST比对验证其为 14-3-3ζ 基因的cDNA全长序列(图1).14-3-3ζ基因的全长cDNA序列具有一个98 bp的5′-端非翻译区(terminal untranslated region,UTR)和一个239 bp的3′-端非翻译区. 它具有一个744 bp的开放阅读框,编码一个具有247个氨基酸的多肽. 结构域分析结果显示该开放阅读框编码的氨基酸序列包含14-3-3保守结构域,这个保守区域是14-3-3蛋白的典型的功能域. 翻译的起始密码子为ATG(位于99-101),终止密码子为TGA(位于840~842位),其后没有加尾信号AATAAA. 序列中A+T和C+G的百分比分别为47.92%和52.08%. 测定的序列经比对、装配后获得全长cDNA序列并提交美国国家生物信息中心(National Center for Biotechnology Information,NCBI)保存(GenBank登录号:MW473724). 将核苷酸序列推导的氨基酸序列在公共数据库(NCBI的NR数据库)进行同源性搜索比对后分析发现,本实验克隆的14-3-3ζ基因在氨基酸水平与拟穴青蟹(NCBI编号:AFD28274.1)的14-3-3蛋白一致度为97.58%,与南美白对虾(NCBI编号:XP_027210306.1)的14-3-3蛋白一致度为97.57%,与斑节对虾(Penaeusmonodon,登录号XP_037791730.1)的14-3-3ζ蛋白一致度为95.14%;在核苷酸水平与拟穴青蟹(NCBI编号:JQ218935.1)14-3-3 ζ基因的一致度达94.19%,与南美白对虾(NCBI编号:XM_027354505.1)和斑节对虾(NCBI编号:XM_037935801.1)14-3-3 ζ基因的一致度分别为87.64%和87.45%. 上述序列之间较高的一致度进一步印证14-3-3蛋白在结构和进化上的保守性. 进化树结果显示,中华绒螯蟹与拟穴青蟹亲缘关系最近,与甲壳动物的斑节对虾和墨吉对虾聚为一小支,与节肢动物的遗传距离较近,而与鱼类及鱼类以上的高等动物的遗传距离相对较远(图1). 选择压力分析表明中华绒螯蟹14-3-3ζ基因没有受到正选择压力(P=0.69),其非同义替换与同义替换比值为0.016.因此,14-3-3ζ受到纯化选择,该蛋白的功能可能是保守的.
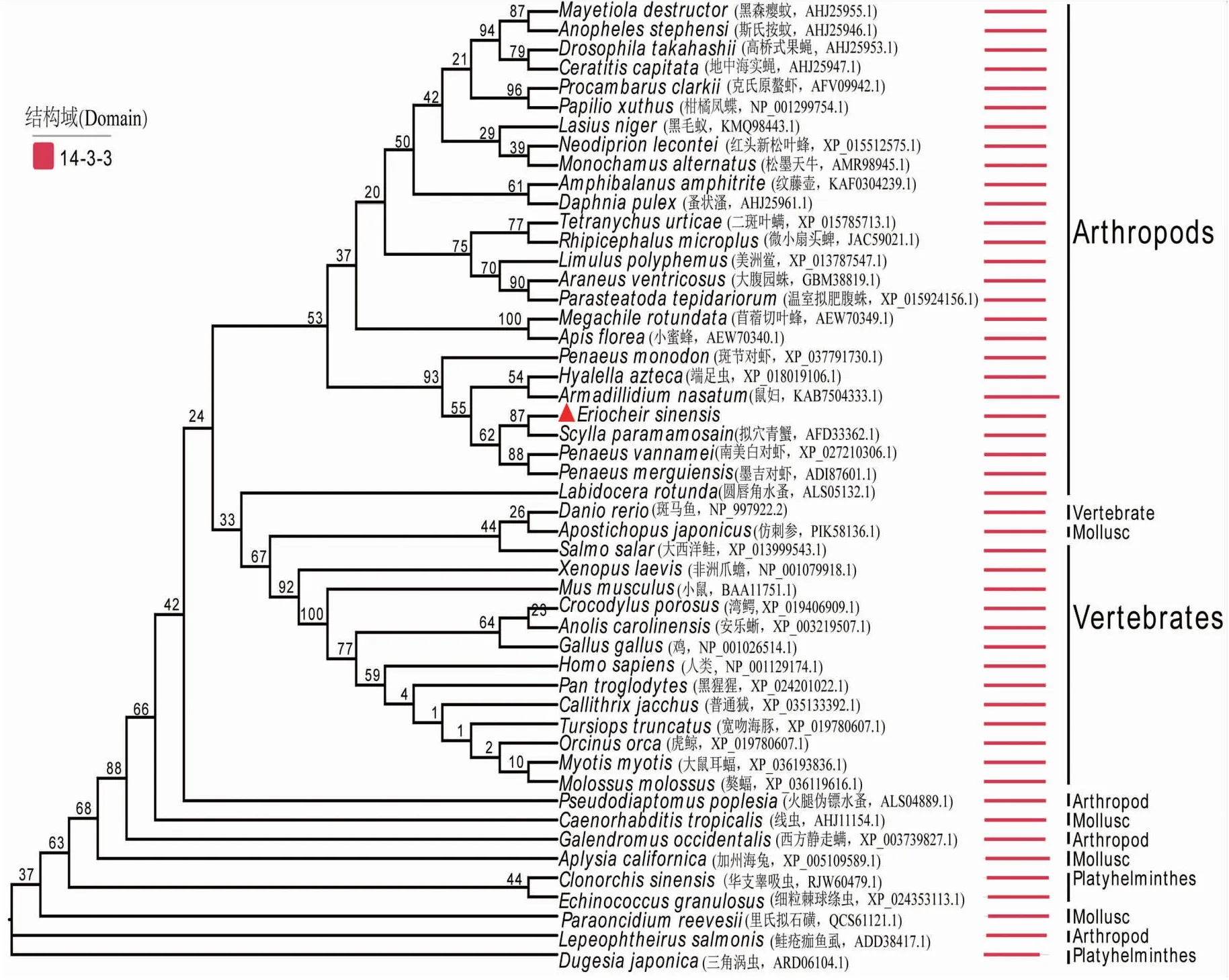
图1 基于邻接法构建的中华绒螯蟹和其他物种 14-3-3ζ蛋白系统发生树Fig.1 Phylogenetic tree of the 14-3-3ζ amino acidsequences between E.sinensis and other species using Neighbor-joining method
2.2 14-3-3ζ蛋白结构分析
采用ProtParam工具进行14-3-3ζ蛋白理化性质分析,结果表明14-3-3ζ蛋白的分子量约为28.0 kDa,理论等电点pI为4.70,原子总数3 899个,分子式为C1218H1934N336O402S9;在组成14-3-3 ζ蛋白的20种氨基酸中,谷氨酸(Glu)所占的比例最高,达到10.5%,其次是丙氨酸(Ala),占比达到9.30%,组氨酸(His)所占的比例最低,为0.4%;脂肪指数为77.45;14-3-3ζ蛋白质的不稳定指数为52.08,根据GRP(Guruprasad-Reedy-Pandit)法的分类,14-3-3 ζ蛋白不稳定. 亲水平均系数为-0.66,表明该蛋白质可能为亲水蛋白. 基于TMHMM和TMPRED的分析结果14-3-3ζ蛋白不存在跨膜区. 14-3-3ζ蛋白的信号肽预测使用SignalP程序,通过S-平均值(mean S value)来判断是否为分泌蛋白,若S-平均值大于0.5,则预测为分泌蛋白,存在信号肽;基于这种算法的结果表明,14-3-3ζ蛋白不含有信号肽序列,它为非分泌型蛋白. PSORT II server分析14-3-3 ζ蛋白的亚细胞定位结果表明14-3-3 ζ蛋白定位于细胞质中的可能性有43.5%,定位于细胞核和线粒体中的可能性均为17.4%. 14-3-3 ζ蛋白多肽链上含有5个蛋白激酶C(protein kinase C,PKC)磷酸化位点,4个酪蛋白激酶II(casein kinase II,CK2)磷酸化位点,3个蛋白激酶A(cyclic-AMP dependent protein kinase A,PKA)磷酸化位点,2个酪蛋白激酶I(casein kinase I,CK1)磷酸化位点,2个重组链激酶(recombinant streptokinase,RSK)磷酸化位点,2个细胞周期依赖激酶1(cyclin-dependent kinase 1,cdc2),1个蛋白激酶G(protein kinase G),1个DNA 依赖的蛋白激酶(DNA-dependent protein kinase,DNAPK),1个丝氨酸蛋白激酶(Serine-protein kinase,ATM)磷酸化位点,促分裂素原活化蛋白激酶(Mitogen-activated protein kinase,MAPK),原癌基因酪氨酸蛋白激酶(proto-oncogene tyrosine-protein kinase,SRC)和2个N端糖基化(Asn糖基化)位点(图2). 14-3-3蛋白是一种重要的调控蛋白,该蛋白可以通过自身序列上的磷酸化位点调节许多蛋白质的活性[25]. 比如,胰腺导管腺癌在缺氧条件下胞外信号调节激酶(extracellular regulated protein kinases,ERK)可以引起14-3-3ζ蛋白第37位丝氨酸发生磷酸化,促进YAP(Yes-associated protein)与14-3-3ζ蛋白复合体分离,并帮助YAP定位到细胞核从而增强低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)依赖的 PKM2(糖酵解丙酮酸激酶)转录和糖酵解[26]. 因此,上述磷酸化位点可能在14-3-3ζ蛋白发挥生物学功能中起到重要作用.

灰色标记为预测磷酸化位点,波浪线标记为预测糖基化位点,黑体为起始/终止密码子,下划线标记ORF验证引物图2 中华绒螯蟹14-3-3ζ基因的全长cDNA序列和推导的氨基酸序列结构Fig.2 Nucleotide and deduced amino acid sequences of 14-3-3ζ gene from E.sinensis
使用Phyre2(protein homology/analog Y recognition engine)服务器对中华绒螯蟹14-3-3ζ蛋白的三级结构建模,结果表明单项最高分模板(single highest scoring template)为隐孢子虫(Cryptosporidiumparvum)14-3-3蛋白的晶体结构,230(93%)个中华绒螯蟹14-3-3ζ蛋白的氨基酸可以与该模板匹配,置信度为100%. 14-3-3ζ蛋白的二级结构组分中存在9个α螺旋结构,不存在β折叠等结构,这一结果与拟穴青蟹14-3-3ζ蛋白结构类似[20]. 多重序列比对结果显示,不同物种的14-3-3ζ蛋白的9个α螺旋区域高度保守,表明14-3-3ζ蛋白在进化上高度保守. 14-3-3蛋白以同源或异源二聚体形式存在,由同源二聚体和异源二聚体形成的U型槽可以与单个或不同蛋白上的两个模体(motifs)相互作用,从而调节不同14-3-3目标蛋白互作,或改变单个目标蛋白的构象和活性[27]. 14-3-3ζ蛋白N末端的4个α螺旋参与二聚体的形成,14-3-3二聚体的形成是通过一个14-3-3单体的α1和α2对应的另一个14-3-3蛋白单体的α3和α4相互作用形成[28]. 14-3-3ζ在C-末端序列一致度较低较差(图3)可能是由于14-3-3ζ在与配体结合时,C端被抛出,暴露高度保守内部凹槽,从而使14-3-3ζ与目标蛋白结合[29].

图3 代表性物种14-3-3ζ蛋白的氨基酸序列多重比对Fig.3 Alignment of the amino acid sequences of among different 14-3-3ζ proteins
3 结论
本文克隆获得了中华绒螯蟹14-3-3基因的全长cDNA序列,并对其蛋白结构与理化性质等进行了深入的生物信息学分析,通过序列同源性比对、序列结构比较和一些生物信息学预测分析,结果表明14-3-3蛋白是14-3-3ζ家族成员,且在进化上较为保守,该蛋白为非分泌型蛋白,不具有跨膜区域,定位于细胞质中,其分子量与已报道的14-3-3ζ蛋白分子量相近;14-3-3ζ蛋白具有家族保守的14-3-3结构域,该蛋白结构域上包含多个磷酸化位点可能在14-3-3ζ发挥生物学功能中起到重要作用. 选择压力分析表明中华绒螯蟹14-3-3ζ受到纯化选择,其功能可能高度保守.
