烧伤后增生性瘢痕组织中铁代谢相关蛋白表达的研究
2021-12-22赵连魁李冬军
李 明,赵连魁,李冬军
(石家庄市人民医院,河北 石家庄 050011)
增生性瘢痕是严重烧伤后患者皮肤恢复所面临的主要问题[1],也是严重烧伤患者回归社会的重要阻力,因此增生性瘢痕的防治一直以来是烧伤整形领域研究的焦点。在许多生理过程中,微量元素铁作为许多酶的金属协同因子起着关键作用。秦泽莲等[2]研究发现钙、镁、锌、铁和铜含量在增生性瘢痕组织中较自身正常皮肤减少,并推测铁等微量元素的减少在增生性瘢痕的形成过程中起到一定作用,然而具体机制不明确。本研究通过检测烧伤后增生性瘢痕患者血中铁元素相关指标及增生性瘢痕组织中铁代谢相关蛋白的表达情况,分析增生性瘢痕组织中铁代谢相关蛋白表达的特点与增生性瘢痕形成的关系,旨在为烧伤后增生性瘢痕的治疗提供新的依据。
1 材料与方法
1.1一般资料 选择2016—2018年在石家庄市第一医院烧伤整形外科住院、有增生性瘢痕典型症状体征的15例烧伤患者作为增生性瘢痕组,男12例,女3例;年龄25~52岁;病程2~11年。选择同期因外伤或美容手术受术者15例作为正常组,男12例,女3例;年龄20~50岁。2组患者无家族性瘢痕增生史及金属元素接触史,无影响铁代谢的相关疾病,术前未采用任何防治瘢痕的治疗,术前均签署患者知情同意书。本研究通过石家庄市第一医院伦理论证。
1.2标本采集及留存 增生性瘢痕组分别采集患者瘢痕及其自身正常皮肤组织标本。瘢痕分别取材于面颈部、肩背部及上肢;正常皮肤取自同一患者全厚皮片移植剩余部分,取材于上肢、腹部及下肢。术中采集标本至液氮中保存。
1.3主要试剂 兔抗大鼠多克隆FTL一抗、 兔抗大鼠多克隆FPN1一抗、鼠抗人单克隆TfR1一抗、兔抗大鼠多克隆DMT1+IRE一抗、兔抗大鼠多克隆DMT1-IRE一抗、兔抗人多克隆β-actin一抗均为Alpha Diagnostic International,USA产品;HRP-耦联的山羊抗小鼠IgG单抗、HRP-耦联的山羊抗兔IgG单抗为北京中杉金桥生物技术有限公司产品,PVDF 膜为美国 Millipore 公司产品,其他试剂为国产分析纯。
1.4检测指标及方法
1.4.1静脉血中铁代谢相关指标 术前取2组患者静脉血,提取血清,送检验科检测血清铁、总铁结合力、不饱和铁结合力、转铁蛋白饱和度、转铁蛋白含量。
1.4.2皮肤组织中铁含量 皮肤和瘢痕组织充分自然解冻,双蒸去离子水洗涤6次,自然干燥24 h,称重。称取0.3 g,分别置于消化器中,加纯硝酸2 mL,置70 ℃水浴加热4 h,待样品完全溶解,用100 ℃水浴加热2~3 h,尽量保持消化器中溶液体积有0.5 mL;各管中加高氯酸0.1 mL,置于70 ℃水浴中加热2 h,直至溶液呈清亮;然后将溶液移入定容管内,分别用双蒸去离子水定容于5 mL。用电感耦合质谱分析仪测定其中Fe元素的含量。按公式计算样品中Fe含量(μg/g):定溶液微量元素含量(μg/g)×定容液体积(5 mL)/样品重量(g)[3]。
1.4.3皮肤组织中铁代谢相关蛋白表达量 冻存瘢痕组织解冻匀浆,充分裂解,提取总蛋白,BCA 法测定蛋白浓度,取蛋白样品电泳,转移至PVDF膜,4 ℃ 封闭过夜,分别用FPN1,TfR1,DMT1+IRE,DMT1-IRE,FTL(1∶200) 和 β-actin 兔多克隆抗体(1∶1 000) 孵育,室温轻摇 3 h,洗涤,辣根过氧化物酶标记的山羊抗兔IgG(1∶2 000) 室温孵育,洗涤, ECL化学发光,凝胶成像系统拍照,封存。利用Fujifilm Las-4000分析软件统计目标条带的积分光密度,用β-actin作为内参,以目的蛋白/ β-actin 表示蛋白相对表达量。
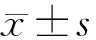
2 结 果
2.1静脉血中铁、总铁结合力、不饱和铁结合力、转铁蛋白饱和度及转铁蛋白含量 正常组和增生性瘢痕组血清铁、总铁结合力、不饱和铁结合力、转铁蛋白饱和度及转铁蛋白含量比较差异均无统计学意义(P均>0.05) 。见表1。
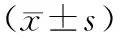
表1 正常组和增生性瘢痕组血清铁、总铁结合力、不饱和铁结合力、转铁蛋白饱和度及转铁蛋白含量比较
2.2皮肤组织中铁含量 正常组皮肤组织中铁含量为(49.65±6.12)μg/g,与增生性瘢痕组自身正常皮肤组织中铁含量(47.92±4.21)μg/g比较差异无统计学意义(P>0.05);增生性瘢痕组增生性瘢痕组织中铁含量为(69.71±4.53)μg/g,明显高于自身正常皮肤组织中铁含量(P<0.05) 。
2.3皮肤组织中铁代谢相关蛋白表达情况 增生性瘢痕组增生性瘢痕组织中FTL、DMT1(+IRE)、 DMT1(-IRE)、FPN1表达量均明显高于自身正常皮肤组织(P均<0.05),TfR1表达量明显低于自身正常皮肤组织(P<0.05)。见图1。
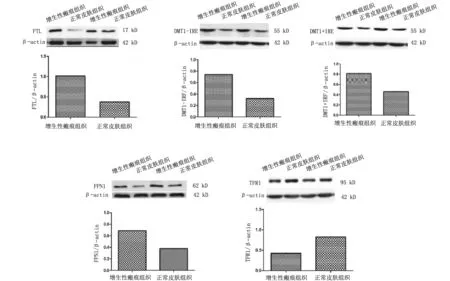
图1 Western blot检测增生性瘢痕中铁代谢相关蛋白的表达情况
3 讨 论
铁作为机体必需的微量元素,参与人体内众多生化反应,铁代谢的紊乱可以导致多种常见疾病的发生[4-6]。铁广泛参与人体重要的生命代谢过程,直接或间接参与烧伤修复中的细胞免疫、伤口愈合及抗氧化反应等多个环节[7-8],铁不足或铁过多都会影响创面愈合[9]。目前,已有的研究多集中在烧伤后增生性瘢痕组织中各种微量元素含量的变化,而有关其进一步的发生机制鲜有研究。本实验探讨了铁代谢相关蛋白在烧伤增生性瘢痕中的表达及其关系。
增生性瘢痕多来源于重度烧伤、创伤,而重度的烧伤、创伤在伤后早期及后续创面修复过程中,由于创面渗液剧增、大量红细胞丢失破坏等造成包括铁元素在内的各种微量元素在体内出现各种各样的改变,其中铁往往处于缺乏状态[10]。因此,有学者指出对于严重烧伤、创伤患者,在伤后及时适量补充铁等微量元素,将有利于机体组织损伤修复,增强抗氧化酶活性[11],增强机体免疫能力,从而促进创面尽早愈合。重度烧、创伤患者经抗感染、营养支持治疗后,机体各物质代谢、能量代谢趋于正常,血清中铁等微量元素含量基本恢复正常,但在创伤局部,由于细胞增殖旺盛,会富集大量的供给细胞生长的铁,这些铁一方面促进了创面局部细胞增殖,另一方面也会带来氧化损伤[8]。又由于烧伤造成的局部微循环结构严重破坏,组织难以得到足够氧供,低氧也可能触发损伤局部组织中各类生长因子分泌失衡[12-13],从而导致胶原合成大量增加,局部修复异常,而异常的瘢痕组织结构又进一步加重局部组织的低营养状态,形成恶性循环[2]。
本研究检测增生性瘢痕患者和正常健康人群的血清铁、总铁结合力、不饱和铁结合力、转铁蛋白饱和度及转铁蛋白含量,结果各指标比较差异均无统计学意义;检测皮肤组织中铁含量发现,正常健康人皮肤组织中铁含量与增生性瘢痕患者自身正常皮肤组织中铁含量比较差异无统计学意义,增生性瘢痕患者增生性瘢痕组织中铁含量明显高于自身正常皮肤组织中铁含量。由此推测,增生性瘢痕患者机体整体处于铁平衡状态,而在增生性瘢痕局部铁过载。这与既往的研究结果并不一致[2],可能是所取的瘢痕组织分别在创面修复的不同阶段,局部微量元素的变化可能不同,这有待加大样本量结合准确评估瘢痕形成时间做进一步研究。
细胞通过铁的吸收、贮存和利用之间的协同调节来维持其铁稳态。铁调节蛋白(iron regulatory protein,IRP)是胞浆内的RNA结合蛋白,能感应细胞内的铁浓度,控制这些蛋白的翻译,以维持细胞内铁稳态[14]。细胞内胞内铁含量下降时,与多种铁代谢相关蛋白(TFR1、DMT1等)mRNA 3’端UTR的铁反应元件(iron responsive element,IRE)相结合,增加其基因的稳定性,从细胞外摄入铁的DMT1、TfR1蛋白表达增加,即细胞的摄铁能力随之增强;此时FPN1 5'IRE与IRP 结合,FPN1 的翻译被抑制,释铁蛋白FPN1表达下降,铁从细胞内向外的输出随之减少[3],反之亦然。通过上述机制,IRP/IRE调节系统在转录后水平实现对细胞内铁代谢的精密调控[10]。在异常增生瘢痕中,胶原细胞、成纤维细胞等各种细胞通过IRP/IRE调节系统摄入铁来满足自身生长增殖、清除活性氧的需要;然而摄入的铁过多,会使细胞内发生铁过载,在IRP/IRE调节系统的作用下,TfR1、DMT1(+IRE)、DMT1(-IRE)表达下降,从而减少由胞外摄入铁;同时FPN1表达升高,增加胞内铁释放,来维持细胞内铁稳态。本研究结果显示,增生性瘢痕组织中FTL、DMT1(+IRE)、DMT1(-IRE)、FPN1表达量均明显高于自身正常皮肤组织,推测可能是由于增生性瘢痕组织中锌、铜等二价金属离子的含量较低[2],DMT1(+IRE)、DMT1(-IRE)是细胞的主要二价金属转运体,对这些微量元素均有摄取转运作用,为维持这些二价金属离子的胞内稳态,细胞内DMT1(+IRE)、DMT1(-IRE)的表达升高,以摄取所需要的二价金属离子;TfR1表达量明显低于自身正常皮肤组织,推测其原因可能是皮肤组织中TfR1本底表达较低[15],TfR1在增生性瘢痕组织之中因细胞内铁的增加而表达下降。根据上述结果,推测在皮肤组织中,通过细胞内IRP/IRE调节系统,铁的摄取与释放主要依赖于TfR1和FPN1的作用,而DMT1 (+IRE)、DMT1 (-IRE)在其中的作用微弱,但这仍需进一步证实。此外,也许另有其他未知调节因素在铁代谢相关蛋白表达过程中发挥作用。
综上所述,烧伤后增生性瘢痕患者全身处于铁稳态,瘢痕局部铁元素沉积过多,细胞主要依赖于TfR1以及FPN1的作用调节铁的摄取和释放。本实验从分子水平丰富了增生性瘢痕发生发展的机制,为烧伤后增生性瘢痕的治疗提供了新的作用靶点,但本实验样本量少,需扩大样本量对上述结论进一步验证。
利益冲突:所有作者均声明不存在利益冲突。
