植物金属硫蛋白的金属结合及解毒研究进展
2021-12-20美合日班阿卜力米提
美合日班·阿卜力米提, 王 艳
(新疆大学 生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
重金属是一种主要的非生物胁迫因子,由于其毒性和较长的半衰期,长期存在土壤中,不仅严重影响自然环境和土壤肥力,还可通过食物链对人类健康造成不利影响。植物能够通过对金属的运输、螯合、交换和区隔等调节网络维持细胞环境中的金属稳态,并最大限度地减少必需和非必需金属离子造成的伤害。植物螯合素(phytochelatins,PCs)和金属硫蛋白(metallthioneins,MTs)是植物体内重要的螯合分子,由于富含半胱氨酸(cysteine,Cys)均具有与金属结合形成稳定复合物的特征,但二者发挥功能的特性又有所不同。PCs是由PC合酶以谷胱甘肽(glutataione,GSH)为底物催化合成的小分子肽,而MTs是由基因家族编码产生的蛋白,且分布广泛,包括细菌、真菌、植物和动物[1]。MTs似乎比PCs具有更广泛的金属亲和力,PCs主要与Cd解毒有关,而MTs与Cu、Zn、Cd和As等多种金属表现出高亲和力[2],进而参与金属平衡与解毒。同时,MTs也被认为是活性氧“清除剂”[3]。本文就近年来植物MTs的金属平衡、重金属解毒及活性氧清除功能及机制进行总结。
1 MTs的分类及特征
MTs是一类低分子质量(Mr< 10 ku)、富含半胱氨酸(20%~30%)的蛋白质。根据Cys残基的排列方式,MTs可以分为3类(I、II和III):I类MTs具有20个保守的Cys残基,仅在哺乳动物和脊椎动物中发现[1];II类包含来自植物、真菌和无脊椎动物的MTs,并显示出Cys残基的灵活排列方式;III类MTs由PCs组成,它们是酶促合成肽,一般结构为(γ-Glu-Cys)n-Gly(n=2~11)。植物MTs属Ⅱ类,其氨基酸数量从45~87不等,Cys含量在10~17个残基,芳香族氨基酸的数量从0到几个不等,组氨酸(His)含量低。根据Cys数量及在N端的分布,分为4种类型(MT1至MT4),且它们往往表现出不同器官和发育阶段特异性的表达模式(表1)。

表1 植物MTs的分类与特征
植物中发现的4种MTs及亚型都能与金属结合,因而发挥着金属螯合剂或“储存库”的作用[4]。空间结构分析显示,植物MTs的构象为哑铃状,具有两个独立的α结合域和β结构域,其核心簇中包含几个四面体的金属-半胱氨酸(Metal-Cys)单位。N端(β结构域)参与必需金属离子的稳态,而C末端(α结构域)紧密螯合过量/或有毒金属离子,两个结构域对不同金属的反应性和亲和力促使两个金属簇发挥不同的功能。至于连接α和β结构域的间隔区,可能有助于MTs蛋白的稳态或亚细胞定位[5],也是MT金属解毒功能所必需的。

(a)鹰嘴豆MT1[10];(b)鹰嘴豆MT2[7];(c)野芭蕉MT3[11];(d)小麦Ec-1[12]。曲线代表多肽链;小圆代表半胱氨酸残基;椭圆代表组氨酸残基;大圆代表二价金属离子(M2+)。图1 植物MTs与二价金属离子结合的假设模型[13]Figure 1 Hypothetical models of plant MTs binding to divalentmetal ions[13]
2 植物MTs的金属解毒
2.1 金属结合特性
大多数植物金属硫蛋白属于Ⅱ型亚家族成员,往往能够结合二价阳离子(图1),如Cd2+、Fe2+、Zn2+和Cu2+。一般而言,MTs对金属的亲和能力为Ag(I)>Cu(II)> Cd(II)>Zn(II)[6]。金属-配体电荷转移(ligand-to-metal charge transfer,LMCT)是指光激发时,金属的电子部分转移至配体,从而使配体的电荷密度分布发生变化产生显著移位。利用该性质,可观察紫外波长220~270 nm下MTs和不同浓度金属结合后的特征移位条带,从而确定MTs对金属离子的结合及结合金属离子的巯基簇数量。基于此原理,已明确鹰嘴豆CicMT2[7]、水稻OsMTI-2b[8]和玉米ZmMT1[9]的金属结合特性及结合不同金属离子的巯基数量。质子和金属离子间对巯基簇也存在竞争反应[7]。特定波长下,二者的竞争表现为LMCT带的pH依赖强度上。往往,随着pH值的降低,LMCT带也会降低。同时二硝基苯甲酸(dinitrobenzoic acid,DTNB)可与MTs的巯基结合并使之氧化,生成的产物在412 nm处具有吸收峰。通过测定不同反应时间下的吸光值,如果金属离子与巯基结合越强,DTNB对MTs的氧化速率就越慢。因而,通过紫外光谱在400~200 nm和pH 7.8~1.8条件下对MTs巯基团的质子化以及MTs与DTNB的反应[9],往往可以明确MTs与金属离子的亲和力关系。
2.2 重金属螯合
MTs可提高植物暴露于有毒环境的金属浓度水平,因而植物金属硫蛋白基因的表达可作为压力抗性的一个指标。研究显示,来自盐地碱蓬的Ⅱ型金属硫蛋白SsMT2能显著提高大肠杆菌和烟草对Cd2+的积累和耐受性[14];拟南芥MT1a、MT1b和MT1基因的敲除,减少突变体中金属离子的积累,增加其对Cd2+的敏感性[15];金属Cu2+和Cd2+对小立碗藓PpMT2基因的表达有较强的诱导作用,PpMT2的异源表达提高酵母和转基因拟南芥对高浓度Cu2+和Cd2+的耐受性[16]。与Zn2+相比,栓皮栎MT2蛋白能够结合更多的Cd2+,表明该蛋白质在重金属解毒方面可能发挥重要作用[17]。
由于Cd等重金属具有高毒性和水溶性,在相对较低浓度下就会对动物、植物和微生物造成影响,因而被认为是非常不利的污染物。植物通过吸收和转运等一系列机制控制金属含量,实现解毒。MTs的合成是植物进行重金属解毒的策略之一,它通过Cys形成巯基簇结合金属离子,形成硫醇键(-SH-M),随后结合金属的MTs与液泡膜上的金属转运蛋白相互作用,被区隔至液泡,从而降低过量金属对胞质中重要分子或细胞器的攻击[1]。Zn污染下的芦苇中,大部分Zn被固定在质外体或螯合转运至液泡[18]。定位于超富集植物菥蓂液泡膜上的TgMTP1在植物应对重金属Ni、Cd、Zn和Co的耐受性方面发挥重要作用[19]。当细胞新陈代谢需要时,金属离子可通过其他转运蛋白将其从液泡释放到胞质中。拟南芥天然抗性相关巨噬细胞蛋白(natural resistance associated macrophage protein,NRAMP)一方面在Mn稳态中发挥重要作用,另外还负责将Mn从液泡中输出以维持线粒体Mn-超氧化物歧化酶(Mn-SOD)活性和低Mn条件下的最佳光合作用[20]。
值得注意的是,MTs对重金属解毒不只是将胞质中螯合的金属区隔到低代谢活性的液泡中。研究发现,拟南芥AtMT2a和AtMT3在蚕豆保卫细胞中的过表达增强其对Cd2+的抗性[21],一方面是由AtMT2a和AtMT3对Cd2+的鳌合,另一方面则间接阻止Cd2+与胞质其他成分的相互作用或进入细胞器,因而减少由Cd2+诱导的活性氧产生。
由于MTs和金属离子结合的动态不稳定性,因而可以与其他蛋白进行金属离子交换,如锌转运蛋白1(zinc transporter 1,ZnT1)[22]、螯合剂-乙二胺四乙酸(ethylene diaminetetraacetic acid,EDTA)[23]、超氧化物歧化酶(superoxide dismutase,SOD)[24]和其他金属结合蛋白,这种转移特性也是MTs发挥As[25]或Cd[26]等重金属解毒及提供Zn、Cu[27]等必需金属的基础。在某种意义上,MTs也是通过金属的螯合和转移特性以缓解衰老过程中金属离子的干扰、活性氧暴发及营养所需部位必需金属离子的释放[28]。因此,MTs不仅参与植物体内金属的浓度调节和重金属解毒,还涉及衰老等生物学过程。
MTs基因在植物不同发育阶段的特定组织和器官中表达,受个体发育的调节。研究显示,拟南芥MT1a和MT2a基因均在毛状体中高水平表达,并由MT1a和MT2a启动子驱动的葡聚糖苷酶报告基因(glucuronidase,GUS)在Cu处理情况下也优先表达在毛状体中[29]。此外,重金属Cd和Ni也分别在印度芥菜和庭荠的毛状体中优先积累。由于毛状体细胞比叶肉细胞大,可作为贮存重金属离子的场所,随着毛状体的衰老死亡,金属离子可被排出体外。以上结果表明植物毛状体作为MTs排出过量重金属离子的通道而发挥解毒作用。
2.3 生物修复
生物修复是指利用植物或相关微生物进行环境净化,可用于无机污染物的清除。一些植物能够从土壤中积极吸收高浓度重金属而未表现出任何毒性,因而被称为“超富集植物”。植物修复的重要特性是对金属的耐受和分配,其中金属从根转位到地上部位被认为是确定植物金属毒性临界值的主要因素。研究发现,MTs是超富集植物耐受高浓度重金属的原因之一。Cd胁迫下,伴矿景天类金属硫蛋白SpMTL基因被诱导表达,一方面通过螯合作用降低胞质中Cd的浓度,同时还通过调节根组织中的液泡螯合能力(vacuolar sequestration capacity,VSC),促进它们从根到芽的长距离运输[30]。在Zn胁迫下,海蓬子金属硫蛋白基因SbMT-2在烟草中的异源表达调节Zn2+从根向茎的选择性转运,因而可以作为植物修复的潜在候选靶基因[31]。
Cd、Pb和Ni等重金属污染物往往会通过工业废物和垃圾填埋等途径进入环境,导致严重的生态问题。如果不对废水进行预处理,则会导致高含量的Cd等金属间接进入土壤和农作物中。一种低成本有效去除重金属的方法是使用生物来源的天然材料(细菌、藻类、真菌、酵母)以生物吸附的方式进行废水或水溶液的处理[32],其特点是利用活微生物进行金属生物吸附,优点是生长的同时可以利用其固有的细胞内吸收和积累重金属的能力。基因工程微生物在污染物的生物修复和生物降解方面具有广阔的应用前景,它可通过插入特定的外源基因增强修复途径。编码植物螯合素和金属硫蛋白的基因往往作为重金属修复工程菌的候选基因。通过异源表达来自杨树的Ⅱ型金属硫蛋白PtdMT可显著提高酵母对Cd的抗性[33]。毛果杨PtMT2b基因的异源表达显著降低Cd对酵母的毒性[34],且这些酵母可通过螯合作用有效去除污水中的Cd[35]。虽然携带毛果杨金属硫蛋白PtMT2b酵母的吸附能力与其他生物吸附性材料相比很低,如每克板栗毛刺、松果或多金属结合生物吸附剂(multi-metal binding biosorbent,MMBB)分别能够吸收溶液中16.2、4.3和31.7 mg的Cd[36-37]。但这些往往还会产生二次重金属污染。然而,活酵母提供恒定的生物吸附材料,不仅可以在细胞内积累金属,并通过内部解毒机制不断去除金属。因此,可以利用金属硫蛋白基因,结合基因工程手段开发一种以酵母为基础的持续生物反应器-生物吸附系统,高效地从废液中去除Cd2+、Cu2+和Pb2+等重金属。
2.4 应答金属胁迫的转录调控机制
植物通过调节金属硫蛋白基因的表达对金属胁迫做出响应。众多研究表明,金属响应元件MRE(metalresponse element,MRE)是植物金属硫蛋白功能性响应元件,由高度保守的七核苷酸核心组成(5′-TGCRCNC-3′),存在于多种植物,如花旗松金属硫蛋白基因PmMT[38]、水稻金属硫蛋白基因ricMT[39]和水稻I-4b类金属硫蛋白基因OsMT-I-4b[40]的启动子区。含有MRE的35 bp豌豆 PvSR2启动子片段能够以金属诱导的方式激活GUS报告基因在烟草原生质体中的表达[41]。同样,水稻ricMT中的MRE元件对Cu胁迫下的诱导是必需的[39]。水稻OsMT-I-4b启动子包含4个MRE拷贝,其存在可驱动各种重金属胁迫下的GUS报告基因的表达[40]。
目前就金属响应元件转录因子(metal responsive element transcription factor,MTF)如何与MRE相互作用调节植物MTs表达的信息非常有限。在Cd胁迫下,豌豆锌指转录因子PvMTF-1与PvSR2启动子区的MRE元件结合[42],通过调节色氨酸的生物合成,提高大豆对Cd胁迫的抗性。尽管MTF在动物中高度保守,但与已鉴定获得的植物PvMTF-1同源性非常低,二者中共有的锌指基序都是与MRE结合必不可少的结构域。植物对铝的抗性受铝抗性转录因子1(aluminumresistancetranscription factor 1,ART1)和WRKY46转录因子的调控[43]。报道显示,在水稻铝抗性相关的29个靶基因启动子中均发现了与ART1转录因子结合的顺式作用元件[44]。WRKY46转录因子则通过直接与顺式作用元件W-boxs结合,调控铝胁迫抗性相关的苹果酸转运蛋白基因ALMT1的表达[43]。
3 活性氧清除
重金属、盐、旱和冷等非生物胁迫会破坏植物体内ROS产生和清除之间的平衡,导致细胞内ROS的过量积累。尽管ROS可作为信号分子参与细胞信号传导、基因表达调控等生理过程,但过量的ROS可氧化核酸、脂类或蛋白质等生物大分子,从而导致细胞损伤。MTs作为抗氧化防御系统的重要组分,具有很强的活性氧清除能力。动力学实验结果显示,MTs清除OH-的能力是已知内源性自由基清除剂中最强的一种。然而,MTs与O2-的反应活性远小于SOD和GSH,原因可能是MTs不具有像SOD那样的活性中心,同时巯基通过形成硫醇金属簇被包埋于蛋白的内部,因而限制与O2-的反应。
研究显示:来自芜菁BrMT[45]、木麻黄CgMT[46]、棉花GhMT[3]、水稻OsMT[47]和枣椰树DpMT[48]基因的异源表达显著降低转基因植物和细菌中的ROS含量;金属胁迫下MTs基因的表达,利于清除ROS,从而增强水稻幼苗对重金属Cu2+和Cd2+的抗性[49];在盐胁迫下,转水稻1型OsMT1e-P植株积累的H2O2较野生型植株少[50];与野生型拟南芥相比,拟南芥突变体mt2a对冷胁迫表现出更高的敏感性,并积累更高水平的H2O2含量[51];在重金属胁迫下,转芋头pCeMT烟草明显表现出较少的自由基以及脂质过氧化物[52]。因此MTs作为非酶类抗氧化剂在植物遭受各种非生物胁迫时发挥重要作用。然而,目前MTs在体内清除活性氧的机制仍尚未得到解析。
3.1 二硫键的形成
MTs是一类富含半胱氨酸的蛋白质,其通过半胱氨酸残基形成的巯基簇与金属离子结合。同时,基于MTs金属硫醇簇的结构特征,半胱氨酸残基也涉及ROS的清除。由于MTs与金属离子的亲和力不同,会发生微弱的解离而暴露巯基,因而易受到逆境下活性氧的攻击,被氧化形成二硫键(S-S),进而消耗ROS[12],因此巯基的氧化[53]和MTs对金属结合的稳定性对其功能至关重要。
3.2 抑制线粒体中ROS释放
早期研究发现,MTs参与动物细胞中线粒体的一些关键功能,如ROS清除[54]、金属稳态[55]、细胞色素c释放[56]、膜通透性调节[57]和电子传输[58]等。其中,电压依赖性阴离子通道(voltage-dependent anion channels,VDACs)是线粒体外膜(outer mitochondrial membrane,OMM)中最丰富的整合膜蛋白。VDACs通过通道的打开和关闭以调节线粒体和细胞质之间代谢产物的运输。电生理学研究表明,VDACs开放时对O2-等阴离子具有选择性,可影响线粒体膜电位和ROS的释放。研究发现,转AtMT2b拟南芥幼苗表现出体内更低的活性氧含量和更高的盐胁迫抗性[59]。在盐胁迫下,拟南芥AtMT2b可与线粒体外膜蛋白AtVDAC3互作,通过降低VADCs通道的开放,进而减少线粒体ROS向细胞质的释放;与此同时,AtMT2b可作为抗氧化剂,直接清除盐胁迫下的ROS,避免胞质中各种细胞器的氧化损伤。因此,AtMT2b可通过负调节线粒体膜蛋白AtVDAC3及直接作为活性氧清除剂降低植物体内ROS的含量。
3.3 调节抗氧化物酶
重金属、高盐和干旱等不利因素往往会导致植物体内产生大量的ROS,造成氧化胁迫。植物通过SOD、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)和非酶(抗坏血酸、谷胱甘肽和酚类化合物)等复杂的抗氧化系统维持体内ROS的稳态。Fe、Cu和Zn不仅是植物正常发育所必需的金属元素,同时也可作为某些酶类蛋白质的组分,充当酶辅因子,参与细胞氧化还原反应,调节光合作用、呼吸作用、碳和氮代谢以及抗氧化等重要的代谢过程。
MTs缓解生物体在多种非生物胁迫下的抗性与其对抗氧化酶的调节密切相关。首先,MTs作为Zn供体,锌指转录因子接受Zn被激活后调节抗氧化相关基因的表达,导致细胞内抗氧化酶浓度增加[60]。转盐角草金属硫蛋白基因SbMT-2的烟草中,编码SOD、POD、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)的抗氧化酶基因表达显著提高,因而增强其在重金属及盐等逆境胁迫下的抗性[27]。其次,MTs可直接作为抗氧化酶的金属离子供体[61]。CAT和SOD是金属酶,需要Cu、Zn和Fe等金属离子的活化。白骨壤2型金属硫蛋白AmMT2对Fe2+具有很强的结合能力,作为Fe2+供体提高过氧化氢酶CAT的活性,显著增强异源表达菌株在H2O2胁迫下的生长[62]。
4 展望
植物MTs作为金属结合蛋白质和强自由基清除剂,参与金属平衡及重金属解毒(图2)、非生物胁迫抗性及环境修复等诸多生物学过程。然而,植物MTs的确切功能仍不清楚。研究发现,MTs在植物生物防御中也发挥重要作用,如柑橘金属硫蛋白RlemMT1通过与锌的结合间接抑制了病原菌锌依赖的有毒物丙烯酸酯类共聚物(polyacrylate,ACR)的产生,进而抵御病原菌对植物生长的侵害[63]。
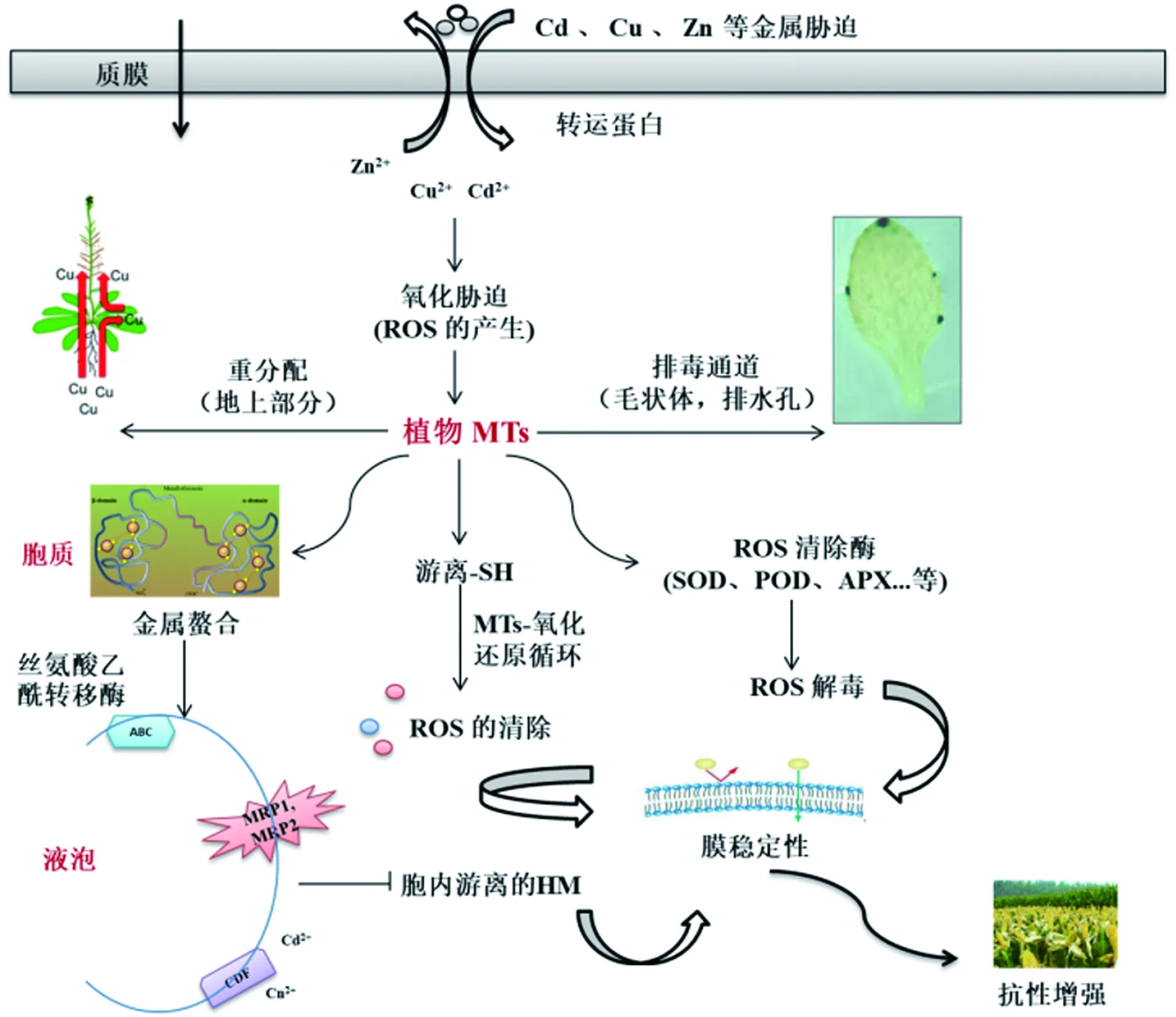
当植物遭受金属胁迫时,大量金属离子积累,同时体内活性氧暴发。一方面,MTs可调节体内金属的平衡:(1)富含Cys的MTs蛋白与金属离子结合,形成硫醇键(-SH-M),金属结合的MTs与液泡膜上的金属转运蛋白(CDF、MRP1、MRP2和ABC)相互作用,随后被转运至液泡以区隔过量金属;(2)MTs可对金属进行重分配,将金属从植物地下部位向地上部位转运,以提高植物对金属的耐受;(3)植物的毛状体与排水孔也可作为MTs储存金属离子的器官或外排金属离子的通道。另一方面,MTs可调节体内活性氧:(1)MTs对细胞内的氧化还原状态非常敏感,其巯基易被ROS氧化形成二硫键 (S-S),通过消耗ROS,发挥ROS 清除功能;(2)MTs也可调节抗氧化酶活性或相关基因的表达,降低细胞的氧化损伤。总而言之,植物MTs通过胞内金属平衡、解毒途径及ROS清除,维持膜稳定性,进而增强重金属耐受性。MTs:金属硫蛋白;-SH:巯基;HM:重金属离子;CDF:阳离子扩散促进剂;MRP1:多耐药相关蛋白1;MRP2:多耐药相关蛋白2;ABC:ATP转运蛋白。图2 植物金属硫蛋白的金属平衡和解毒作用机制Figure 2 The metal homeostasis and detoxification mechanismof plant metallothionein
植物MTs对重金属解毒的诸多研究中,大多都集中在MTs通过巯基螯合重金属的研究,而有关活性氧对金属硫蛋白巯基的氧化,从而减少氧化胁迫的分析较少。目前尚不清楚MTs与金属结合和ROS清除之间的相互作用。有学者认为,当ROS与MTs的Cys残基发生氧化反应时,释放的金属可能参与信号转导[64]。
动物体中金属响应元件MRE主要通过与其特异结合的转录因子MTF结合,调控该基因对金属的响应应答。然而,由于植物金属硫蛋白比动物MTs发现晚,进展相对缓慢,大部分植物MTs的分离纯化和检测方法还未成熟,因而限制了植物MTs调控机制的研究。尽管部分植物MTs基因的启动子中还存在茉莉酸、脱落酸以及分生组织细胞激活有关的顺式作用元件,暗示MTs参与诸多过程,调节植物的生长发育和对环境的适应。然而,其转录激活的关键元件、调节蛋白的鉴定、互作蛋白的筛选及明确的信号传导途径等方面信息非常有限,急需展开更为详尽的研究。
综上,挖掘植物MTs的潜在功能,探索重金属解毒、生物及非生物抗性中发生的调控机制,利用基因工程手段提高生物的胁迫抗性和生物修复能力,仍然是今后研究的重要内容。
