高效根结线虫生防真菌筛选及其性能研究
2021-12-20赵俊杰刘莹莹李亮亮陈国参王继雯
李 磊, 赵俊杰, 刘莹莹, 甄 静, 李亮亮, 陈国参, 慕 琦, 王继雯
(1. 河南省微生物工程重点实验室,郑州 450000;2. 河南省科学院生物研究所有限责任公司,郑州 450000)
根结线虫属于线虫门、侧尾腺纲、垫刃目、异皮科、根结线虫属[1],其主要危害作物的根部,能侵染根部细胞,使根部输导组织遭到破坏,从而失去吸收养分和水分的能力,导致作物营养不良而早衰,甚至整株干枯死亡。1885年,Berkeley最先[2]在黄瓜根际发现根结线虫,此后不断有新种被发现。约有80多种根结线虫种类被报道[3],而我国记录的有效种有39个[4]。蔬菜根结线虫寄生范围广、繁殖速度快、侵染具有掩蔽性且能通过病土、病苗和灌水等方式传播[5-6],防治比较困难,给蔬菜生产造成巨大的损失,因此对根结线虫的防治已经成为一项非常重要的农业生产任务。
已有的根结线虫病害的防治措施主要包括化学防治、物理防治、农业防治、抗病育种和生物防治等[7]。生物防治是近年来新兴起的一种防治方法,生物防治所筛选的目标拮抗物均来源于自然环境中,对土壤环境友好,不污染环境,绿色环保,具有可持续性,符合绿色农业的发展要求,是一种比较理想的防治技术[8]。
生物防治蔬菜根结线虫病害的前提是获得具有生防作用的菌株,而如何高效地筛选出生防菌株是最为关键的问题[9]。马金慧等[10]研究表明哈茨木霉菌株TRI2发酵液在48 h时可以100%杀死根结线虫,Zhang等[11]研究表明长枝木霉菌株T6对南方根结线虫的二龄幼虫具有较强的寄生和致死作用。Bokhari等[12]的研究发现哈茨木霉、康宁木霉、绿色木霉和钩状木霉均有防治爪哇根结线虫的活性。翟明娟等[13]研究表明绿色木霉菌株Tvir-6发酵液在24 h内对根结线虫二龄幼虫的校正死亡率高达98.5%,Burgwyn等[14]研究表明哈茨木霉和绿色木霉发酵滤液均能显著降低南方根结线虫卵的孵化和二龄幼虫的活性。卵是根结线虫生活史中的一个重要阶段,也是真菌防治作用最敏感的一个时期[15]。根结线虫的外壳有脂质层、几丁质层和卵黄层组成,其中几丁质的含量约占整个卵壳成分的40%[16-17]。在根结线虫卵壳中几丁质层结构坚固是防止真菌侵染的重要屏障[18]。真菌寄生根结线虫虫卵是在细胞机械压力和酶类共同作用下完成的,高活性的几丁质酶可以软化根结线虫卵壳降低其卵壳通透性有利于真菌菌丝对卵壳的穿透[19]。因此,几丁质酶的活性是评价真菌生防潜力的重要指标。目前对棘孢木霉的研究多集中在其对尖孢镰刀菌[20]和叶枯病菌[21]等病原菌的防治作用上,关于棘孢木霉对根结线虫有生防作用却未见报道。本研究以产几丁质酶活性和离体拮抗试验为筛选指标,建立一种有效的体系,能够筛选出具有防治根结线虫潜力的生防菌株,获得能够实际应用于蔬菜生产中防治根结线虫的有效菌种资源,为蔬菜根结线虫生防菌剂的开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品
2018年6月于安阳滑县根结线虫病害发病的蔬菜大棚中采集了番茄根际土样和根结组织样品,于4 ℃保存备用。
1.1.2 培养基
分离培养基:磷酸二氢钾1 g,蛋白胨5 g,硫酸镁0.5 g,葡萄糖10 g,琼脂20 g,孟加拉红水溶液3 mL,蒸馏水定容至1 000 mL,pH自然,121 ℃灭菌30 min。临用前,每100 mL培养基加入1%链霉素0.3 mL。
PDA培养基:去皮马铃薯200 g,切成小块,加入蒸馏水煮沸30 min,用纱布过滤,向滤液中加入蔗糖20 g,琼脂20 g,补蒸馏水定容至1 000 mL,pH自然,121 ℃灭菌30 min。
筛选培养基:蔗糖3 g,硝酸钠2 g,磷酸氢二钾1 g,氯化钾0.5 g,硫酸亚铁0.5 g,硫酸镁0.5 g,加入胶体几丁质2 g,琼脂20 g,蒸馏水定容至1 000 mL,pH 7.0,121 ℃灭菌30 min。
种子培养基:去皮马铃薯200 g,切成小块,加入蒸馏水煮沸30 min,用纱布过滤,向滤液中加入蔗糖20 g,补蒸馏水定容至1 000 mL,pH自然,121 ℃灭菌30 min。
测定培养基:硝酸钠2 g,磷酸氢二钾1 g,蔗糖3 g,氯化钾0.5 g,硫酸亚铁0.5 g,硫酸镁0.5 g,加入胶体几丁质2 g,蒸馏水定容至1 000 mL,pH 7.0,121 ℃灭菌30 min。
发酵培养基:去皮马铃薯200 g,切成小块,加入蒸馏水煮沸30 min,用纱布过滤,向滤液中加入蔗糖20 g,补蒸馏水定容至1 000 mL,pH自然,121 ℃灭菌30 min。
1.2 方法
1.2.1 真菌菌株分离纯化
称取根际土样10 g,溶于装有90 mL无菌水的250 mL三角瓶中,摇床振荡10 min,摇匀即为10-1稀释液,将样品依次稀释至10-4,分别涂布于分离培养基上,25 ℃培养箱培养,挑取单菌落,纯化,保存备用。
用自来水将根结组织上的泥土冲洗干净,用0.5%次氯酸钠溶液浸泡5 min,无菌水冲洗3次,用已灭菌的剪刀将根组织剪成0.5 cm长的小段,用灭菌的镊子夹取3~5段根组织接于分离培养基上,25 ℃培养箱培养,待根组织周围长出菌丝体,纯化,保存备用。
1.2.2 几丁质平板透明圈法初筛
选取菌丝体生长良好的菌株平板,用打孔器打孔,得到直径为5 mm的菌块,将菌块接于筛选培养基上,每个筛选培养基上接3个菌块,每个处理重复3次,25 ℃培养箱培养5 d,观察菌块周围是否出现水解透明圈,测量透明圈直径(D)和菌落直径(d)。
1.2.3 几丁质酶活的测定
将初筛选出的菌株接于种子培养基(装液量50 mL/250 mL)中,25 ℃,180 r/min培养48 h后,按0.5%接种量接入测定培养基(装液量50 mL/250 mL)中,25 ℃,180 r/min培养48 h后培养液用滤纸过滤。取10 mL离心管两支,分别加入1 mL滤液和1 mL含量为1%几丁质胶体,一支离心管于4 ℃放置作为对照,另一支离心管于40 ℃水浴60 min,水浴结束后,在样品和对照中均加入1 mL DNS溶液,沸水浴10 min,冷却室温后,加入2 mL蒸馏水,4 000 r/min离心10 min,取上清液于540 nm波长下测定吸光度值,每个处理重复3次。根据N-乙酰基-D-氨基葡萄糖标准曲线计算还原糖含量。酶活力单位定义:在上述条件下,1 min催化底物生产1 μmol N-乙酰基-D-氨基葡萄糖所需要的酶量作为1个酶活力单位(U)。
1.2.4 菌株鉴定
真菌菌株的鉴定综合其形态学特征与rDNA-ITS(Internal Transcribed Spacer)序列分子鉴定结果。其中真菌形态学的鉴定参照《真菌鉴定手册》,将真菌接种于PDA固体培养基中,25 ℃培养7 d后观察菌落的颜色、菌丝形态、生长速率等特征,同时采用显微镜观察其孢子的形态特征。
分子生物学鉴定采用真菌试剂盒提取菌体总DNA。以提取的总DNA为模板,利用ITS通用引物 ITS1(5′-TCCGTAGGTGAACCTGCGC-3′)和ITS4(5′-TCCTCCGCT TAT TGATATGC-3′)扩增供试菌的片段。PCR体系为50 μL体系:DNA模板2 μL,上游引物2 μL,下游引物2 μL,10×PCR buffer 5 μL,dNTP 4 μL,Taq酶1 μL,dd H2O 34 μL。PCR 反应条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,循环40次;72 ℃再延伸10 min。PCR反应产物经1%琼脂糖凝胶电泳检测,检测后进行测序分析。测序结果使用NCBI中(National Center Forbiotechnology Information)的GenBank数据库进行Blast同源性比对。选取同源性较高的模式菌株的ITS序列,采用mega 5.0软件中的邻接(neighbor joining,NJ)法进行系统发育分析。
1.2.5 菌株对根结线虫虫卵的寄生试验
将初筛选出的菌株在PDA培养基上25 ℃培养7 d,使菌丝长满整个平板。用无菌水冲洗长满菌丝体的平板,经无菌滤布过滤,收集得到孢子悬液。采用血球计数板计数,调整孢子悬液浓度为1×107CFU/mL。将病根洗净,在解剖镜下直接挑取新鲜的卵块,用1%次氯酸钠震荡解离卵块,收集游离卵,经2%次氯酸钠表面消毒后无菌水冲洗,制成100个卵/mL的悬浮液。取无菌12孔细胞培养板,每孔接种1 mL孢子悬液和1 mL卵悬液。每个处理重复3次。以加无菌水作为对照。在pH自然温度为25 ℃条件下,培养7 d后,观察卵的寄生情况,并计算卵的寄生率。计算公式:卵寄生率=(被寄生卵数/加入卵总数)×100%。
1.2.6 菌株对根结线虫虫卵孵化的抑制作用
将筛选出的菌株接入种子液培养基(装液量50 mL/250 mL)中,在pH自然,25 ℃条件下,180 r/min培养48 h后,按0.5%接种量接入发酵培养基(装液量50 mL/250 mL)中,在25 ℃条件下,180 r/min培养72 h后,获得发酵液,10 000 r/min离心10 min,经滤膜孔径为0.22 μm过滤器过滤得到上清液。取无菌12孔细胞培养板,每孔接种1 mL发酵上清液和1 mL卵悬液。每个处理重复3次。以空白发酵培养基作为对照。在25 ℃条件下,分别培养1、3、5、7和9 d后,观察卵的孵化情况,并计算卵孵化的相对抑制率。计算公式:相对抑制率=(对照孵化线虫数-处理孵化线虫数)/对照孵化线虫数×100%。
1.2.7 菌株对二龄幼虫的致死作用
从洗净的病根上直接挑取新鲜的卵块于孵化装置中进行孵化,24 h后开始收集幼虫,制备浓度为100 条/mL幼虫悬液。真菌发酵液的制备方法与上述1.2.5相同。取无菌12孔细胞培养板,每孔接种1 mL发酵上清液和1 mL幼虫悬液。每个处理重复3次。以空白发酵培养基作为对照。在pH自然,25 ℃条件下,分别培养12、24、36、48和60 h后,观察二龄幼虫的致死情况,线虫僵直不动并用挑针触动不动者为死虫,线虫呈弯曲蠕动状态或挑针触动后活动者为活虫。计算公式:致死率=(幼虫死亡数/幼虫总数)×100%;校正致死率=[(处理线虫致死率-对照线虫致死率)/(1-对照线虫致死率)]×100%。
1.2.8 数据统计与分析
应用Excel软件对数据进行整理,采用DPS 7.05进行数据分析,样品与样品组之间用单因素方差分析中的图基(Tukey)检验进行数据分析。
2 结果与分析
2.1 几丁质平板透明圈初筛结果
从采集的根际土样和根结组织上共分离获得真菌168株。测定其在几丁质平板上形成透明圈直径值 (D)和菌落直径值(d),得到10株具有较高产几丁质酶活潜力的菌株,结果见表1,10株菌株的D/d值均高于2,菌株SFC-3的D/d值最高。

表1 菌株透明圈测定结果
2.2 几丁质酶活的测定
对初筛得到的10株菌株,培养48 h后的几丁质酶活进行测定。结果(图1)显示,10株菌株的几丁质酶活均大于1 U/mL,与测定透明圈直径/菌落直径的值(D/d)结果相一致,D/d值较高的菌株,几丁质酶活值也较高。其中酶活性最高的菌株为SFC-3,其酶活为2.07 U/mL。

不同小写字母表示差异显著(P<0.05);不同大写字母表示差异极显著(P<0.01)。图1 不同菌株几丁质酶活Figure 1 Chitinase activity in different strains
2.3 菌株鉴定结果
菌株SFC-3在PDA固体培养基上培养,菌落初期为白色,中心浅绿色,气生菌丝纤细、羊毛状,由中心向四周散布,菌落背面无色,菌落中期逐渐转变为浅绿色,中心呈深绿色[图2(a)],气生菌丝转变为棉絮状,菌落后期整体呈深绿色,在显微镜下观察其分生孢子为绿色,形状呈球形或椭球型,直径约为3 μm[图2(b)]。根据《真菌鉴定手册》初步判断菌株SFC-3为木霉属。将菌株SFC-3 的ITS序列的测定结果在GenBank上进行Blast比对分析,选取与其相近的模式菌株构建进化树,结果如图3所示。在进化树中,菌株SFC-3与棘孢木霉(Trichodermaasperellum)有最高相似度,同源性达到了99%。结合其形态学特征,鉴定菌株SFC-3为棘孢木霉(Trichodermaasperellum)。

图2 SFC-3在PDA平板上形成的菌落(a)及显微镜下的孢子的形态特征(b)Figure 2 Morphological characteristics of colonies(a)and spores under microscope of SFC-3 on PDA plates(b)

图3 基于ITS rDNA序列菌株SFC-3的系统发育树Figure 3 Phylogenetic tree of strain SFC-3 based on ITS rDNA sequences
2.4 不同菌株对根结线虫虫卵的寄生结果
不同菌株对根结线虫卵的寄生结果如图4所示。菌株对虫卵的寄生率与其产几丁质酶活(表1)的值呈正相关,产酶活能力越强,对虫卵的寄生率越高,其中寄生率最低的菌株为SFC-1,寄生率为41.29%;寄生率最高的菌株为SFC-3,其寄生率达到了78.86%,与其他菌株相比差异极显著(P<0.01);其余8个菌株的寄生率为43%~75%。菌株SFC-3对卵的寄生作用如图5所示,对照组中的虫卵其表面光滑,内容物均匀[图5(a)],菌株SFC-3处理组中被寄生的卵长满菌丝体 [图5(b)]。

不同小写字母表示差异显著(P<0.05);不同大写字母表示差异极显著(P<0.01)。图4 不同菌株对虫卵的寄生结果Figure 4 Parasitic results of different strains on eggs

(a)对照CK;(b) 菌株SFC-3处理。图5 菌株SFC-3对虫卵的寄生作用Figure 5 The parasitic effect of the strain SFC-3 on the eggs
2.5 菌株对根结线虫虫卵孵化的抑制作用
菌株SFC-3发酵滤液对根结线虫卵孵化的影响如图6所示:在第1 天菌株SFC-3发酵滤液对根结线虫卵孵化抑制率就达到了85%以上;第3 天,发酵液对虫卵的抑制率达到了90.81%;在第7天菌株SFC-3发酵滤液对线虫卵孵化抑制率最高达96.51%。这说明菌株SFC-3对根结线虫虫卵孵化有良好的抑制效果。

不同小写字母表示差异显著(P<0.05);不同大写字母表示差异极显著(P<0.01)。图6 菌株SFC-3对线虫卵孵化的相对抑制率Figure 6 Relative inhibition rate of the strain SFC-3 on hatching of nematode eggs
2.6 菌株对二龄幼虫的致死作用
菌株SFC-3对二龄幼虫的致死作用如图7所示,随着时间增加,菌株对二龄幼虫的校正致死率随之增长,在24 h达到了85.64%,在48 h达到最高点93.37%。这表明菌株SFC-3在防治根结线虫虫害中有良好的潜力。
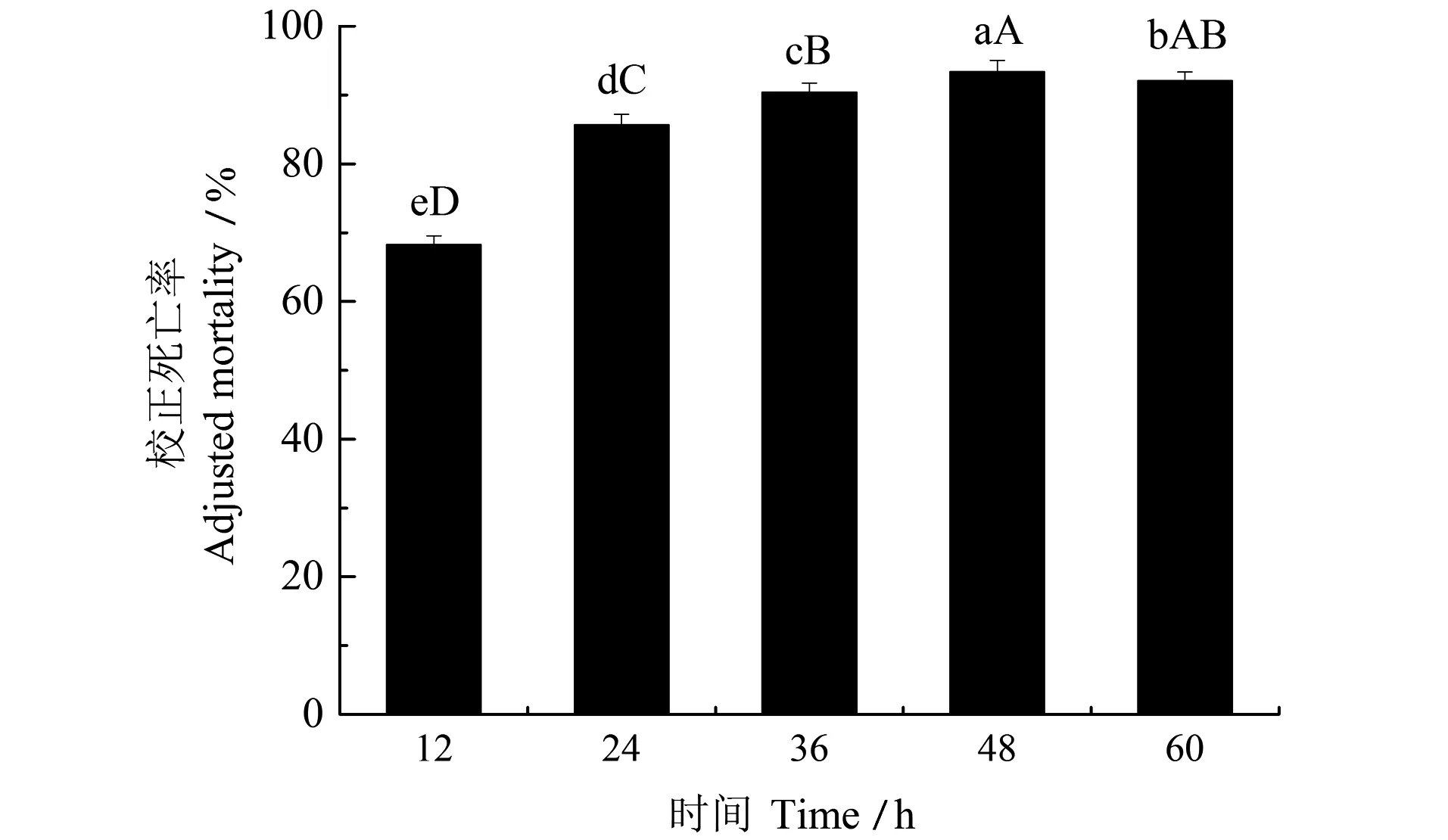
不同小写字母表示差异显著(P<0.05);不同大写字母表示差异极显著(P<0.01)。图7 菌株SFC-3对二龄幼虫的校正致死率Figure 7 Corrected mortality of the strain SFC-3 against the second juveniles
3 讨论与结论
根结线虫的生活史是从虫卵到四龄成虫,在整个阶段中卵的孵化至二龄幼虫的形成阶段是暴露在根外土壤中的,其余阶段都是寄生在根组织中,因此从线虫卵孵化到二龄幼虫的形成是防治根结线虫的重要时期。研究表明:利用SFC-3发酵滤液作用根结线虫卵第1 天就对卵孵化抑制率达到了85%以上,因此,可以从虫卵孵化第1 天开始使用菌株SFC-3发酵滤液来抑制虫卵孵化,不但对根结线虫防治效果较好,而且可以有效节约防治时间和生产成本。菌株杀死虫卵主要是通过寄生作用,卵囊外层为胶质,真菌菌丝可以进行穿透,加上真菌在生长过程中的一些分泌物及代谢产物如蛋白酶类,水解酶类会破坏卵的结构影响其正常的发育从而杀死虫卵;菌株杀死二龄幼虫则主要靠其高活性的几丁质酶溶解二龄幼虫外壳致其死亡。从机理和抑制效果来看,该菌株在对虫卵的致死效果要优于对二龄幼虫的致死效果。
研究从番茄根际土壤筛选到一株高效抗蔬菜根结线虫的菌株SFC-3,经鉴定为棘孢木霉。在实验室条件下,通过根结线虫虫卵寄生实验和二龄幼虫致死率实验发现:菌株SFC-3对虫卵的寄生率最高达78.86%,对根结线虫虫卵孵化的相对抑制率最高达96.51%,对二龄幼虫的校正死亡率达到93.37%。因此,菌株SFC-3是一株具有潜力的抗根结线虫菌株。
