减瘤性根治性前列腺切除术对骨转移前列腺癌患者的临床疗效分析
2021-12-20蒋铭心熊天宇叶小波邢念增金木兰杨敏福牛亦农
蒋铭心 苏 瑶 熊天宇 叶小波 靳 松 邢念增 金木兰 杨敏福* 牛亦农,6*
(1.首都医科大学泌尿外科研究所 首都医科大学附属北京朝阳医院泌尿外科,北京 100020;2. 首都医科大学附属北京朝阳医院核医学科,北京 100020;3.清华大学附属北京清华长庚医院泌尿外科,北京 102218;4.中国医学科学院北京协和医学院肿瘤医院泌尿外科,北京 100021;5.首都医科大学附属北京朝阳医院病理科,北京 100020; 6.首都医科大学附属北京世纪坛医院泌尿外科,北京 100038)
在全球,前列腺癌位居男性癌症发病率第二位、病死率第五位。据统计,2018年前列腺癌全球新发病例约127.6万例,死亡病例约35.9万例[1]。根治性前列腺切除术或放射治疗(以下简称放疗)是器官局限性及局部进展期前列腺癌的标准治疗选择。对于转移性前列腺癌,雄激素剥夺疗法是最主要的标准治疗方式[2-3],而针对原发灶的局部治疗,目前仍存在争议,一些回顾性研究[4-9]表明,减瘤性根治性前列腺切除术具有可行性,并能给患者带来生存获益。本研究旨在对行减瘤性根治性前列腺切除术的骨转移前列腺癌患者的临床疗效进行回顾性分析。
1 资料与方法
1.1 一般资料
从首都医科大学附属北京朝阳医院病案系统收集2010年1月至2021年7月于泌尿外科住院手术治疗的前列腺癌患者的临床资料,从中筛选出全身骨扫描提示存在异常的181例患者。一名经验丰富的核医学科医生对这部分患者的骨扫描结果重新阅片,其中97例结合电子计算机断层扫描(computed tomography,CT)或者磁共振成像(magnetic resonance imaging,MRI),明确存在骨转移灶的共计34例,时间跨度为2012年2月至2021年6月。研究方案经首都医科大学附属北京朝阳医院伦理委员会批准,批准编号:2021-科-495。
1.2 手术方法
患者全身麻醉,仰卧位,头高脚低,常规消毒铺巾,留置F18双腔尿管,脐下切口示指钝性分离腹膜外间隙,置入球囊扩张器扩大腹膜外空间,置入腹腔镜,以脐为顶点分别于脐下双侧腹直肌外缘、髂前上棘内侧分别置入12 mm和5 mm套管(Trocar),清扫前列腺表面脂肪组织,打开双侧盆筋膜,游离至前列腺尖部,缝扎阴茎背深静脉复合体(dorsal vascular complex,DVC)。分离膀胱颈与前列腺交界,靠近前列腺底部剪开膀胱颈,保留膀胱颈口,向上提起前列腺底部,分离出双侧输精管及精囊,切断双侧输精管。游离至前列腺尖部,注意保护直肠,处理双侧前列腺侧韧带,切开耻骨前列腺韧带及DVC,暴露并切断尿道,完整切除前列腺、精囊及部分输精管。根据个体情况由术者决定是否清扫双侧盆腔淋巴结,在导尿管引导下使用3-0可吸收线连续缝合尿道与膀胱颈,常规留置引流管,关闭切口,术后留置导尿。
1.3 观察与随访指标
记录患者基线资料[包括年龄、体质量指数(body mass index,BMI)、东部肿瘤协作组织(Eastern Cooperative Oncology Group,ECOG)体能状态评分等]、围手术期数据、病理结果。对患者进行随访,记录术后前列腺特异抗原(prostate specific antigen, PSA)变化情况及骨扫描复查结果,记录远期预后情况。无生化进展生存期(biochemical progression-free survival,BPFS)定义为从手术当天开始到出现PSA生化进展的时间。总生存期(overall survival,OS)为患者自手术当天开始至死亡的时间。
1.4 统计学方法
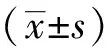
2 结果
2.1 患者临床特征
本研究中34例骨转移前列腺癌患者接受了减瘤性根治性前列腺切除术,包括1例开放手术和33例腔镜手术,基本临床特征总结于表1。2例患者因最高PSA>1 000 ng/mL未行前列腺穿刺活检,另有1例患者前列腺穿刺活检Gleason评分数据缺失。22例患者术前进行了内分泌治疗,中位内分泌治疗时间7.5个月,其中12例患者术前PSA下降至1 ng/mL以下。6例患者术中未行淋巴结清扫,余平均清扫淋巴结数目9个,8例患者淋巴结阳性,中位淋巴结阳性数目4.5个。因内分泌治疗后反应,1例患者术后病理阴性,无法判断病理T分期和Gleason评分,另有2例患者仅无法判断术后病理Gleason评分。
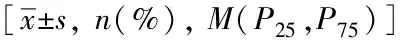
表1 患者的临床资料
2.2 手术并发症情况
术后1个月内9例患者出现≥1种并发症,其中淋巴瘘1例,尿瘘1例,泌尿系感染2例,尿失禁6例,均为Clavien-Dindo Ⅰ~Ⅱ级。6例尿失禁的患者术后3个月时尿控功能基本恢复,无须使用尿垫。
2.3 生存预后情况
中位随访时间29.0个月,2年总生存率85.9%。所有患者术后都进行了内分泌治疗,中位无生化进展时间75.0个月,2年无生化进展生存率63.9%。单因素分析发现骨转移灶数目(P=0.021)、切缘阳性/阴性 (P=0.049)是影响无生化进展生存期的危险因素。进一步分组比较发现,骨转移灶数目≥5组患者的平均BPFS为28.1个月,而骨转移灶数目<5组的患者平均BPFS为63.2个月(P=0.012,图1);切缘阳性组患者的平均BPFS为34.8个月,而切缘阴性组患者的平均BPFS为70.3个月(P=0.029,图2)。在多变量危险因素分析中(表2),切缘阳性/阴性与BPFS显著相关(P=0.026),是独立危险因素。
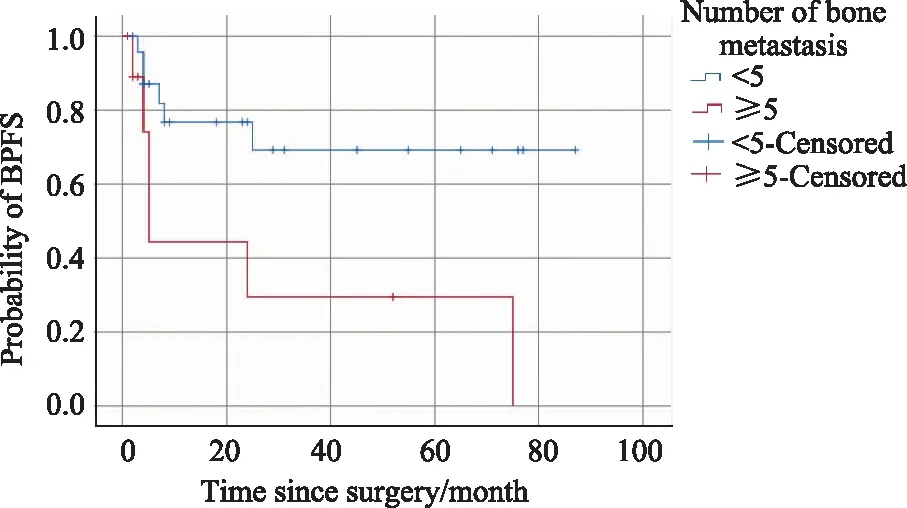
图1 Kaplan-Meier估计骨转移灶数目≥5与<5两组患者的无生化进展生存期 Fig.1 Kaplan-Meier estimates of BPFS in patients with bone metastasis ≥5 or<5BPFS: biochemical progression-free survival.
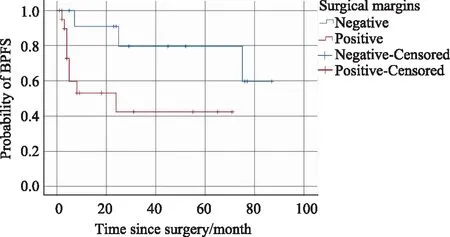
图2 Kaplan-Meier估计切缘阳性和阴性两组患者的无生化进展生存期 Fig.2 Kaplan-Meier estimates of BPFS in patients with positive or negative surgical marginsBPFS: biochemical progression-free survival.
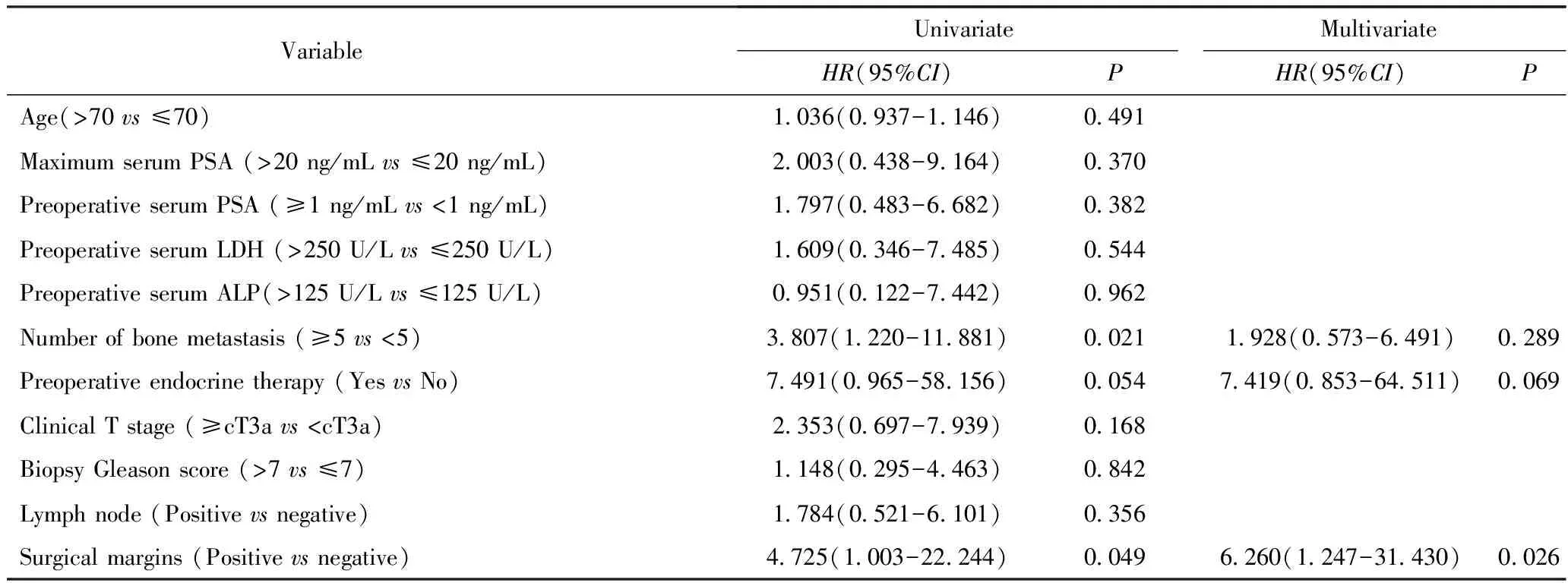
表2 患者无生化进展生存期的危险因素分析 Tab.2 Analysis of risk factors for BPFS of patients
3 讨论
转移性前列腺癌是严重影响前列腺癌患者预后的重要疾病阶段。由于前列腺癌起病隐匿,早期多无明显症状,往往初次诊断时就已发生转移,最常见骨转移。在美国,转移性前列腺癌仅占新发前列腺癌的5%~6%[10],而在我国,这一比例却高达54%[11],雄激素剥夺治疗是转移性前列腺癌最广泛使用的基础疗法,但随着疾病进展,多数将转变为转移性去势抵抗性前列腺癌,5年总体生存率不足30%[12]。原发病灶的减瘤手术在乳腺[13]、结肠[14]、卵巢[15]和肾[16-17]等转移性恶性肿瘤的治疗中发挥着不可或缺的作用,但在转移性前列腺癌中的作用尚不明确[18]。
有研究[19]显示,相较于局限性前列腺癌,转移性前列腺癌接受手术治疗会增加手术时间过长、术中失血量过多和尿失禁等风险。本研究中所有患者手术顺利完成,中位手术时间180 min,中位出血量100 mL,术中未出现需要输血的情况,中位住院时长13.5 d,术后1个月内未出现严重并发症。虽然6例(17.6%)患者术后拔出尿管后即刻尿控欠佳,出现了尿失禁的情况,但在术后3个月复查时尿控恢复可,不再需要尿垫。李高翔等[20]发现,25例寡转移前列腺癌患者和222例局限性前列腺癌患者行根治性前列腺切除术后,两者的并发症发生率(24%vs22.1%)差异无统计学意义,提示并发症风险并非寡转移性前列腺癌患者行前列腺癌根治术的限制性因素。Sooriakumaran等[4]报道了接受根治性前列腺切除术的106例转移性前列腺癌患者,其中79%的患者术后90 d内未出现并发症,2年总体生存率约为89%。Steuber等[5]比较了43例接受减瘤性根治性前列腺切除术和40例未手术接受全身治疗的低负荷骨转移(骨转移灶数目≤3)的前列腺癌患者的预后,虽然没能证明手术能带来生存获益,但局部并发症发生率较低,手术组仅为7%(2例吻合口狭窄和1例严重尿失禁),非手术组为35%(输尿管梗阻或尿潴留需要导尿和/或经尿道电切治疗)。这些数据表明,如果是经验丰富的外科医生,减瘤性根治性前列腺切除术在技术上是安全可行的,且能减少局部肿瘤进展导致的远期并发症,如血尿、排尿困难、尿潴留、肾积水或者下肢水肿等。
本研究显示,切缘阳性/阴性是患者无生化进展生存期的独立危险因素,切缘阳性组的平均无生化进展生存期较阴性组显著缩短。Silberstein等[21]和 Thalgott等[22]报道了对于局部晚期前列腺癌患者术前应用一段时间的新辅助内分泌治疗能够明显缩小前列腺体积,达到临床肿瘤降期,从而降低手术难度,减少手术切缘的阳性率。郑毅等[23]报告了1例转移性前列腺癌患者在经过6周的多西他赛化疗+内分泌治疗后行根治性前列腺切除术,切缘阴性,术前PSA 43.18 ng/mL,术后近5个月复查血PSA接近于0。因此,对于骨转移性前列腺癌患者行术前内分泌治疗是有必要的,根据具体情况可结合化学药物治疗(以下简称化疗),能使原本无法手术切除前列腺原发灶的患者,获得了完整切除的可能性。考虑到存在骨转移灶,特别是对于切缘阳性的患者,术后也需要继续内分泌治疗,必要时还需联合放化疗等其他治疗,以控制疾病进一步发展。
骨转移灶的数目也影响患者的无生化进展生存期,尽管在多因素分析中差异无统计学意义。随访确认死亡的患者均为术前骨扫描转移灶数目≥5,在一定程度上说明骨转移数目越多,预后相对越差。但是本研究显示,术前骨扫描转移灶数目≥5接受减瘤性根治性前列腺切除术的患者中也有术后随访时间超过9年者,其最高PSA为47.88 ng/mL,术前内分泌治疗2年,PSA降至0.181 ng/mL,后出现反弹升高至0.489 ng/mL,遂行手术治疗。术后持续内分泌治疗,目前尿控和PSA均控制满意。表明骨转移灶数目的多少不是判断是否手术的绝对指征,经过慎重筛选和认真准备的患者手术获益是可观的。
Culp等[6]回顾性分析了8 185例转移性前列腺癌患者,发现接受过减瘤性根治性前列腺切除术或近距离放射治疗的患者的5年总体生存率和预测疾病特异性生存率远高于单独接受抗雄激素治疗的患者。Gratzke等[7]的研究显示,在1 538例转移性前列腺癌患者中74例患者接受了根治性前列腺切除术,5年总体生存率为55%,而未手术的仅为21%。本研究队列2年总体生存率为85.9%,6例患者术后随访时间超过5年,术后生活质量可,表明减瘤性根治性前列腺切除术具备一定的生存获益。
一项纳入8 197例转移性前列腺癌患者的回顾性研究显示,原发灶的局部治疗(根治性前列腺切除术或放疗)有显著的癌症特异性生存率获益,特别是对于癌症特异性死亡风险<40%的患者[8]。另一项纳入13 692例转移性前列腺癌患者的回顾性研究[9]显示,494例患者接受了局部治疗(根治性前列腺切除术或放射治疗),减瘤性根治性前列腺切除术显著改善了癌症特异性生存率,尤其是Gleason评分≤7,≤cT3以及M1a的患者。但是,并非所有患者的原发灶的局部治疗都能改善预后,Löppenberg等[24]研究发现只有当患者3年总体死亡风险<72%时,原发灶局部治疗(根治性前列腺切除术或放疗)才能使患者获益。本研究显示3例术前考虑为转移去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)的患者行减瘤性根治性前列腺切除术后3个月内就出现了生化进展,其中2例患者于随访期间病故,预示诊断mCRPC的患者行减瘤性根治性前列腺切除术获益不大,需结合患者自身情况慎重考虑是否行手术治疗。综上,进行了辅助内分泌治疗且未处于激素抵抗阶段,穿刺Gleason评分≤7、≤cT3a、骨转移灶数目<5的骨转移前列腺癌患者行减瘤性根治性前列腺切除术获益的可能性大。
本研究局限在小样本的单臂回顾性研究,研究对象随访时间参差不齐,未能对行减瘤性根治性前列腺切除术患者的总生存期进行进一步探讨,对患者无生化进展生存期进行了多因素分析,纳入了3个自变量,考虑1个自变量至少对应20个阳性样本的原则,这可能导致研究结论存在一定偏倚,因此还需要大样本的前瞻性研究来确认减瘤性根治性前列腺切除术的长期疗效。
