心脏手术后脑梗死的危险因素分析
2021-12-20胡文莉侯登榜王粮山来永强侯晓彤
胡文莉 侯登榜 王粮山 贾 明 来永强 侯晓彤 王 红*
(1. 空军特色医学中心超声诊断科,北京 100142; 2. 首都医科大学附属北京安贞医院心外ICU,北京 100029; 3. 首都医科大学附属北京安贞医院心脏外科中心,北京 100029)
我国心脏外科手术量仍逐年上升[1],如果术后发生脑并发症,如脑梗死、脑出血、癫痫、缺血缺氧性脑病等,将延长住院时间、增加住院费用、影响患者生活质量,甚至危及生命。既往研究[2-4]显示,高龄、高血压病、糖尿病、高脂血症、手术时间延长、术中低血压、术后心房颤动(以下简称房颤)等是心脏外科手术后脑并发症的风险因素。近年来,越来越多的术者为了更准确地判断患者术后脑并发症的风险、提高手术效果,术前积极采用影像检查,如颈动脉超声甚至颅内计算机断层血管造影协助评估风险。显然,颈动脉超声简单、无创、便于临床应用,但是,目前还不清楚何种颈动脉超声结果有助于临床预测。此外,找到在心外手术围术期可以控制的影响脑并发症的因素,积极加以干预,对提高手术效果意义重大。脑梗死是心外术后常见的脑并发症,本研究旨在分析、探讨基于颈动脉超声参数的心脏外科手术后患者并发脑梗死的风险因素。
1 对象与方法
1.1 研究对象
以首都医科大学附属北京安贞医院7A病房2020年1月-2020年12月住院手术的成人患者(≥18岁)作为研究对象,除去颈动脉超声数据缺失的患者101例、未行气管插管的心脏介入手术40例以及未行头颅电子计算机断层扫描(computed tomography, CT)检查的术后脑并发症(癫痫)患者1例,491例患者纳入本研究。选择其中诊断为脑梗死的患者为病例组(脑梗死组)9例,诊断为非脑梗死的患者为对照组(非脑梗死组),482例。
1.2 颈动脉超声
采用彩色多普勒超声诊断仪4~12 MHz线阵探头和2~5 MHz的凸阵探头,行双侧颈动脉彩色多普勒超声检查在手术前完成。先行二维超声连续横切扫查,再行纵切扫查。左侧从主动脉弓,右侧从无名动脉分叉处开始。从颈根部探测颈总动脉近心端,然后沿着血管走形向头侧移动,跨过颈动脉分叉处,分别探测颈内及颈外动脉。观察颈总动脉及其分叉处、颈内动脉血管壁的结构。彩色多普勒显像观察血流充盈状况,脉冲多普勒显示血流频谱。椎动脉从起始处开始扫查,自下而上观察血管走行、管腔内膜变化和有无异常回声,测量血流频谱[5]。取样线与血流方向的夹角<60°,多普勒取样容积为管腔的1/3~1/4。
1.3 手术及术后监护
患者入手术室后常规吸氧、心电监护、麻醉、行气管插管呼吸机/麻醉机辅助通气、穿刺桡动脉和颈静脉以实现监测和入液。由手术医生按术前讨论方案实施开胸心脏手术,手术完成并经过评估后逐层关闭胸腔、停止麻醉,血流动力学稳定的情况下转回重症监护室(intensive care unit, ICU)。
研究对象均由一组ICU医生进行监护,保证监护治疗的一致性。手术室和ICU毗邻,患者转运途中使用呼吸气囊人工呼吸,入ICU后立即转为呼吸机强制通气、连接心电监护,ICU医生按照各种心外手术后常规管理,给具备转入适应证的患者开具术后医嘱,观察生命体征、尿量、引流量和检验、检查指标并依病情变化按照诊治流程调整治疗。
1.4 变量定义以及脑并发症的诊断和治疗
颈动脉斑块定义为手术前超声探及颈总动脉或颈内动脉明显斑块或狭窄(>50%)。术前经颈动脉支架、椎动脉支架或颈动脉内膜剥脱术消除了病变的不予计算。
术中低血压:心外手术中平均动脉压小于60 mmHg(1 mmHg=0.133 kPa),持续超过15 min,不包括阻断和开放升主动脉伴随的短暂血压变化。
术后低心排综合征(简称术后低心排),定义为患者心外手术返回ICU后尽管优化了容量,心脏指数仍低于<2 L·min-1·m-2, 导致血压下降和组织低灌注[6]。
ICU医生和护士在患者麻醉苏醒或镇静停止后至少每天进行2次神经系统常规检查,包括对口头命令或疼痛刺激的反应、瞳孔大小和对光反射或其他脑干反射。当发现异常神经系统体征(如神志不清、抽搐、或四肢无活动等)时,在12 h内进行头颅CT,请神经科医生会诊确定诊断(检查阴性但无法排除脑梗的患者,依照会诊意见动态复查CT,直至确诊),并根据神经科医生的会诊意见进行治疗。经药物治疗、家属参与、环境调整等可以改善的谵妄不列入脑并发症[7]。
1.5 统计学方法
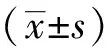
2 结果
2.1 患者临床结局
491例患者中487例患者存活出院或转院,住院存活率为99.2%。脑梗死9例,没有脑出血并发症,脑梗发生率为1.8%,发生时间为术后29(15~62)h。2例脑梗死患者死亡。脑梗死患者的机械通气时间和ICU时间均长于非脑梗死患者,出院生活能力评分明显低于非脑梗死患者差异有统计学意义(P<0.05),详见表1。
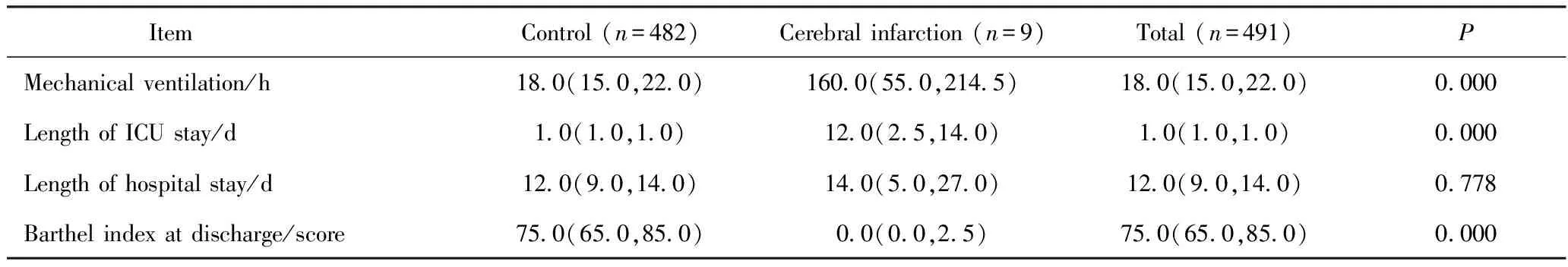
表1 患者住院治疗时间和出院生活能力比较Tab.1 Comparison of length of treatments and activities of daily living score at discharge M(P25, P75)
2.2 不同临床结局患者基线特征比较
脑梗死患者与非脑梗死患者相比,性别、年龄、共病比例等差异均无统计学意义(P>0.05)。双侧颈+椎动脉均有斑块的患者比例脑梗死组明显高于非脑梗死组,组间比较,差异有统计学意义(P<0.05),详见表2。
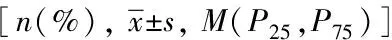
表2 不同临床结局患者基线特征
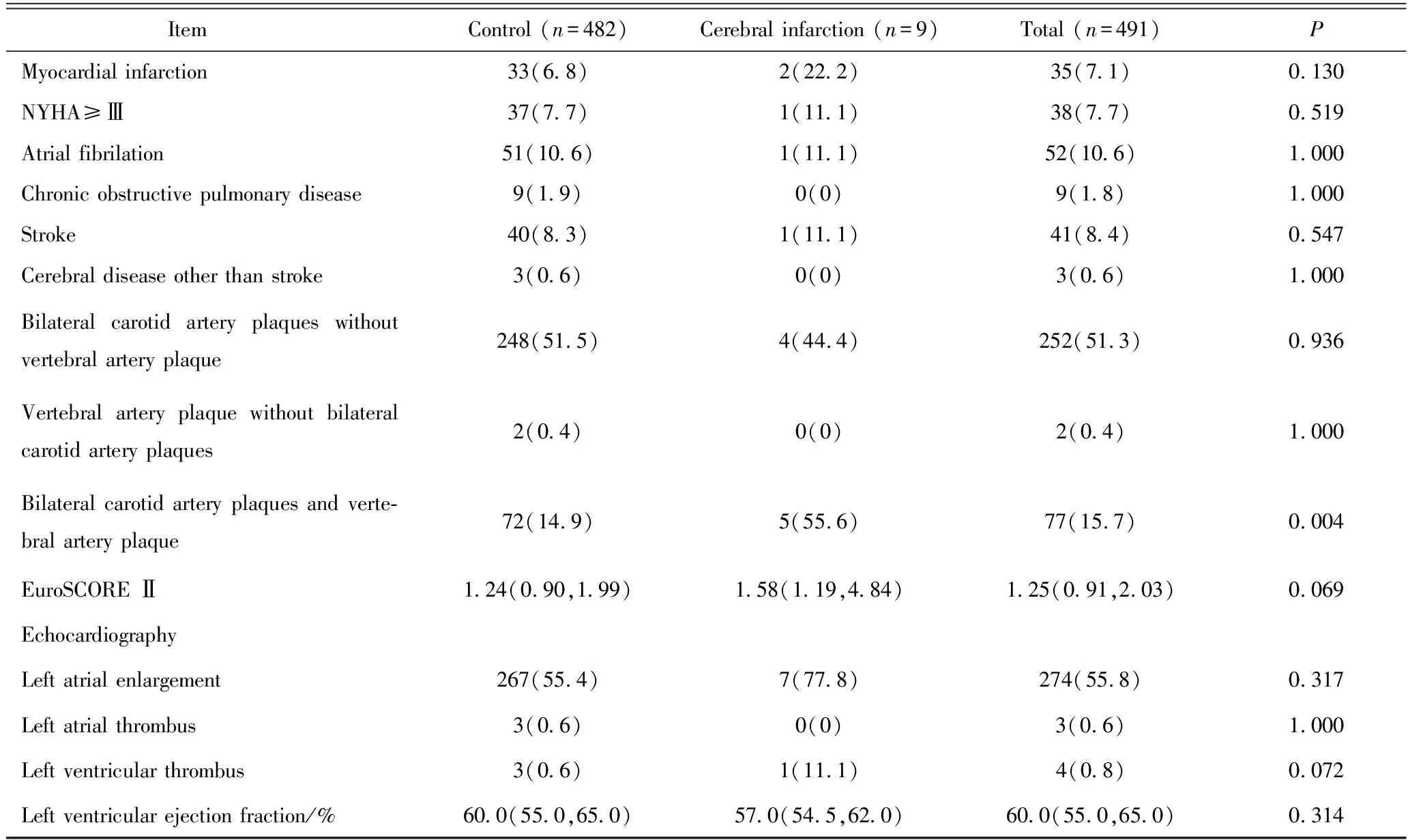
续表2
2.3 不同临床结局患者围术期的相关因素比较
脑梗死患者与对照患者相比,手术类型和手术时间差异无统计学意义,脑梗死患者术中低血压发生率高,脑梗死患者44.4%,非脑梗死患者4.1%,两组差异有统计学意义(P<0.001)。体外膜氧合(extracorporeal membrane oxygenation, ECMO)支持仅5例,脑梗死患者中ECMO支持比例高,脑梗死患者22.2%,非脑梗死患者0.6%(P=0.003)。脑梗死患者中术后新发房颤比例高于非脑梗死患者,脑梗死患者44.4%,非脑梗死患者4.8%(P=0.001,表3)。
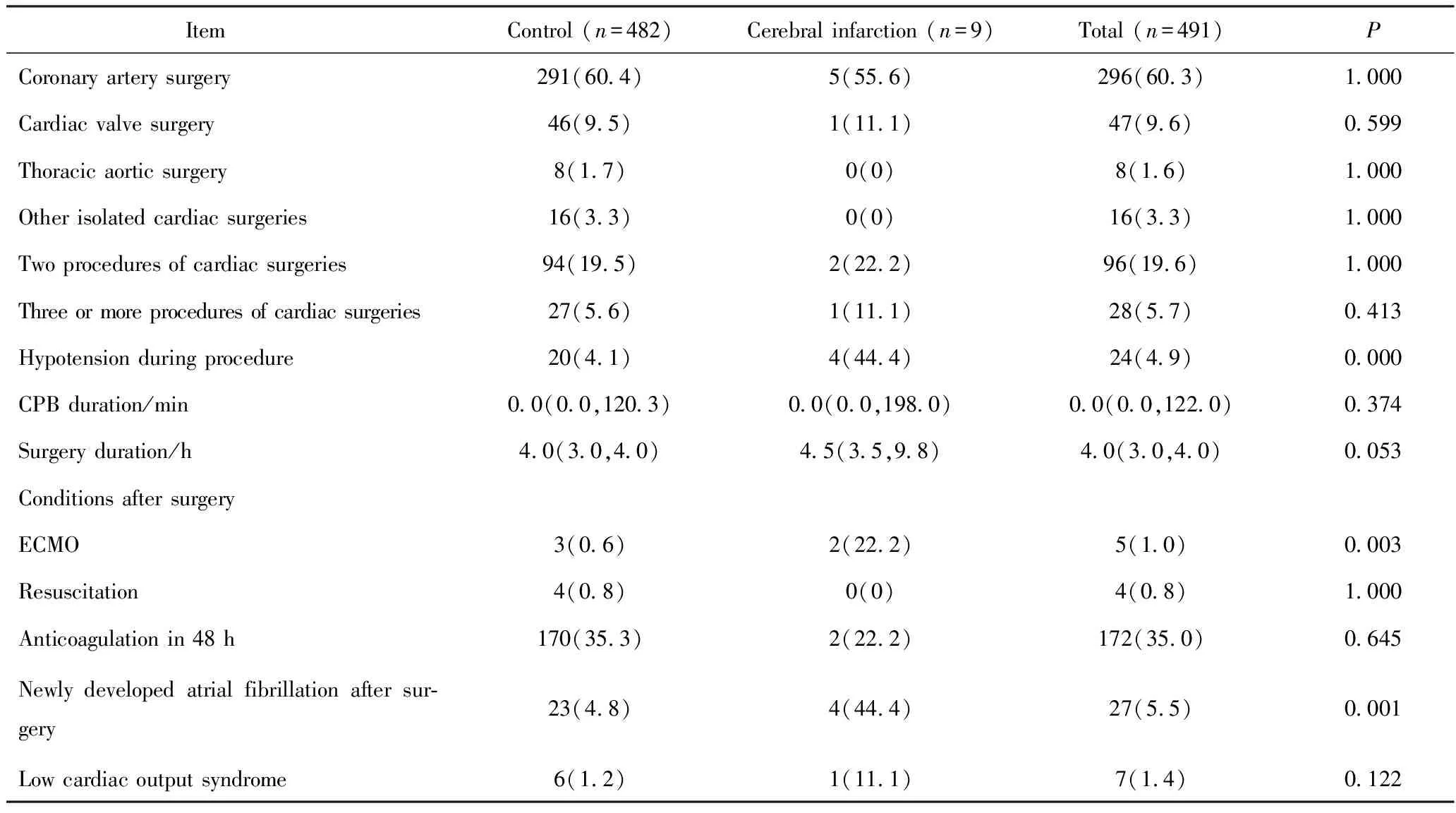
表3 不同临床结局患者围术期的相关因素
2.4 脑梗死风险的多因素分析
以是否脑梗死为因变量,以EuroSCORE Ⅱ高、双侧颈+椎动脉均有斑块、左室血栓、体表面积大、术中低血压、ECMO辅助、术后新发房颤和术后低心排为自变量,进行多因素Logistic回归分析。EuroSCORE Ⅱ高、双侧颈+椎动脉均有斑块、ECMO辅助和术后新发房颤是心脏手术后脑梗死的危险因素(P<0.05),详见表4。
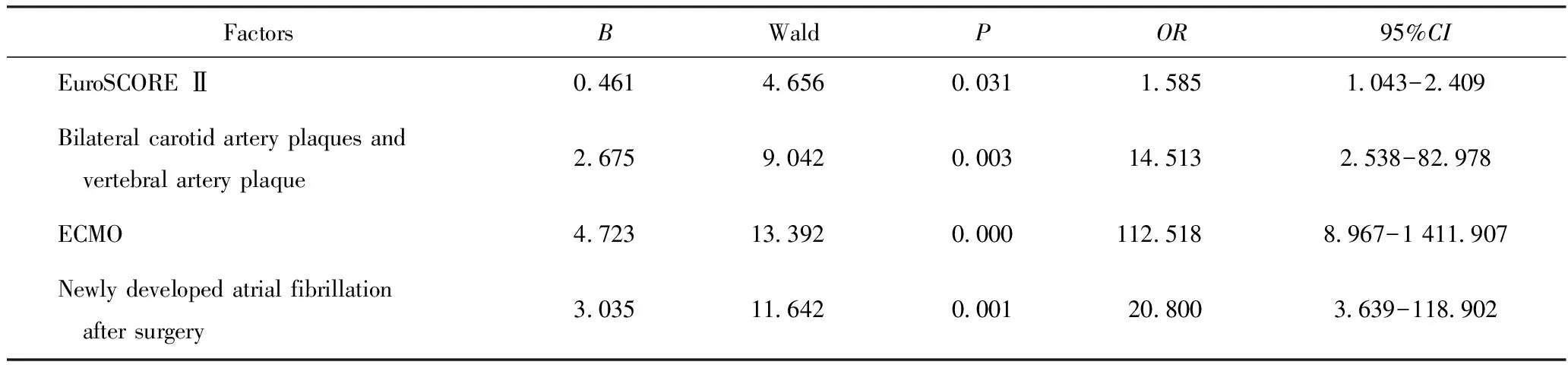
表4 Logistic回归分析风险因素
3 讨论
本研究中,491例心外手术患者在住院期间脑梗死的总发生率为1.8%,并发脑梗死患者的住院存活率约为77.8%。其次是没有双侧颈动脉斑块的患者无脑梗死并发症,EuroSCORE Ⅱ高、双侧颈+椎动脉均有斑块、ECMO辅助和术后新发房颤是心脏手术后脑梗死的独立风险因素。临床结局比较需要选择全部术后脑梗死的患者和全部非脑梗死患者,在其他基线特征没有统计学差异的前提下进行统计。
研究[4]显示,心外术后1个月脑梗死的发生率为1.5%~5.2%,本研究发生率较低,可能与以下原因有关:(1)既往研究[4]为术后1个月时的脑梗死发生率,本研究观察时间为住院期间,没有计算出院到术后1个月之间发生的脑梗死。(2)既往研究[2, 4]主要依靠磁共振成像(magnetic resonance imaging, MRI)诊断心外术后神经系统并发症,MRI可以探查到无临床表现的病灶,诊断脑梗死更为敏感。然而,本研究并发脑梗死患者的病死率较高,高于国外报道[3, 8]的14.9%~19.0%,原因也很可能与依靠CT检查诊断相关,即本研究中一些轻微的神经系统缺血损伤未被发现,诊断脑梗死的患者病情均比较严重。
存在共病或基础疾病的存在意味着患者病情较重或治疗难度较大。本研究没有发现高血压病、高脂血症、糖尿病、心肌梗死、心力衰竭、房颤、慢性阻塞性肺疾病和脑卒中史是并发脑梗死的风险因素,可能因为术前对每位择期手术患者的血压、血脂、心功能、肺功能、凝血功能等进行了充分的控制或调整。EuroSCORE是术前进行的一种以死亡作为评估终点的心脏手术风险评估系统,EuroSCORE Ⅱ复合了高龄、共病、炎性反应、手术复杂度等多种因素,预测死亡的效果更好[9],本研究发现EuroSCORE Ⅱ评分增高时,术后发生脑梗死的风险也增加。所以,此类患者的手术指征与手术适应证评价更应谨慎。
既往研究[10-12]虽然分析出很多风险因素,但是缺乏颈动脉超声的数据。双侧颈动脉斑块意味着:①脑供血已经受限;②全身性动脉硬化的存在,比如主动脉、颅内的动脉,这些部位的斑块有脱落栓塞、形成血栓等危险。本研究并发脑梗死的全部患者都有颈动脉斑块的基础病变,但是,脑组织由左右两条颈内动脉血管和左右两条椎动脉血管供血,分别形成颈内动脉系统和椎-基底动脉系统,颈内动脉系统和椎-基底动脉系统之间通过脑底动脉环交通。当脑底动脉环组成动脉中的一支阻塞或狭窄时,健侧血液可能代偿,减轻或消除血管阻塞或狭窄所引起的症状。所以,仅有颈动脉斑块或仅有椎动脉斑块不是心脏手术后脑梗死的独立风险因素、而双侧颈动脉和椎动脉均有斑块是心脏手术后脑梗死的独立风险因素。颈动脉支架、椎动脉支架或颈动脉内膜剥脱术可以部分解除脑供血不足的病理基础,目前小样本量研究[10]提示解除病变可能有利于改善预后,但是,支架或手术选择、干预时间选择等问题目前还没有达成共识,需要进一步研究。
术中低血压严重影响脑灌注,甚至有研究者[4]发现体外循环(cardiopulmonary bypass, CPB)中平均动脉压50~60 mmHg(1 mmHg=0.133 kPa)会比平均动脉压80~100 mmHg更容易发生脑缺血事件,这在高龄患者中尤为突出[4]。然而,本研究多因素分析没有得出术中低血压预测术后脑梗死的阳性结果,可能与:本研究对象年龄较小,目前术中的脑保护策略有所完善以及本研究包含了一部分心脏不停跳、非CPB的冠状动脉手术有关。
房颤是脑梗死的独立风险因素[11],本研究发现术后新发房颤,而非术前房颤是风险因素,这需要在手术后及早发现、积极预防和控制。然而,术后新发房颤立即形成左房血栓并造成脑栓塞的可能性很小,是否还存在左房血栓形成-血栓脱落栓塞之外的机制需要进一步研究。本研究发现ECMO辅助是脑并发症的风险因素,本课题组[7, 12]前期研究结果也显示心外术后ECMO辅助患者脑梗死的发生率是8%,高于无ECMO辅助患者,脑的缺血性损害与这类患者疾病严重,ECMO放置前低氧、低血压难以纠正有关。另外,ECMO动静脉插管激活凝血系统,这既包括接触激活,也包括内源性和外源性凝血系统以及血小板的激活,造成血栓形成和缺血事件。还有很少见的原因或诱因,如抢救中操作不当带来的气体栓塞、二氧化碳清除过快损害脑血管的调节能力等[12-13]。对于ECMO辅助带来的脑并发症,目前的认知还远远不足,在充分理解ECMO造成的病理生理改变的前提下,应该对有ECMO适应证的患者及早辅助,并遵循操作流程,做好细节,尽量减少脑并发症。
本研究局限性主要是发生脑梗死的患者例数少,可能影响研究结果。另外,单中心研究的固有缺陷和本研究缺乏中长期随访,可能使对心外术后脑梗死的发生率、病死率的把握不准确。今后仍需更大样本量的回顾研究或干预研究验证结果。
总之,颈动脉超声发现双侧颈动脉和椎动脉斑块是心脏外科术后并发脑梗死的风险因素,有必要实施心脏术前颈动脉超声筛查并对有风险的患者严格术中、术后管理。颈动脉支架、椎动脉支架或颈动脉内膜剥脱术是否有助于减少脑并发症还需要研究。
