青蒿素衍生物抗癌活性研究
2021-12-20代天志孙德群
陈 欢 代天志 孙德群
(西南科技大学生命科学与工程学院 四川绵阳 621010)
近 20 年来,随着经济的快速增长和工业化的发展,空气污染、生活方式改变、人口老龄化等使中国疾病谱发生了巨大变化,但是癌症仍然是目前全世界人类死亡的最主要原因之一。在中国,男性最常见的癌症类型是肺癌、胃癌、肝癌、结直肠癌和食道癌,而乳腺癌、肺癌、结直肠癌、胃癌和宫颈癌是中国女性的主要癌症类型[1]。我国每天将近有1万人确诊癌症,这相当于平均每分钟就会有7个人诊断出癌症。除了实体瘤的患病率高外,近年来人们对白血病的关注度也逐渐增高,死亡率占各类肿瘤的第六位,预后差,且儿童是白血病的高发人群。在2010年前就有文献报道我国的白血病患儿有200多万,并且每年以3~4万的速度增加[2]。癌症越来越低龄化和多药耐药性的频繁出现[3-5],使寻找有效的新抗癌潜在药物迫在眉睫。
青蒿素(Artemisinin)是我国科学家屠呦呦于1972年从菊科植物黄花蒿叶中提取分离出的一种萜类化合物。经长期临床研究表明,青蒿素是继乙氨嘧啶、氯喹、伯喹之后最有效的抗疟特效药,曾被世界卫生组织称作是“世界上唯一有效的抗疟疾药物”[6-8]。由于青蒿素在抗疟疾上所做的巨大贡献,人们掀起了对青蒿素研究的热潮,近年来的许多研究表明,青蒿素及其衍生物不仅是天然的抗疟疾药,也是有效的抗癌药。比如:青蒿琥酯对白血病、结肠、黑色素瘤、乳腺、卵巢、前列腺、中枢神经系统(CNS)和肾癌细胞具有抑制活性[9];双氢青蒿素对胰腺癌细胞、白血病细胞、骨肉瘤细胞和肺癌细胞也有显著的抗肿瘤活性,而且青蒿酮表现出比青蒿素更好的活性,并与其他抗癌药物有相当大的协同作用[10-11]。Galal等对60种肿瘤细胞株进行的体外抗肿瘤活性测定中,所合成的12种双氢青蒿素缩醛二聚体对非小细胞肺癌、中枢神经系统肿瘤、白血病细胞等癌细胞的IC50值在0.019~8.700 μmol/L之间。课题组前期对青蒿素衍生物的研究数据也表明青蒿素衍生物抗癌活性的显著及研究价值[12-14]。在进行相关的药理机理研究中,人们发现青蒿素类化合物强大的抗癌作用归因于一个特殊的活性结构——过氧基团。过氧基团与铁和血红素或血红素结合蛋白的相互作用,不仅能扰乱癌细胞中相关铁代谢,还促发自身细胞毒性,使癌细胞死亡[15-17]。除此之外,在细胞中被铁激活的青蒿素类化合物会释放高烷基化自由基和活性氧自由基,进而促进凋亡、抑制生长、抑制血管生成、抑制癌细胞侵袭、迁移、转移和DNA损伤,激发相关细胞凋亡通路(线粒体凋亡通路、内质网凋亡通路)等一系列级联反应。在癌细胞中高表达的转铁蛋白和低表达的超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等抗氧化酶,使青蒿素类化合物具有良好选择性[18-20]。综上所述,对青蒿素进行有效的结构修饰具有重要意义。
本文以青蒿素化学结构为基础,设计并合成了新青蒿素衍生物D-21,并通过体外细胞活性实验和一系列荧光染色实验来证明新青蒿素衍生物D-21 的抗癌活性。
1 实验前准备
1.1 主要试剂和仪器
试剂:DMEM,RPMI-1640,IMDM培养基,胰酶消化液,Hyclone;胎牛血清(FBS),Natocor;四甲基噻唑蓝(MTT),中国碧云天生物技术公司;Hoechst 33258,Annexin V-FITC ,PI,线粒体膜电位检测试剂盒(JC-1),中国碧云天生物技术公司;阿霉素(DOX),中国碧云天生物技术公司;苯丁酸氮芥,安耐吉化学公司;十二烷基硫酸钠(SDS)、氯化钠(NaCl)、氯化钾(KCl)、磷酸二氢钾(KH2PO4)、十二水磷酸氢二钠(Na2HPO4·12H2O)、浓盐酸,成都市科隆化学品有限公司。
仪器:XD20-RFL倒置荧光显微镜,宁波舜宇仪器有限公司;5404型低速冷冻离心机,上海安亭科学仪器厂;SH-1000 Lab型全波长酶标仪,Corona Electric;KG-SX-700型高温蒸汽灭菌锅;KAGOSHIMA SEISAKUSYO INC;SW-CJ-1D型超净工作台,上海力辰邦西仪器科技有限公司。
1.2 试剂的制备
DMEM完全培养基的配制:取20 mL FBS(胎牛血清)和2 mL青霉素链霉素溶液加入到DMEM基础培养基至最终培养基体积为200 mL,使完全培养基中FBS约为10%,PS约为1%,并于4 ℃ 冰箱保存备用。
DMEM维持培养基的配制:取5 mL FBS(胎牛血清)和2 mL青霉素链霉素溶液加入到DMEM基础培养基至最终培养基体积为200 mL,使完全培养基中FBS约为2.5%,PS约为1.0%,并于4 ℃ 冰箱保存备用。
RPMI-1640和IMDM完全培养基和维持培养基的配制方法同上。
MTT溶液的配制:称取500 mg的MTT粉末,用100 mL的PBS(磷酸盐缓冲溶液)溶解后,0.22 μm无菌滤膜过滤,EP管分装并置于-20 ℃ 冰箱中避光保存备用。
三联裂解液的配制:称取SDS (十二烷基硫酸钠)10 g,异丁醇5 mL,10 mol/L HCl 0.1 mL用双蒸水溶解并配成100 mL 溶液,用0.22 μm的滤膜过滤后,灭菌常温保存。
磷酸盐缓冲液(PBS)的配制:称取1.600 g NaCl,0.040 g KCl,0.694 g Na2HPO4·12H2O,0.040 g K2HPO4溶解于200 mL超纯水中,调节pH值为7.2~7.4,灭菌常温保存。
1.3 细胞株
本文中用于研究的人正常肝细胞系L02、人神经母细胞瘤细胞SH-SY5Y、胶质瘤细胞系U118-MG、人肺癌细胞系A549、人结肠癌细胞系HCT-116、人急性淋巴细胞白血病T淋巴细胞系CCRF-CEM、人慢性髓原白血病细胞系K562和人早幼粒细胞白血病细胞HL-60均购自上海揽宝(Shanghai Labpal)。
1.4 新青蒿素衍生物D-21结构式
新青蒿素衍生物D-21由西南科技大学生命科学与工程学院药物合成实验室设计合成,并经氢谱、碳谱、质谱确定结构式。
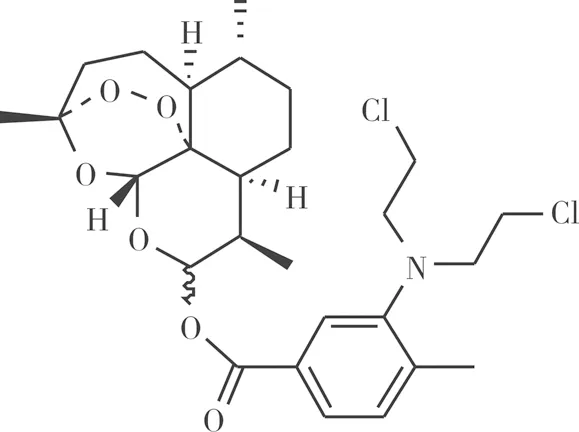
m.p.: 60.1~61.7 ℃。1H NMR (600 MHz, CDCl3) δ 7.97 (s, 1H), 7.92 (d,J=8.3 Hz, 1H), 7.16 (d,J=8.3 Hz, 1H), 6.00 (d,J=9.8 Hz, 1H), 5.52 (s, 1H), 3.56 ~3.46 (m, 8H), 2.74 (s, 1H), 2.40 (d,J=17.8 Hz, 1H), 2.35 (s, 3H), 2.05 (d,J=14.4 Hz, 1H), 1.91 (d,J=13.7 Hz, 1H), 1.83 (s, 1H), 1.75 (d,J=16.1 Hz, 1H), 1.68 (d,J=13.7 Hz, 1H), 1.57~ 1.45 (m, 2H), 1.43 (s, 3H), 1.35 (d,J=36.8 Hz, 2H), 1.10~1.02 (m, 1H), 0.98 (d,J=6.1 Hz, 3H), 0.91 (d,J=7.1 Hz, 3H)。13C NMR (126 MHz, CDCl3) δ 165.01, 151.95, 134.37, 133.71,128.75, 125.15, 122.43, 104.41, 92.40,91.60,80.22,77.29,77.04,76.78, 55.18, 51.70,45.39,41.43,37.31, 36.29, 34.17, 32.07, 25.97,24.62,22.10,20.25,18.50,12.25。HRMS (ESI) m/z calcd. for [C27H37Cl2NO6H+]: 542.199 8, Found, 542.171 6。
2 实验方法
2.1 细胞培养
HCT-116,A549,SHSY-5Y,U118-MG细胞系所用培养液为DMEM完全培养基,CCRF-CEM,K562,L02细胞系所用培养基为RPMI-1640完全培养基,HL-60细胞系所用培养液为IMDM完全培养基。上述细胞均在条件为37 ℃,5% CO2的饱和湿度的细胞培养箱中培养。
2.2 MTT法测D-21抗肿瘤活性
2.2.1 贴壁细胞
(1)接种细胞:待细胞处于对数生长期时,用胰酶消化细胞,并用完全培养基将消化下来的细胞制成适当细胞数量的细胞悬液,将细胞接种到96孔板中,每孔100 μL。放入培养箱中培养。
(2)药物的配制和细胞给药:培养24 h后,用DMSO溶解待测化合物,配成初始药物浓度为10 μmol/L,并用维持培养基配制最终药物浓度为0.04,0.40,2.00,10.00,20.00,40.00 μmol/L 共6组,并设置空白对照组。轻轻吸弃培养板中旧的培养液,每孔中加入100 μL各浓度的药物(每个浓度设3个复孔),然后放入细胞培养箱中培养。
(3)检测:细胞培养72 h后,轻轻吸弃培养板中旧的培养液,然后每孔加入100 μL MTT(0.5 mg/mL)溶液,培养箱中孵育4 h,吸弃孔内溶液,再向各孔加入100 μL DMSO溶解,并用酶标仪检测波长为490 nm 的吸光值。按公式(1)计算待测化合物对肿瘤细胞的生长抑制率,并通过SPSS软件计算其IC50。
抑制率=(1-实验组平均OD值/对照组
平均OD值)×100%
(1)
2.2.2 悬浮细胞
(1)接种细胞与细胞给药:待细胞处于对数生长期时,收集细胞,用维持培养基混悬细胞并制成适当浓度的初始细胞悬液,然后用此细胞悬液配制成含不同药物浓度的最终细胞悬液,最后接种于96孔板中,每孔90 μL,每个浓度设3个复孔,然后放入细胞培养箱中培养。
(2)检测:细胞培养72 h后,每孔加入20 μL浓度5 mg/mL的MTT溶液,培养箱中孵育4 h,然后每孔加入100 μL三联裂解液,培养箱中孵育10 h,并用酶标仪检测波长为570 nm的吸光值。按前述方法计算其IC50。
2.3 D-21对肿瘤细胞形态的影响观测
取对数生长期的CCRF-CEM细胞接种于24孔板中,用维持培养基制成适当浓度的细胞悬液,用细胞悬液稀释药物,使其最终药物浓度为0.000,0.625,1.250,5.000,10.000,20.000 μmol/L,然后将含不同化合物浓度的细胞悬液接种到24孔板中,每孔1 mL,放入培养箱中培养24 h,然后在荧光显微镜下观察细胞形态,并用ImageView软件拍照保存。
2.4 D-21不同浓度和不同作用时间对肿瘤细胞的抑制试验
收集处于对数生长期的CCRF-CEM细胞,用维持培养基制成适当浓度的细胞悬液,用细胞悬液稀释药物,使其最终药物浓度为0.00,0.05,0.10,0.50,2.50,5.00,10.00,20.00,40.00,60.00 μmol/L,然后将此不同浓度的细胞悬液接种到96孔板中,每孔100 μL,每个浓度设3个复孔,放入孵箱中分别培养24,48,72 h,每组时间重复3次;用MTT法检测波长在570 nm的吸光值,算出IC50值后,用软件GraphPad Prism 8处理数值并绘制CCRF-CEM细胞经新青蒿素衍生物D-21不同浓度和不同作用时间处理的抑制活性曲线图。
2.5 Hoechst 33258染色
2.5.1 药物配制:用DMSO溶解待测化合物,配成初始药物浓度为10 mmol/L,-20 ℃ 保存。
2.5.2 细胞接种及给药:收集处于对数生长期的细胞,用维持培养基制成适当浓度的细胞悬液,用细胞悬液稀释药物,使其最终药物浓度为0.000,0.625,1.250,5.000,10.000,20.000 μmol/L,然后将含不同化合物浓度的细胞悬液接种到24孔板中,每孔1 mL,放入孵箱中培养24 h。
2.5.3 染色:用EP管收集药物作用后的细胞(1 000 r/min,5 min),将Hoechst 33258储备液用PBS稀释成10 μg/mL,PBS洗细胞两次后,每管加入稀释后的染色液200 μL,室温避光孵育20 min后,离心除去染色液,用PBS小心清洗细胞2次;将染色后的细胞重新接种于24孔板中,并在荧光显微镜下观察拍照;整个过程尽量避光操作。
2.6 Annexin V-FITC and PI 染色
2.6.1 药物配制:方法同2.5.1节
2.6.2 细胞接种及给药:收集处于对数生长期的细胞,用维持培养基制成适当浓度的细胞悬液,用细胞悬液稀释药物,使其最终药物浓度为1.250,5.000,10.000,20.000 μmol/L,然后将含不同化合物浓度的细胞悬液接种到24孔板中,每孔1 mL,放入孵箱中培养24 h。
2.6.3 染色:用EP管收集药物作用后的细胞(1 000 r/min,5 min),PBS洗涤细胞,加入195 μL染色结合液重悬细胞后,再依次分别加入5 μL Annexin V-FITC和10 μL PI染色液,轻轻混匀,室温避光20 min(期间可重悬细胞,以便细胞和染色液充分作用),随后将细胞接种于24孔板中静置于冰浴片刻后,在荧光显微镜下观察拍照。整个过程尽量避光操作。
2.7 线粒体膜电位(JC-1)染色
2.7.1 药物配制:方法同2.5.1节
2.7.2 细胞接种及给药:收集处于对数生长期的细胞,用维持培养基制成适当浓度的细胞悬液,用细胞悬液稀释药物,使其最终药物浓度为0.000,1.250,5.000,10.000,20.000 μmol/L,然后将含不同化合物浓度的细胞悬液接种到24孔板中,每孔1 mL,放入孵箱中培养24 h。
2.7.3 染色:用EP管收集药物作用后的细胞(1 000 r/min,5 min),PBS洗涤细胞,加入1 mL细胞培养液和1 mL染色工作液,充分混匀后在培养箱中孵育20 min;孵育结束后,离心除去上清液(2 000 r/min ,4 ℃,4 min),并用JC-1染色缓冲液(1X)洗涤细胞2次;将JC-1染色缓冲液(1X)重悬的细胞接种于24孔板中,并在荧光显微镜下观察拍照。整个过程尽量避光操作。
3 实验结果与讨论
3.1 化合物对8种肿瘤细胞系的抗肿瘤活性
本实验采用MTT法测定了化合物对CCRF-CEM,SH-SY5Y,U118-MG,A549,HCT-116细胞系的抗肿瘤活性,用正常肝细胞L02来测定化合物的毒性。以双氢青蒿素(DHA)、阿霉素(DOX)、苯丁酸氮芥(DZ)为阳性对照,如表1。通过实验数据可以看出,本实验室设计合成的新青蒿素衍生物D-21 对癌细胞普遍具有较好活性,特别是对白血病细胞系CCRF-CEM的增长抑制作用显著,其 IC50值 0.602±0.252 μmol/L,达纳摩尔级,这对潜在的抗肿瘤药物的设计和筛选提供了实验依据和思路。
因为很多研究已经表明含氮芥类的衍生物对结肠癌细胞系特别是白血病细胞系具有显著的抗肿瘤活性[21-22],为了进一步验证本课题组合成的青蒿素衍生物是否对其他白血病细胞有抗增殖作用,我们又测定了新青蒿素衍生物D-21对人慢性髓原白血病细胞系K562和人早幼粒细胞白血病细胞HL-60 这两株细胞系的抗细胞增殖作用。
从表1的总体数据可以得出,新青蒿素衍生物D-21 对所选的肿瘤细胞系均有较好抗增殖作用,特别是对白血病细胞株具有更强的细胞活性,且对急性白血病细胞系的抗增殖作用好于慢性白血病细胞系。因此,我们决定进一步研究新青蒿素衍生物D-21对CCRF-CEM细胞的初步抗肿瘤机制。

表1 青蒿素衍生物对8种细胞株的抑制活性(x±SD,n=3)Table 1 Inhibitory activities of new artemisinin derivative against eight cancer cell lines(x±SD,n=3)
3.2 D-21不同浓度和不同作用时间对肿瘤细胞生长的抑制作用
如图1所示,新青蒿素衍生物D-21对CCRF-CEM细胞的生长有明显的抑制作用,且呈浓度和时间依赖性。当药物(10 μmol/L)作用24 h后,细胞抑制率达50%以上,表明抑制效果显著。

图1 新青蒿素衍生物D-21不同浓度和不同作用时间对CCRF-CEM细胞的增殖抑制率曲线Fig.1 Proliferation inhibition rate curve of new artemisinin derivative D-21 on CCRF-CEM cells at different concentrations and time
3.3 D-21对肿瘤细胞形态的影响
一般来说,细胞形态的骤变、空泡的出现是肿瘤细胞早期凋亡的直观表象,可以通过对肿瘤细胞外观的观察来初步判断化合物对细胞的作用情况。如图2所示,CCRF-CEM细胞经新青蒿素衍生物D-21处理后发生明显的形态学变化。随着新青蒿素衍生物D-21浓度的增加,细胞开始皱缩,细胞膜完整性受损,这种变化说明细胞骨架已崩解,细胞逐渐死亡,尤其是当新青蒿素衍生物D-21浓度达到 1.25 μmol/L时,细胞开始出现明显的形态学变化,表明新青蒿素衍生物D-21细胞毒性作用显著。

图2 新青蒿素衍生物D-21作用后的CCRF-CEM细胞形态Fig.2 Morphology of CCRF-CEM cells after treated with a new artemisinin derivative D-21
3.4 Hoechst 33258染色结果分析
为了确定新青蒿素衍生物D-21诱导的抗增殖活性是否与细胞凋亡有关,进行了Hoechst 33258染色实验。Hoechst 33258染色可初步评价细胞凋亡,经染料孵育后可直接观察到细胞的荧光图像。根据染色机理,正常细胞呈弱蓝色荧光,凋亡细胞因凋亡导致染色质固缩而呈强蓝色荧光。如图3所示,新青蒿素衍生物D-21的加入使细胞比空白对照组表现出更亮的蓝色荧光,并且呈现强荧光的细胞量明显随着药物浓度的增加而增加。当新青蒿素衍生物D-21浓度在0.625 μmol/L时,孔板内就出现了形状不同的凋亡小体,细胞质浓缩,说明新青蒿素衍生物D-21以浓度依赖的方式诱导细胞凋亡。

图3 Hoechst 33258对新青蒿素衍生物D-21作用后的CCRF-CEM细胞染色图Fig.3 Hoechst 33258 staining picture of CCRF-CEM cells after treated with a new artemisinin derivative D-21
3.5 Annexin V-FITC and PI 染色结果分析
为了进一步评价新青蒿素衍生物D-21的细胞活性是否与细胞凋亡有关,进行了Annexin V-FITC和PI染色实验。Annexin V是一种膜黏蛋白,它能选择性地与细胞膜中的磷脂酰丝氨酸结合。磷脂酰丝氨酸主要分布在细胞膜内部。当细胞发生凋亡时,会出现磷脂酰丝氨酸翻出到细胞膜表面的现象,这是细胞凋亡的重要特征。Annexin V-FITC是一种用绿色荧光探针FITC标记的Annexin V,根据Annexin V-FITC与磷脂酰丝氨酸的结合,就能知道磷脂酰丝氨酸在细胞膜表面的分布情况,从而检测出细胞的凋亡状态。PI可对凋亡后期坏死细胞或细胞膜失去完整性的细胞进行染色,然后呈现红色荧光。本实验通过Annexin V-FITC和PI双重染色,可以更全面地验证该化合物是否诱导细胞凋亡。如图4所示,随着化合物浓度的增加,绿色和红色荧光明显增强。表明新青蒿素衍生物D-21可明显诱导细胞凋亡和坏死。
3.6 线粒体膜电位(JC-1)染色结果分析
细胞凋亡的机制之一是线粒体膜通透性的改变,随后一些促凋亡因子释放到细胞质内,引发一系列级联反应然后促进细胞凋亡,其中凋亡现象之一就是线粒体膜电位的降低。在此,用荧光探针JC-1研究了新青蒿素衍生物D-21对线粒体膜电位的影响。JC-1是广泛用于检测线粒体膜电位的理想荧光探针,可用于早期细胞凋亡的检测。当线粒体膜电位较高时,JC-1聚集在线粒体基质中形成一种聚合体(J-聚集体)并产生红色荧光;当线粒体膜电位较低时,JC-1不能进入线粒体基质,JC-1以单体形式产生绿色荧光。因此,可以通过荧光颜色检测线粒体膜电位的变化。如图5所示,与对照组相比,新青蒿素衍生物D-21处理的CCRF-CEM细胞发散的绿色荧光强度明显增强,且呈剂量依赖性。实验结果表明,新青蒿素衍生物D-21可以通过改变线粒体膜的去极化诱导细胞凋亡。

图5 新青蒿素衍生物D-21作用后的CCRF-CEM细胞线粒体膜电位(JC-1)染色图Fig.5 JC-1 staining picture of CCRF-CEM cells after treated with a new artemisinin derivative D-21
4 结论与展望
新青蒿素衍生物D-21对结肠癌细胞HCT-116、肺癌细胞A549、人慢性髓原白血病细胞K562、人早幼粒细胞白血病细胞HL-6、人急性白血病细胞CCRF-CEM有显著的抗增殖活性,使D-21跃升为抗癌药成为可能。抗癌活性的初步探讨也证明了随着D-21浓度的增加,受线粒体膜电位相关凋亡通路影响,肿瘤细胞快速凋亡。
虽然人们对青蒿素及其衍生物已经进行了大量的研究,但是像新青蒿素衍生物D-21这种具有显著抗癌活性的化合物却未见报道。通过本文实验可以充分证明新青蒿素衍生物D-21有非常大的潜在研究意义,可进一步研究新的药理机理,为今后抗癌药物的临床研究提供实验基础。
