PDTC调节线粒体功能障碍与Klotho蛋白表达对大鼠脓毒症合并急性肾损伤的影响*
2021-12-20沈文婷秦建品
沈文婷,陈 明,许 诣,秦建品
(湖北文理学院附属医院 襄阳市中心医院儿科,襄阳 441021)
脓毒症是重症监护病房中发病率和死亡率较高的常见病状,由感染引起全身炎症反应和组织器官功能障碍,进而危及患者生命[1]。据统计,由脓毒症引起的急性肾损伤(acute kidney injury,AKI)的发生率高达50%,并与不良的临床结果密切相关。AKI不仅延长了患者的住院时间,而且还与其死亡率增加有关[2]。此外,AKI患者在后期患上慢性肾脏病和终末期肾脏疾病的概率较大[3]。目前,脓毒症引起AKI 的病理生理机制尚未完全明确,寻找脓毒症诱发AKI的关键致病因子与相关机制,能够为有效预防和诊治该疾病提供新思路。
吡咯烷二硫代氨基甲酸酯(pyrroiidine dithiocarbamate,PDTC)是一种稳定的衍生自二硫代氨基甲酸酯的硫醇化合物,可作为抗氧化剂和自由基清除剂发挥多种生物效应。此外,PDTC 还参与调控炎症反应[4]。已有研究表明,PDTC对大鼠糖尿病肾脏损伤与大鼠急性肾损伤均具有一定的保护作用[5-6],而关于其在脓毒症合并AKI中的作用及机制研究较少,本研究通过构建脓毒症AKI 大鼠模型,以探究PDTC 对脓毒症合并AKI 大鼠的作用情况,及其对线粒体功能与抗衰老蛋白Klotho 表达的影响。
1 材料与方法
1.1 实验动物
清洁级健康SD 大鼠,雄性,体质量180~200 g。饲养于室温(23±2)℃、湿度40%~60%的小动物饲养箱内,以12 h光照/黑暗交替循环,期间自由进食、饮水。试验前将大鼠在动物实验中心适应性饲养1周。
1.2 主要试剂与材料
PDTC购自美国Sigma公司,ELISA试剂盒和丙二醛(MDA)、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)检测试剂盒购自南京建成生物技术研究所,Masson染色试剂盒购自北京博奥森生物技术有限公司,苏木精—伊红(HE)染色试剂盒、TUNEL细胞凋亡检测试剂盒和免疫组织化学染色试剂盒购自北京索莱宝科技有限公司,免疫荧光染色试剂盒、BCA 蛋白检测试剂盒和增强型ECL 化学发光液购自上海碧云天生物技术研究所,TRIzol试剂、cDNA合成试剂盒与SYBR Green qPCR Master Mix 试剂盒购自日本Takara公司,抗体Klotho、细胞色素C氧化酶Ⅳ(COXⅣ)、自噬标记轻链3(LC3)、肾皮质匀浆细胞色素-C(Cyto-C)、抗增殖蛋白(Prohibitin)购自英国Abcam 公司,抗体β-actin、辣根过氧化物酶标记的山羊抗兔IgG 和生物素标记的山羊抗兔IgG购自美国Santa Cruz公司。其他试剂均为国产市售分析纯。
1.3 方法
1.3.1 动物分组与处理 60只SD大鼠按随机数字表法分为对照组、模型组、PDTC 组,每组20 只。模型组和PDTC组大鼠通过盲肠结扎穿刺(CLP)制备脓毒症合并AKI 模型,造模前大鼠12 h 禁食,6 h 禁水,腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉,后固定,剔除腹部体毛,消毒后沿腹部正中间白线切开皮肤2 cm左右切口,暴露腹腔脏器,分离盲肠,在距盲端1 cm 处进行结扎,结扎后逐层缝合切口,并立即在大鼠股部皮下注射生理盐水。造模成功标准:在CLP 模型构建后6 h 内未出现死亡,并出现包括腹泻、竖毛、萎靡、活动力减弱等脓毒症的标准症状。对照组大鼠除了不进行盲肠结扎穿孔和不留置导管外,其他操作均与上述过程相同。PDTC 组大鼠在造模后1 h,以50 mg/kg 剂量通过腹腔注射PDTC 试剂液,模型组及对照组注射同等剂量生理盐水,每日1次,持续1周[5]。
1.3.2 ELISA法检测血清肌酐(SCr)、尿素氮(BUN)和24 h尿蛋白(24 h UP)水平 治疗1周后,将大鼠麻醉后眼球取血,室温静置2 h,置于4 ℃低温离心机以3 000 r/min离心15 min,取上清液,应用Beckman CX-7 全自动生化分析仪测定血清SCr、BUN 和24 h UP 的水平,具体步骤按照试剂盒说明书进行。
1.3.3 肾组织氧化应激指标检测 采血结束后处死大鼠,解剖取其右侧肾组织,无菌环境下剪碎、研磨匀浆,加入缓冲液置于冰上裂解2 h,4 ℃低温离心机以12 000 r/min 离心10 min,提取收集上清液备用,硫代巴比妥酸法检测肾组织MDA 水平,微板法检测肾组织SOD水平,光谱光度测量工具检测肾组织T-AOC 水平,具体操作过程参照试剂盒说明书进行。
1.3.4 HE 染色观察肾组织病理形态学变化 解剖取大鼠左侧肾组织,置入4%多聚甲醛浸泡固定,固定24 h,常规石蜡包埋,切片机切成5 μm 的组织薄片,切片常规脱蜡至水,加入苏木精染色5 min,流水冲洗,伊红染色3 min,流水冲洗,梯度乙醇脱水,晾干,中性树胶封片,通过光学显微镜观察肾组织病理形态变化并拍照。
1.3.5 Masson 染色观察肾组织胶原沉积 取制备好的肾组织石蜡切片,常规脱蜡至水,加入weigert铁苏木精液染色10 min,1%盐酸乙醇分化10 s,流水冲洗干净,依次加入Masson染液染色3 min,丽春红酸性品红液染色5 min,l%磷钼酸水溶液分化3 min,苯胺蓝染液染色5 min,1%冰醋酸水溶液浸泡并洗涤切片,脱水与透明后,中性树胶封片,通过光学显微镜观察肾组织胶原沉积情况并拍照。
1.3.6 TUNEL 染色检测肾组织细胞凋亡 肾组织石蜡切片常规脱蜡至水,加入20 μg/mL蛋白酶K室温孵育15 min,PBS 冲洗干净,滴加50 μL TUNEL试剂液,37 ℃孵育1 h,加入过氧化物酶转化剂,37 ℃孵育30 min,DAB试剂液显色,苏木精复染,脱水透明,中性树胶封片。通过光学显微镜观察,凋亡细胞核呈棕褐色,随机选择6个视野统计TUNEL阳性细胞数与总细胞数,计算TUNEL阳性细胞率。
1.3.7 免疫组织化学染色检测肾组织Klotho 蛋白表达 肾组织石蜡切片脱蜡水化,置于柠檬酸盐缓冲液(温度95 ℃)煮沸15 min,3%H2O2去除内源性过氧化物酶,5%山羊血清室温封闭2 h,将切片分别与兔抗Klotho(1∶500)在4 ℃冰箱孵育过夜。次日,PBS 冲洗切片,加入辣根过氧化物酶标记的山羊抗兔IgG(1∶1 000)室温孵育1 h,PBS 冲洗,DAB 显色,苏木精复染,中性树胶封片,在光学显微镜下观察组织染色情况,胞质染成黄色至棕色即为阳性,随机选择6 个视野,Image-Pro Plus 6.0 软件统计阳性表达面积。
1.3.8 实时荧光定量PCR 法(RT-qPCR)检测肾组织Klotho mRNA 表达 TRIzol 法提取右侧肾组织总RNA,Nanodrop 测定RNA 纯度、浓度,按照cDNA 合成试剂盒说明逆转录获得cDNA。根据SYBR Green qPCR Master Mix 试剂盒说明进行qPCR 检测基因mRNA 表达,以GAPDH 作为内参基因。扩增程序:95 ℃预变性5 min(1个循环);95 ℃变性30 s(1个循环),55 ℃退火15 s,72 ℃延伸30 s(42 个循环)。引物序列如下:Klotho 上游引物:5'-GGGTCACTGGGTCAATCT-3',下游:5'-GCAAAGTAGCCACAAAGG-3';GAPDH 上游引物:5'-ACAGCAACAGGTGGTGGAC-3',下 游:5'-GCCGATCCACACGGAGTAC-3'。采用2-ΔΔCt法计算基因mRNA相对表达水平。
1.3.9 免疫荧光染色检测肾组织LC3 与COX Ⅳ表达 将左侧肾组织在OCT 化合物中冷冻并切成8 μm 的纵切片。将切片解冻,4%甲醛溶液固定20 min,0.2 %Triton X-100 透化处理切片20 min,10%山羊血清室温封闭30 min,加入兔抗LC3(1∶200)与COX Ⅳ(1∶50)抗体在4 ℃冰箱共同孵育过夜。次日,PBS 冲洗切片,加入TRITC 标记的山羊抗兔IgG(1∶200),室温孵育2 h,PBS 冲洗,中性树胶封片,使用荧光显微镜观察荧光表达并拍照。
1.3.10 Western blotting 法检测肾组织Cyto-C、Prohibitin 蛋白表达 将右侧肾组织皮质剪碎匀浆,加入RIPA 裂解缓冲液裂解提取总蛋白,BCA 法测定浓度。以50 µg 蛋白加样,10% SDS-PAGE 分离蛋白质,电转到聚偏二氟乙烯膜上,5%脱脂奶粉中封闭2 h,滴加兔抗Cyto-C(1∶1 000)、Prohibitin(1∶1 000),4 ℃冰箱孵育过夜,以β-actin 作为肾皮质胞浆内参蛋白,COX Ⅳ作为肾皮质线粒体内参蛋白。次日,TBST清洗3次,加入辣根过氧化物酶标记山羊抗兔IgG(1∶2 000)室温孵育1 h,TBST清洗3次,增强型ECL 液显色曝光,凝胶成像系统拍摄图像,Image-Pro Plus 6.0软件分析各蛋白条带灰度值。
1.4 统计学方法
采用SPSS 23.0 软件进行数据统计分析,计量资料以均数±标准差()表示,多组间数据比较用单因素方差分析,组间两两比较采用LSD-t法,以P<0.05为差异具有统计学意义。
2 结果
2.1 PDTC 对脓毒症合并AKI 大鼠生化指标的影响
与对照组比较,模型组大鼠血清中SCr、BUN的含量和24 h UP 水平显著升高(P<0.05);与模型组相比,PDTC 组大鼠血清中SCr、BUN 含量和24 h UP水平显著下降(P<0.05),见表1。
表1 各组大鼠SCr、BUN和24 h UP比较
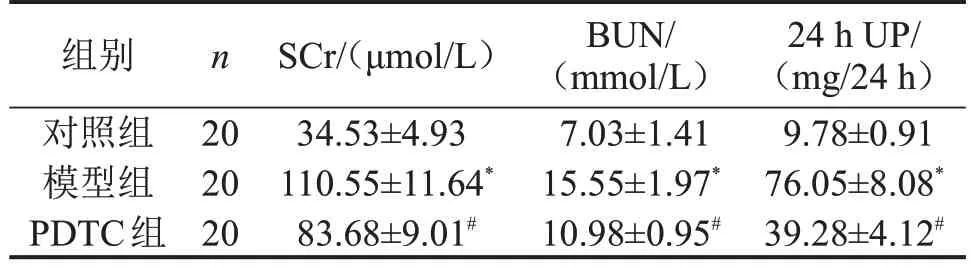
表1 各组大鼠SCr、BUN和24 h UP比较
与对照组比较,*P<0.05;与模型组比较,#P<0.05。
2.2 PDTC 对脓毒症合并AKI 大鼠肾组织氧化应激反应的影响
与对照组相比,模型组大鼠肾组织内SOD、TAOC 含量显著减少,MDA 含量显著增加(P<0.05);与模型组相比,PDTC组大鼠肾组织内SOD、T-AOC 含量均显著增加,而MDA 含量则显著减少(P<0.05),见图1。
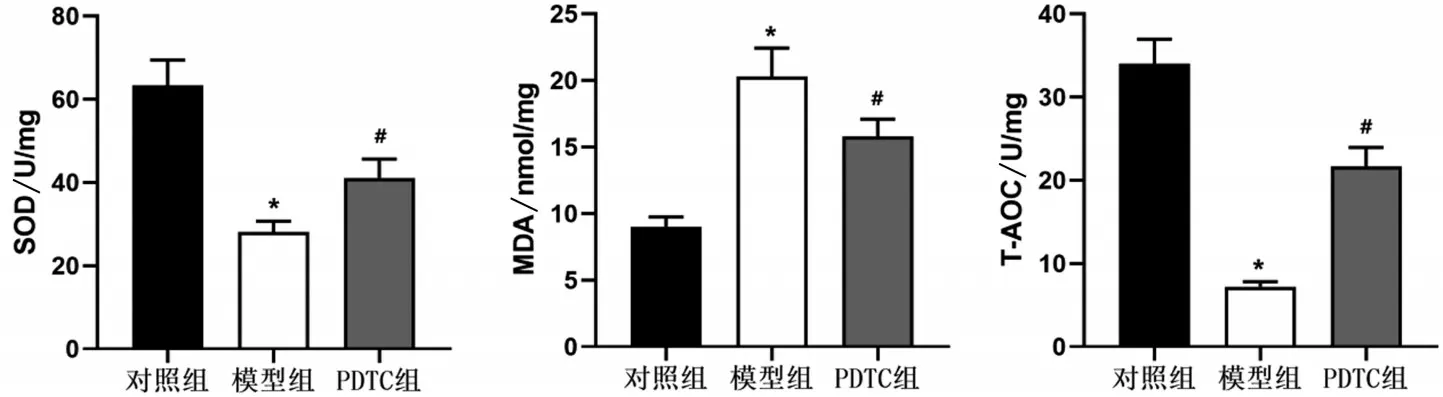
图1 各组大鼠肾组织SOD、MDA和T-AOC水平比较
2.3 PDTC 对脓毒症合并AKI 大鼠肾组织病理形态学改变的影响
HE 染色结果显示,对照组大鼠肾组织未见变化,肾小管结构正常,未见上皮细胞脱落,细胞外基质正常分布;与对照组相比,模型组大鼠肾组织内肾小管萎缩、坏死,上皮细胞脱落,并有空泡性病变,伴随大量炎性细胞浸润;与模型组比较,PDTC组大鼠肾小管坏死与萎缩现象明显减轻,管腔内脱落细胞减少,炎性细胞浸润减轻,见图2。Masson染色结果显示,对照组大鼠肾组织内蓝染胶原纤维较少;与对照组相比,模型组大鼠肾组织中蓝染胶原纤维面积明显增多,纤维束增粗,排列紊乱,呈现明显纤维化;与模型组相比,PDTC组大鼠肾组织中蓝染胶原纤维面积明显减少,纤维化程度有所减轻,见图3。
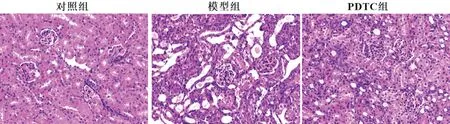
图2 HE染色检测大鼠肾组织病理形态学(×400)
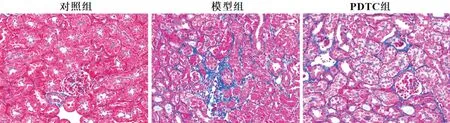
图3 Masson染色检测大鼠肾组织胶原沉积(×400)
2.4 PDTC 对脓毒症合并AKI 大鼠肾组织细胞凋亡的影响
TUNEL 染色结果显示,模型组大鼠肾组织内TUNEL 阳性细胞凋亡率为(26.56±2.03)%,较对照组(6.85±0.49)%显著升高(P<0.05);PDTC 组TUNEL 阳性细胞凋亡率(18.31±1.52)%显著低于模型组(P<0.05),见图4。
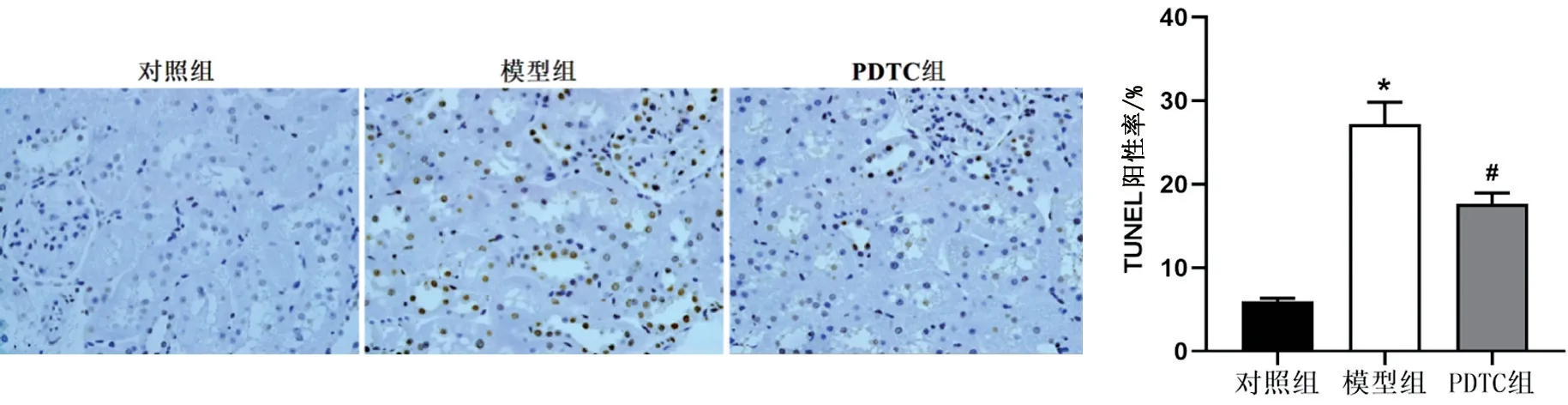
图4 TUNEL染色检测大鼠肾组织细胞凋亡(×400)
2.5 PDTC 对脓毒症合并AKI 大鼠肾组织Klotho蛋白与mRNA表达水平的影响
免疫组织化学染色结果显示,对照组大鼠肾组织内有明显的棕褐色染色,Klotho 阳性面积率为(37.13±3.28)%;模型组肾组织染色较浅较少,Klotho 阳性面积率为(8.92±0.73)%,较对照组显著降低(P<0.05);与模型组比较,PDTC 组肾组织染色加深,Klotho 阳性面积率为(24.77±2.06)%,显著高于对照组(P<0.05),见图5。模型组肾组织Klotho mRNA相对表达量为(0.73±0.03),较对照组(1.00±0.05)明显下调(P<0.05);而相较于模型组,PDTC 组肾组织Klotho mRNA 相对表达量(0.72±0.06)明显上调(P<0.05)。
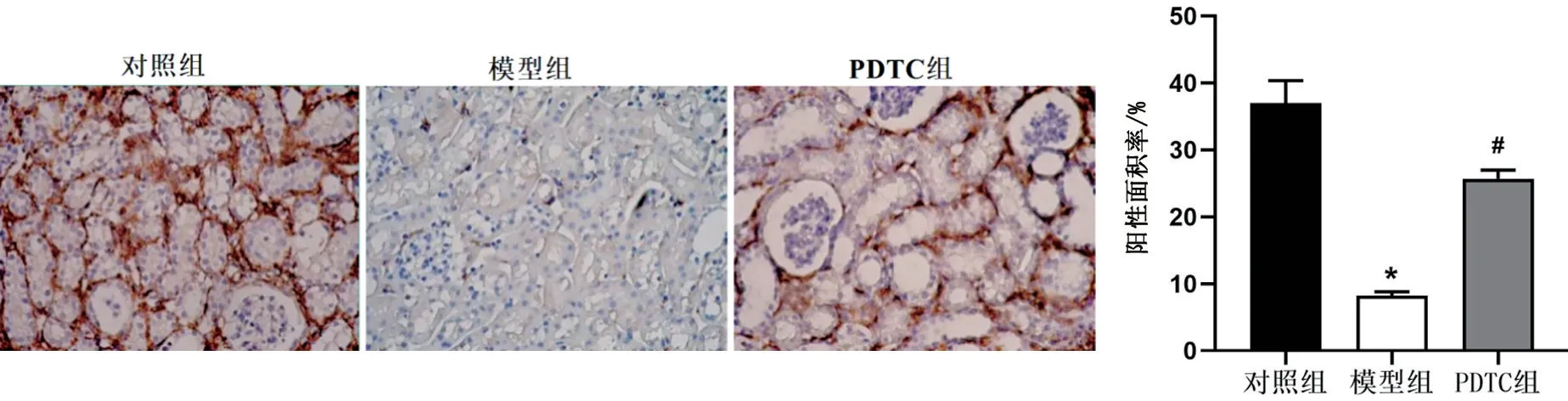
图5 免疫组织化学染色检测大鼠肾组织Klotho蛋白表达(×400)
2.6 PDTC 对脓毒症合并AKI 大鼠肾组织线粒体水平的影响
免疫荧光染色结果显示,相较于对照组,模型组大鼠的肾组织中绿色荧光增强,LC3 水平升高,COX Ⅳ和LC3 共定位也随之增加;而与模型组比较,PDTC组大鼠肾组织内绿色荧光减弱,LC3水平明显降低,COX Ⅳ和LC3共定位也发生减少,见图6。

图6 免疫荧光染色检测大鼠肾组织中LC3和COX Ⅳ表达(×400)
2.7 PDTC 对脓毒症合并AKI 大鼠肾组织线粒体Cyto-C、Prohibitin蛋白表达的影响
与对照组比较,模型组大鼠肾皮质胞浆Cyto-C、Prohibitin 蛋白表达显著升高(P<0.05),肾皮质线粒体Cyto-C、Prohibitin 蛋白表达显著降低(P<0.05);与模型组比较,PDTC组大鼠肾皮质胞浆Cyto-C、Prohibitin 蛋白表达则显著降低(P<0.05),同时,肾皮质线粒体Cyto-C、Prohibitin 蛋白表达显著升高(P<0.05),见图7。

图7 Western blotting检测大鼠肾组织Cyto-C、Prohibitin蛋白表达
3 讨论
脓毒症又称败血症,是由微生物或其他病原体入侵引起的强烈的全身性炎症反应,通过不可控的炎症反应对机体的多个器官造成急性功能损害,并最终发展为多器官功能障碍综合征[1]。肾脏是常受炎症反应攻击的靶器官之一,AKI 是脓毒症的主要并发症之一,可导致肾小管严重损伤,造成肾功能障碍,并对患者生命造成了极大的威胁[7]。然而,脓毒症发展的潜在机制仍不清楚。在本研究中,应用构建脓毒症合并AKI 大鼠模型,探讨PDTC 作用下对该疾病的影响,及其与线粒体功能障碍的关联和调控的分子靶点。
PDTC 的抗氧化作用与抑制核因子-κB(NFκB)活性密切相关,在多个促炎性细胞因子基因的转录中起着至关重要的作用。体外和体内研究均显示,PDTC 参与减弱炎症反应。例如,PDTC 通过阻断IL-6、IL-8 和GM-SCF 分泌并抑制NF-κB 活化来响应人内皮细胞的炎症介质[8]。在人肝上皮细胞中,PDTC 抑制细胞因子模拟可诱导型一氧化氮合酶(iNOS)的表达和一氧化氮(NO)合成,破坏肝细胞中STAT 激活来抑制IL-6 信号传导[9]。另外,PDTC可通过诱导血红素加氧酶-1(HO-1)的表达在大鼠肝损伤模型中发挥保护作用[10]。在本研究中,使用PDTC 治疗脓毒症合并AKI 大鼠后,通过检测发现相较于未经治疗的模型组大鼠,治疗后的大鼠血清中SCr、BUN 含量和24 UP 水平明显下降(P<0.05)。此外,还观察到大鼠肾小管坏死与萎缩现象得以改善,炎性细胞浸润减轻,纤维化程度减小。以上指标检测结果均说明,PDTC 可在大鼠脓毒症合并AKI 中起到保护作用。因此,鉴于PDTC 具有广泛生物学和病理学作用,在调节炎症信号通路中可将其作为针对多种炎症疾病的有效治疗方法来开展相关研究。
脓毒症可引起线粒体损伤和免疫功能紊乱,并且在炎症反应中NO等危险因素均可诱发线粒体功能障碍、氧化应激和细胞凋亡等现象[11]。线粒体作为机体的能量中心,参与真核生物的氧化代谢过程,是产生ROS 的主要场所。线粒体DNA 从受损细胞泄漏到循环系统中时,再加上细菌感染,可能导致系统性炎症反应综合征。当线粒体膜电位下降时,内外膜间的蛋白质释放至胞浆介导细胞凋亡,此外,功能失调的线粒体可通过选择性自噬进行降解,从而促进受损线粒体的周转[12]。Cyto-C 和Prohibitin均主要表达于线粒体内膜,Cyto-C可作为线粒体损伤的标志物,当线粒体发生损伤时,Cyto-C释放至胞浆触发细胞凋亡相关级联反应;Prohibitin可通过自身结构的疏水区与线粒体多肽链结合,防止降解的发生[13-14]。本研究结果显示,经过PDTC治疗脓毒症合并AKI大鼠后,肾组织内细胞凋亡明显减少,LC3 表达也减少,同时,大鼠肾皮质线粒体Cyto-C、Prohibitin 蛋白表达明显升高,而肾皮质胞浆Cyto-C、Prohibitin 蛋白表达则明显降低(P<0.05)。由此说明,PDTC 可改善脓毒症合并AKI 大鼠的线粒体损伤及功能障碍。
氧化应激条件下线粒体的结构和功能受损是生物能量和细胞氧利用受损的主要原因,是触发线粒体功能障碍的关键。线粒体不足或过多会导致线粒体呼吸过程中出现ROS缺乏或积累,最终导致线粒体稳态失控和生物能量代谢性疾病[15]。Klotho蛋白由肾小管分泌,在肾脏中呈现高表达,能够抑制发挥抗氧化作用,并且参与调控炎症反应、细胞凋亡、离子转运和器官纤维化等过程[16-17]。本研究表明,通过PDTC治疗脓毒症合并AKI大鼠后,抑制了大鼠肾组织内SOD、T-AOC 含量的减少和MDA含量的增加,并促进了Klotho 蛋白表达(P<0.05)。由此推测,PDTC 可抑制脓毒症合并AKI 大鼠肾组织内氧化应激反应,并激活Klotho的表达。
综上所述,本实验研究结果表明,PDTC可改善大鼠脓毒症合并AKI,其能够抑制氧化应激损伤,调节线粒体功能,并激活Klotho 表达。然而,脓毒症合并AKI 的机制错综复杂,PDTC 作用过程中是否涉及其他靶点与机制还有待进一步研究。
