α-生育酚通过抑制mTOR激活小鼠海马神经元细胞自噬
2021-12-18武霁舟王省
武霁舟,王省
(南京中医药大学基础医学院/转化系统生物学与神经科学研究中心/中医脑病学重点实验室,南京 210023)
自噬广泛存在于真核生物,与各种生理活动和病理变化密切相关[1]。自噬作为促生存机制[2-3],当细胞内环境稳态改变或机体受到刺激时,能够清除胞内损伤的细胞器,保护细胞免于凋亡和坏死,在维持能量代谢、内环境稳态等方面起着重要作用[4]。细胞自噬还可以引起II型程序性细胞死亡,以清除受损细胞[5],但过度激活可能导致多种疾病的发生[6]。
α-生育酚是维生素E的一种存在形式,具有很强的抗氧化能力[7-9]。越来越多的研究发现,抗氧化能力和自噬具有一定联系[10-12]。因此,本研究在此基础上,以HT22小鼠海马神经元细胞为研究对象,观察自噬现象,探索α-生育酚对细胞自噬的影响以及可能的分子机制。
1 材料与设备
1.1 细胞
HT22海马细胞由南京中医药大学药学院馈赠。
1.2 药物和试剂
1)α-生育酚(上海元叶生物科技有限公司,批号J01020RA14,BR,纯度50%);2)抗体LC3-II,p-AMPK,p-mTOR(Cell Signaling Technology公司,批号分别为12753s,2535s,2971s);3)p62(Sigma公司,货号P0067);4)RAPA裂解液(碧云天,P0013K);5)BSA(Biofroxx公司,货号4240GR100);6)PBS(HyClone,货号SH30256.01);7)Dulbecco’s Modified Eagle Medium(DMEM,Gibco公司,货号C11995500BT);8)MTT(BioFroxx公司,货号3580GR001);9)0.25%Trypsin-EDTA(Gibco,货号25200-056)。
1.3 仪器
1)垂直电泳槽(Bio-RAD,货号041BR11339);2)超微量生物检测仪(NanoDrop 2000,货号G402);3)自动化学发光图像分析系统(Tanon-5200,货号13T12NPFLI-1157);4)高速离心机(Thermo Fisher,货号75002455)。
2 方法
2.1 HT22细胞的培养及实验分组
HT22细胞接种于10%FBS-DMEM完全培养基,于恒温培养箱(37℃,5%CO2,95%空气,饱和湿度)进行培养,1~2 d全量换液,待细胞融合度达70%~80%进行传代。取对数生长期的HT22细胞,接种于6孔/96孔微量培养板,在完全培养基处理24 h后,随机分为4组:1)Control组:1%FBS-DMEM处理24 h;2)C.C组:15 μm compound C处理24 h;3)α-生育酚组:25 μm α-生育酚处理 24 h;4)C.C+ α-生育酚组:15 μm compound C 和 25 μm α-生育酚共同处理24 h。
2.2 免疫荧光法(AO)检测自噬溶酶体
将HT22细胞接种于6孔板,按照设定的分组处理后,细胞在由PBS配制的1 ug·mL-1AO溶液中室温孵育10 min,使用PBS洗涤细胞3次,在荧光显微镜下观察样品。
2.3 透射电镜(TEM)检测自噬体
细胞按设定的分组处理后,收集细胞置于2.5%戊二醛溶液固定、PBS洗涤、1%四氧化锇溶液固定、PBS洗涤、梯度乙醇脱水、非环氧树脂单体包埋。超薄切片60~80 nm后,用3%醋酸双氧铀和柠檬酸铅染色,透射电子显微镜观察自噬体。
2.4 Western blot法检测蛋白表达
将细胞接种于6孔板,按照设定的分组处理后,消化并收集细胞,经PBS洗涤后于冰上使用裂解液提取细胞总蛋白,测定并调整蛋白浓度,加热变性后于-20℃冰箱保存。每组取等量蛋白进行电泳分离,将蛋白转移至PDVF膜上后,于1%BSA封闭1 h,加入适当稀释的一抗,4℃摇床过夜,TBST缓冲溶液洗膜3次,每次10 min,再加入适当稀释的二抗,室温摇床结合1 h,TBST缓冲溶液洗膜三次后置于显影液中,显色、曝光。
2.5 统计学方法
数据均以平均值±标准误(mean± SEM)表示,使用GraphPad Prism 6.0软件进行统计分析,应用单向方差分析(ANOVA)和Bonferroni方法分析组差异,以P<0.05为差异有统计学意义。
3 结果
3.1 细胞免疫荧光标记
与对照组比较,C.C+α-生育酚组的橙色溶酶体数量明显增加(见图A)。

图A α-生育酚对橙色溶酶体的影响[图1-3(10X);图4-6(40X)]
3.2 透射电镜观察自噬体
按设定分组处理后,C.C预处理组自噬体数量显著降低(P<0.01),而α-生育酚增加了自噬体的数量(见图B、C)。
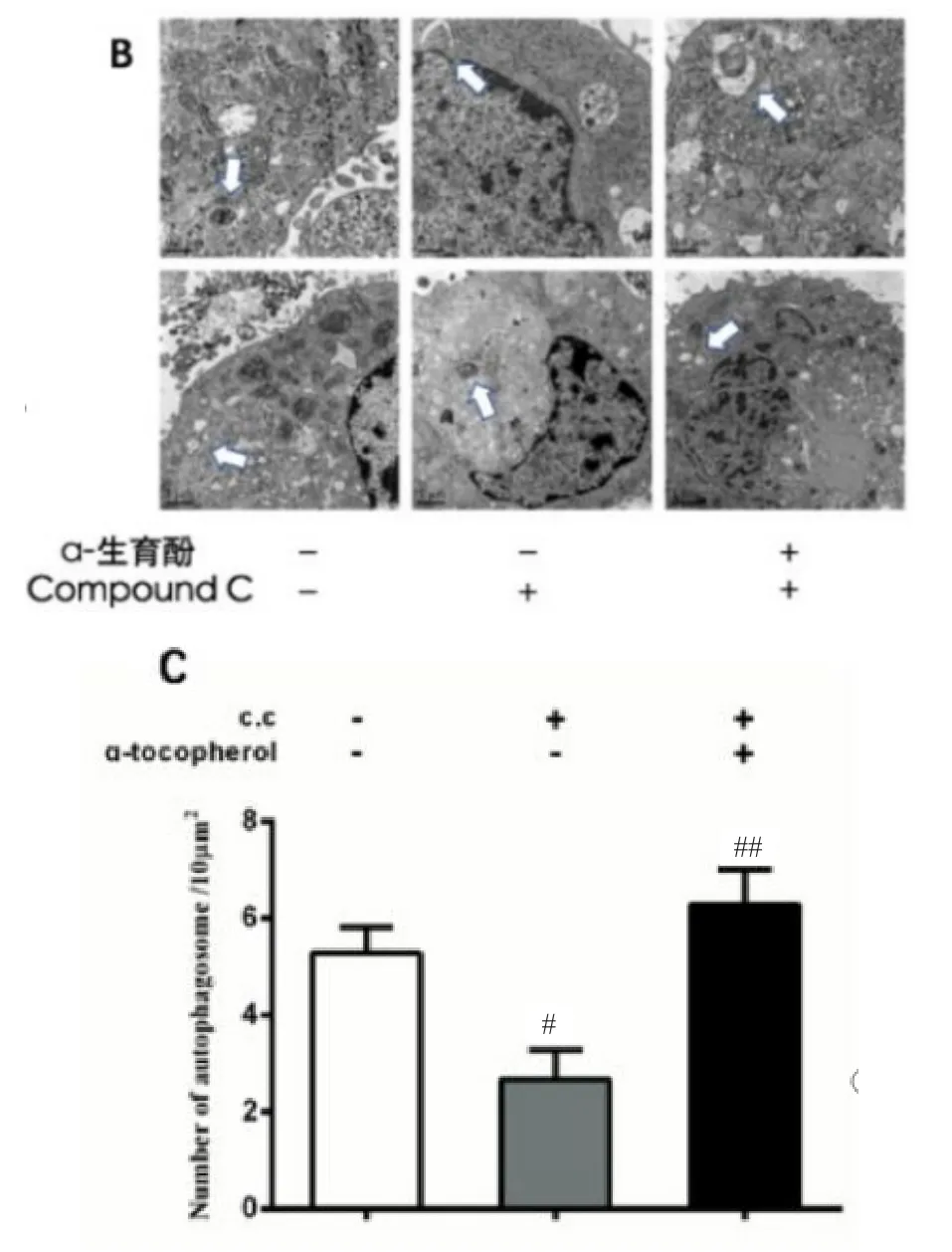
图B/C α-生育酚对自噬体数量的影响
3.3 Western Blot 检测结果
α-生育酚通过抑制HT22细胞中mTOR激酶的表达而诱导自噬(见图D)。与对照组相比,预处理α-生育酚能够显著降低由C.C诱导的LC3-Ⅱ的表达(a,P<0.01),上调了P62的表达(b,P<0.001)。α-生育酚能够激活胞内p-AMPK的表达,但不能逆转C.C对p-AMPK表达的抑制(c,相对于CTL组,P<0.01;相对于C.C组,P>0.05)。α-生育酚可以下调p-mTOR的表达(d,相对于C.C组,P<0.05;相对于CTL组,P<0.01)。C.C抑制ULK1的表达(e,P<0.05,相对于CTL组);α-生育酚能够逆转C.C对ULK1激酶的抑制作用,提高其表达水平(e,P<0.05)。
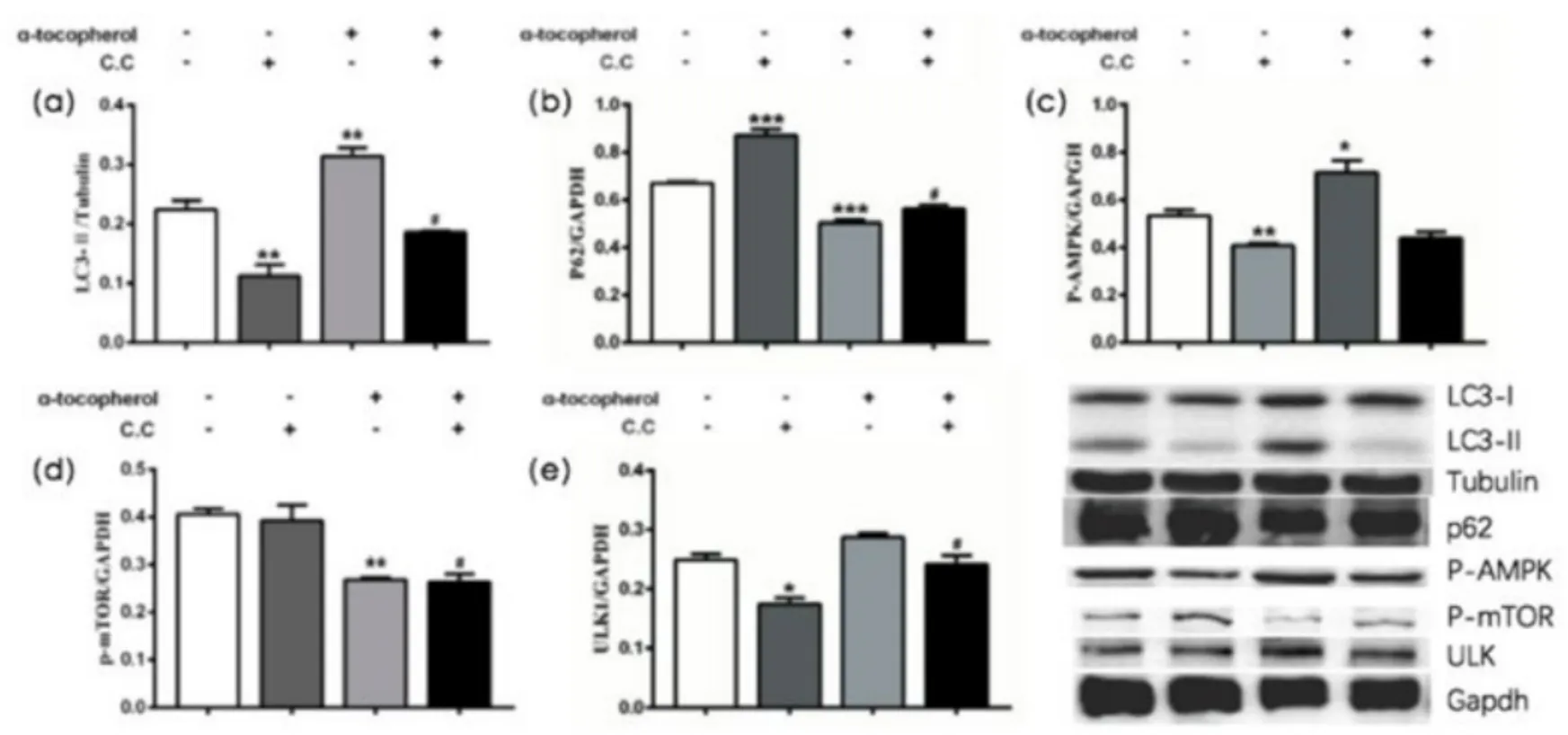
图D α-生育酚作用HT22细胞后相关蛋白表达的变化
4 讨论
LC3的表达水平与自噬相关[13],刺激自噬体的形成与抑制自噬体的降解均可导致LC3-Ⅱ表达水平升高。LC3-Ⅱ参与了自噬的全过程,能与新形成的膜相结合,直到自噬溶酶体的形成,其相对量与自噬体含量相关,其表达水平间接反应了自噬水平的高低[14],这种LC3亚型也是目前检测自噬体时最常用的分子标记之一。我们发现LC3-Ⅱ和LC3-I的总和在同一样品中不一定相同,考虑到LC3抗体对LC3-Ⅱ的亲和力可能高于LC3-Ⅰ,因此我们的研究只考虑了LC3-Ⅱ的水平。经α-生育酚干预后,HT22细胞自噬现象明显增强,表现为AO染色下橙色溶酶体数量明显增多,透射电镜下观察自噬体显著增加,自噬相关蛋白LC3-Ⅱ表达上调及p62水平降低。
mTOR是雷帕霉素的靶分子,是一种丝氨酸/苏氨酸激酶,可多种蛋白相互作用,主要形成两种不同的蛋白质复合物mTORC1和mTORC2[15],其中mTORC1参与了ULK1复合物的调控[16]。mTORC1下游有三种不同的途径,包括4EBP1,P70S6K1和S6激酶[17],其中4EBP1和P70S6K1是mTOR激酶的真核翻译起始因子的两种调节剂。有丝分裂原和生长因子可激活P70S6K1并随后磷酸化S6激酶,激活自噬。活化状态的mTORC1复合体通过磷酸化ULK1、ATG13、ATG101和FIP200组成的ULK1复合体来抑制细胞自噬,降低ULK1激酶的活性;而诱导细胞自噬的信号通过抑制mTORC1激活ULK1复合体,促进自噬的启动[18]。
除mTORC1以外,ULK1复合物的水平还受能量感受器AMPK的调控[19]。随着对AMPK功能及作用机制的研究深入,越来越多的研究发现AMPK可以直接作用于ULK1调控自噬[20]。Compound Cs是AMPK特异性抑制剂[21],本研究通过Compound C特异性抑制HT22细胞AMPK表达,进而降低细胞自噬水平作为自噬抑制模型,然后予以α-生育酚处理观察其对自噬的影响以及明确α-生育酚自噬信号通路机制。实验结果显示C.C组能降低细胞自噬水平,加入α-生育酚干预后细胞自噬显著提高,细胞内ULK1表达上调,p-mTOR水平下降。但α-生育酚并没有提高AMPK的表达水平,提示AMPK不是α-生育酚诱导自噬的关键分子,其自噬诱导信号机制可能与抑制mTOR/ULK1信号通路有关。综上,α-生育酚可诱导细胞自噬,AMPK不是α-生育酚诱导自噬的关键分子,其信号机制可能与抑制mTOR/ULK1信号通路有关。
