头孢孟多酯钠制备技术优化及质量研究
2021-12-17张爽贾全刘树斌任峰田洪年贺娇
张爽,贾全,刘树斌,任峰,田洪年,贺娇
(华北制药河北华民药业有限责任公司,石家庄 052165)
头孢孟多酯钠(Cefamandolenafate, 1)为头孢菌素类抗菌药,容易在水溶液中发生降解反应,脱去苄位上的甲酰基生成头孢孟多(Cefamandole, 2)而发挥药效。本品对多数革兰阳性球菌有较强的抗菌作用,用于敏感菌所致的肺部感染、尿路感染、胆道感染等的治疗[1]。
头孢孟多酯钠是由美国Lilly 公司于1972年创制成功,1978年首先在英国上市,注射剂商品名为Mandol,并由上海新先锋药业率先在国内上市;2004年初浙江永宁药业、海南灵康药业股份有限公司等厂家开始仿制申报,2005年我国批准进口YungjinPharm.Co., Ltd(韩国)头孢孟多酯料药及台湾生达制药2 个规格的注射用头孢孟多酯钠。
合成头孢孟多酯钠的传统工艺方法主要有活性酯法和酰氯法两种,且大都以7-氨基头孢烷酸(7-ACA)或7-氨基-3-(1-甲基-1H-四氮唑-5-基)-硫甲基-3-头孢-4-羧酸(7-TMCA)作为起始原料。① 活性酯法:利用甲酰基扁桃酸与甲巯基四氮唑反应先制成活性酯,再与7-ACA 或7-TMCA 反应,得到头孢孟多酯酸,经成盐反应制得头孢孟多酯钠[2]。但该方法存在工艺复杂,合成总收率不高,且部分原材料具有高毒性和高过敏性等缺点,因此不适合于工业化生产。② 酰氯法:利用7-TMCA 经硅烷基化保护,再与甲酰基扁桃酰氯进行酰化反应,经水解、脱色、成盐反应后制得头孢孟多酯钠[3-4]。该方法工艺路线相对简单,适合于工业生产。其中,反应溶剂、硅烷基化、保护试剂、结晶溶剂的选择是影响产品质量和收率的关键因素[5]。
本文在酰氯法的基础上,本着产品质量好、原料廉价易得、工艺步骤操作简单且危险性小、反应条件温和、设备要求简单的出发点,对头孢孟多酯钠的合成工艺进一步作了优化与改进。经研究发现,在反应的准备阶段时,将反应物先溶解到低温溶剂中,使其在接下来的反应中能够以离子形式存在,参加头孢孟多酸酯的合成反应,使得合成反应地更加充分,提高反应的速率。本文在头孢孟多酸酯合成步骤中,加料的时间严格控制在一定的范围内,使得在反应容器中的反应物浓度不会聚集过高,有效控制过程杂质的生成,产品质量满足《中华人民共和国药典》2020年版二部标准要求,对工业化生产具有指导意义。
1 实验部分
1.1 试剂与仪器
1260 高效液相色谱仪(HPLC,美国Agilent Technologies Inc),DHJF-4002 低 温 恒 温 反 应 浴,SHB-B95 型循环水式多用真空泵,DZF-6050 真空干燥箱,7-TMCA(华北制药河北华民药业有限责任公司),异辛酸钠(北京百灵威科技有限公司),其他所有试剂均为分析纯,水为纯化水。
1.2 合成路线
以7-TMCA(2)为起始原料,选用条件温和易于控制的BSA(3)作为硅烷基化保护试剂,改变现有工艺[6]体系中溶剂配比、7-TMCA 硅烷化浓度,与甲酰基扁桃酰氯(5)反应,水解得到头孢孟多酯酸(6),利用相转移技术头孢孟多酸除杂、纯化,经浓缩、成盐、结晶得到产品化合物1,合成路线,如图2 所示。
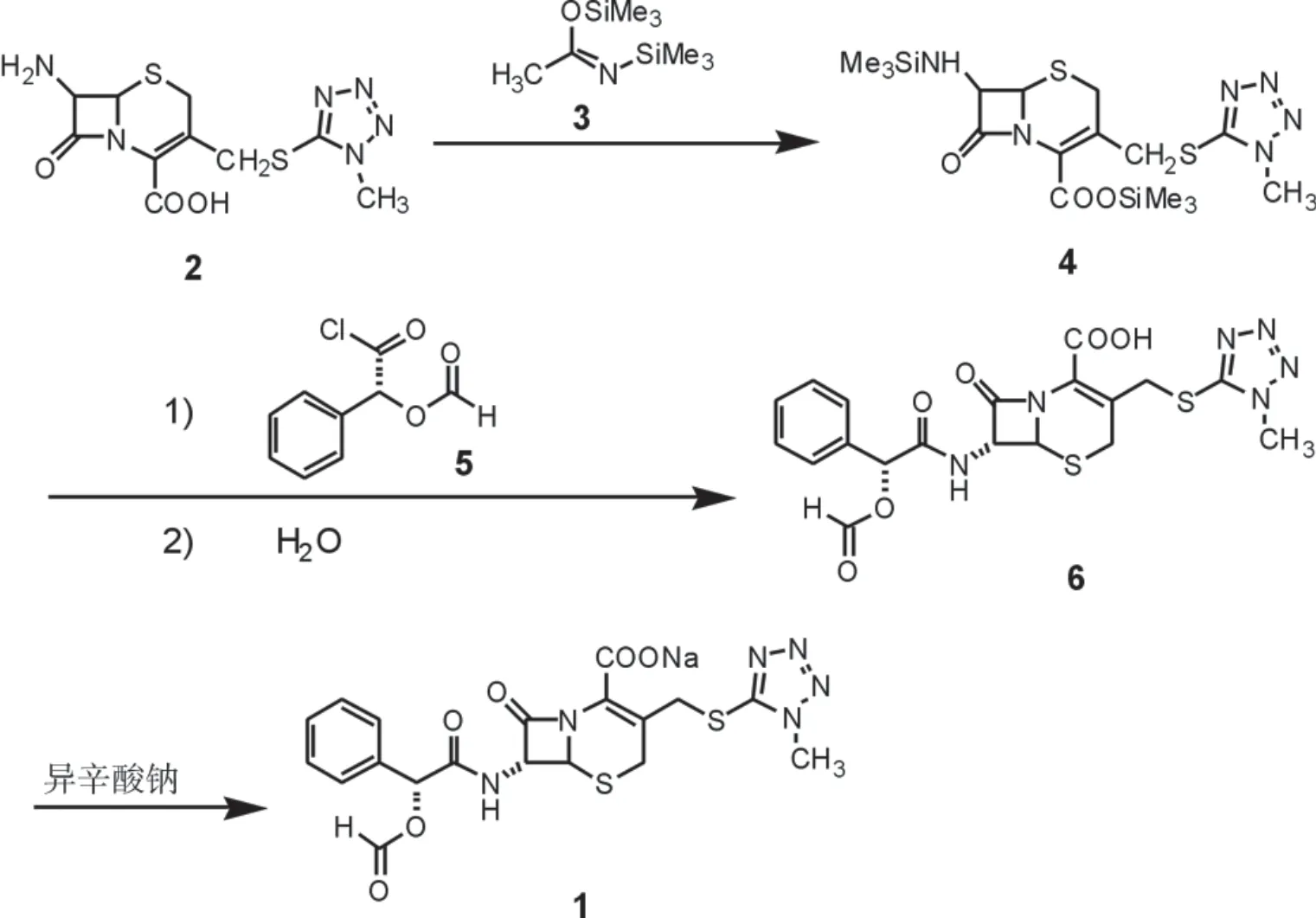
图2 头孢孟多酯钠合成路线Fig.2 Synthetic route of cefmendol axetil sodium
2 实验结果与讨论
2.1 工艺优化
2.1.1 头孢孟多酯酸(6)的合成:
向500 mL 反应瓶中加入二氯甲烷125 mL,7-TMCA 25 g,BSA 30.5 g,控温30 ℃,反应50 min,溶清后反应结束控温0 ~ 10℃,滴加甲酰基扁桃酰氯15 mL, 反 应30 ~ 60 min, 检 测7-TMCA 残 留≤2.0%,反应结束。在另一个四口瓶中加入50 mL纯化水,将反应液流加入5 ~ 15℃以下的50 mL 纯化水,同时流加10%的碳酸氢钠溶液,过程控制pH=5.5±0.1,快速搅拌5 min,静置分相,回收有机相。向水相中加入乙酸乙酯150 mL,用6 mol/L 盐酸溶液调节pH=0.52,快速搅拌10 min,静置分相,向乙酸乙酯相中加入2.5 g 活性炭及2.5 g 无水硫酸镁,脱色脱水处理30 min,水分0.75%。进一步优化酰化反应过程中关键因素,结果见表1。

表1 酰化过程参数优化Tab.1 Optimization of acylation process parameters
由表1 可以看出, 酰化反应在5 ℃反应60 min,7-TMCA 残留为0.3%,说明酰化反应完全,且产生的头孢孟多降解杂质少,不会对产品质量产生影 响。
2.1.2 头孢孟多酯钠(1)的合成
溶解12 g 异辛酸钠于100 mL 乙酸乙酯中,溶清并经无菌过滤后,40 min 流加至结晶器(头孢孟多酯酸溶液)中,流加过程温度控制在20 ~ 25℃。加入异辛酸钠溶液时控制体系pH 值在7.1 ~ 7.5 之间,流加完毕后,养晶30 min,大量出晶。然后90 min内加入乙酸乙酯200 mL,养晶30 min。过滤,洗涤(50 mL 丙酮×2 次),40℃真空干燥,然后经无菌分装得到注射用头孢孟多钠粉针制剂。进一步优化结晶反应过程中关键因素,结果见表2。

表2 结晶过程参数优化Tab.2 Optimization of crystallization process parameters
由表2 可以看出,结晶反应控制温度在23℃,加入异辛酸钠在pH 值7.3 时,产品收率及质量较好,质量收率较现有技术制备的产品提升约5 个百分点。
2.2 质量检测
2.2.1 原料药质量检测
按照优化工艺进行连续三批小试实验,并取现有技术制备产品及市售样品,检测各项质量指标,具体数据见表3。

表3 试验样品与市售样品质量对比表Tab.3 Comparison of quality indexes of cefmendol axetil sodium
由表3 可以看出,优化工艺制备的产品质量优于现有技术及市售样品,其质量指标符合《中华人民共和国药典》2020年版二部标准。
2.2.2 制剂质量研究
文献 [7]表明含5%碳酸钠的注射用头孢孟多酯钠的总不良反应例数远低于不含碳酸钠的制剂,其混粉产品更合理。将试验样品分别与5%碳酸钠混和得到制剂样品1 ~ 3,并同时取市售某厂样品,按照《欧洲药典》10.0 版检测方法一起测定各项质量指标,质量结果见表4。

表4 注射用头孢孟多酯钠质量对比表Tab.4 Comparison of quality indexes of cefmendol axetil sodium for injection
由表4 可看出,采用新工艺制备的头孢孟多酯钠经过混粉后各项质量指标均满足《欧洲药典》10.0版标准,且优于市售样品。
2.2.3 加速试验研究
取上述四批制剂样品适量,分别置于(40±2)℃、相对湿度(75±10)%条件下放置1 个月,测定对pH 值、有关物质、含量等,以判断制剂的稳定性,质量结果见表5。

表5 加速试验质量对比Tab.5 Quality comparison of accelerated experiment
试验结果表明,头孢孟多酯钠制剂产品在加速过程中,各项指标检测仍符合《欧洲药典》10.0 版标准,且杂质总和明显优于市售产品,表明该制剂品质较高、稳定性较好。
3 结论
综上,头孢孟多酯钠的制备工艺进行优化与改进后,使用高浓度二氯甲烷反应体系,硅烷化、酰化过程快,反应时间短,7-TMCA 反应残留在0.5%以下,产品质量收率达到133%,质量符合《中华人民共和国药典》2020年版二部标准,制剂样品满足《欧洲药典》10.0 版标准。通过加速试验与市售样品质量对比,证明优化工艺在质量稳定性优于现有技术产品,可满足患者用药安全性;且该工艺制备过程产生的废液均可回收利用,绿色环保、降低生产成本,适于大规模工业化生产。
