鹰嘴豆多肽的免疫活性研究
2021-12-17王亚非于淼淼沈明浩
王亚非,于淼淼,于 悦,陈 卓,丁 越,黄 珊,沈明浩
(1吉林农业大学 食品科学与工程学院,吉林 长春130000;2长春海关技术中心,吉林 长春 130031)
鹰嘴豆(CiceraretinumL.)别名鸡心豆,属豆科鹰嘴豆属植物,其播种面积大,资源丰富,营养价值极高,是天然的植物蛋白资源[1]。因此,以鹰嘴豆为原料加工的鹰嘴豆饼、鹰嘴豆罐头等相关食品,具有成为主流豆类食品的潜质。鹰嘴豆中蛋白质含量约占籽粒干质量的30%,且其蛋白类成分在增强免疫力[2]、抗氧化[3]、抗肿瘤[4]、降低胆固醇[5]等方面的生理活性远高于大豆及豌豆等豆类作物,因而受到国内外学者的广泛关注。
有研究表明,从豆科作物中分离出的多肽类物质可以有效提高生物体对疾病的抵御能力,增强巨噬细胞的吞噬作用,激发非特异性免疫防御系统,从而使生物体免受侵害。这些多肽类物质的分子质量主要介于50~1 000 u[6-7]。张健等[8]研究发现,大豆肽能显著提高小鼠血清中IgM、IgG及IgA的含量,从而显著增强体液免疫功能。杨健等[9]研究发现,绿豆肽具有免疫调节功能,可通过抑制巨噬细胞自噬、改变其分泌的细胞因子水平而发挥免疫调节活性。
近年来,对鹰嘴豆多肽(chickpea peptides,CP)的免疫调节作用研究还处于初级阶段。高捷等[10]研究发现,鹰嘴豆多肽对荷瘤小鼠的特异性和非特异性免疫功能具有明显的促进作用;刘艳等[11]研究表明,鹰嘴豆多肽中谷氨酸和天冬氨酸占比最高,且其分子质量主要集中在1 000 u以下;李睿珺等[12]研究认为,富含谷氨酸、天冬氨酸等疏水性氨基酸的鹰嘴豆多肽对免疫功能低下小鼠具有较强的免疫调节活性。本研究从鹰嘴豆多肽对环磷酰胺所致免疫功能低下小鼠和RAW264.7细胞的影响,来探究其免疫调节功能和作用机制,以期为我国西北地区鹰嘴豆的开发利用提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 试验动物 SPF级BALB/C雌鼠,体质量(21±2) g,购自辽宁长生生物技术有限公司,许可证编号:SCXK(辽)2020-0001。
1.1.2 主要试剂 鹰嘴豆,购自新疆木垒县;碱性蛋白酶、中性蛋白酶、风味蛋白酶及免疫球蛋白G(IgG)、IgA、IgM、干扰素-γ(IFN-γ)、NO、白细胞介素-2(IL-2)、IL-6、肿瘤坏死因子-α(TNF-α)、IL-1β检测试剂盒,购自福建泉州市九邦生物科技有限公司;噻唑蓝(MTT)和二甲基亚砜(DMSO),购自上海源叶生物科技有限公司;RAW264.7细胞,由吉林农业大学食品科学与工程学院安全实验室保存;环磷酰胺和脂多糖(lipopolysaccharides,LPS),为美国Sigma公司产品。
1.1.3 主要仪器 多功能酶标仪,江苏常州德社精密仪器有限公司产品;低温自动平衡离心机,辽宁辽阳弘扬分离设备有限公司产品;高效液相色谱仪和氨基酸自动分析仪,日本岛津公司产品;CO2培养箱,美国NUAIRE公司产品。
1.2 鹰嘴豆多肽的制备及其分子质量分布与氨基酸组成测定
参考叶健明等[13]的复合酶解方法制备鹰嘴豆多肽。以鹰嘴豆豆粉为原料,用碱溶酸沉法制得鹰嘴豆蛋白质,采用碱性蛋白酶进行初步酶解,再用质量比1∶1混合的中性蛋白酶和风味蛋白酶酶解,酶解条件(经响应面优化得到)为:加酶量5 300 U/g,pH 7,酶解时间3.5 h,酶解温度55 ℃,在此工艺下多肽得率为63.94%。酶解样品采用葡聚糖凝胶柱纯化。
采用高效液相色谱(HPLC)对鹰嘴豆多肽的分子质量分布进行分析,色谱柱为TSK G2000SW(300×7.5 mm),洗脱溶剂为50 mmol/L、pH 5.0的磷酸盐缓冲液,其中含有1 g/L三氟乙酸和350 mL/L甲醇。流动相流速为0.75 mL/min,洗脱组分采用波长220 nm紫外波检测,根据标准分子质量蛋白的分子质量曲线确定多肽的分子质量。
依据《食品中氨基酸的测定》(GB 5009.124-2016),用氨基酸自动分析仪测定鹰嘴豆多肽的氨基酸组成及其质量分数。
1.3 鹰嘴豆多肽免疫活性的测定
1.3.1 试验动物分组与处理 取60只小鼠,连续3 d腹腔注射环磷酰胺(80 mg/kg)建立免疫功能低下的动物模型。建模成功后,取50只免疫功能低下小鼠随机均分为5组,即模型组(灌胃生理盐水)及阳性对照组(灌胃匹多莫德25 mg/kg)和鹰嘴豆多肽低剂量组(灌胃鹰嘴豆多肽50 mg/kg)、中剂量组(灌胃鹰嘴豆多肽100 mg/kg)、高剂量组(灌胃鹰嘴豆多肽200 mg/kg),另取10只健康小鼠作为空白组(灌胃生理盐水)。各组小鼠每日灌胃1次相应物质,连续灌胃21 d。
1.3.2 胸腺指数、脾脏指数的测算 21 d的灌胃试验结束后,每组随机取6只小鼠称体质量,眶静脉采血后断颈处死,分离胸腺和脾脏并称其质量,按下述公式计算胸腺和脾脏的器官指数:器官指数=器官质量(mg)/体质量(g)。
1.3.3 脾脏组织和胸腺组织形态的观察 采用常规方法将脾脏和胸腺固定、包埋、切片、苏木精-伊红染色(hematoxylin eosin staining,HE染色)后,分别观察形态变化。
1.3.4 脾淋巴细胞增殖情况测定 称取相同质量1.3.2中所用6只小鼠的脾脏,无菌条件下制备脾淋巴细胞悬液[14],台盼蓝染色并计数,要求细胞活率>95%。取 96 孔细胞板,对照孔加100 μL脾淋巴细胞悬液(3×106mL-1),刺激孔加100 μL同浓度脾淋巴细胞悬液和终质量浓度为5 μg/mL的刀豆蛋白(ConA),各5个重复。培养20 h后加20 μL MTT(5 mg/mL)再培养4 h,然后加150 μL DMSO,于10 min后测定490 nm处吸光度值(OD490)。用刺激指数(SI)来反映各组小鼠脾淋巴细胞的增殖率,SI =刺激孔OD490/对照孔OD490。
1.3.5 血清中免疫球蛋白和细胞因子水平的测定 将小鼠血样2 000 r/min离心15 min后取血清,用试剂盒检测血清中IgG、IgA、IgM及IFN-γ、IL-6、IL-2的质量浓度。
1.3.6 RAW264.7细胞增殖率、吞噬能力和细胞因子水平的测定 (1)增殖率。向96孔细胞板中加入RAW264.7细胞悬液(1.6×105mL-1) 180 μL/孔,于体积分数5% CO2、37 ℃条件下培养24 h后,将细胞分为空白对照组、阳性对照组和鹰嘴豆多肽试验组,空白组仅加入10 μL细胞培养液,阳性对照组加入10 μL LPS(终质量浓度为2 μg/mL),鹰嘴豆多肽试验组加入10 μL不同质量浓度(50,100,200和400 μg/mL)的鹰嘴豆多肽溶液,继续培养24 h。然后加入20 μL MTT(5 mg/mL)培养4 h后弃上清,加200 μL DMSO,于490 nm处测定吸光度值,计算SI。
(2)吞噬能力。细胞培养和处理方法同1.3.6(1)中,结束后吸取培养液,空白对照组仅加入150 μL红细胞裂解液,其余各组加入质量分数0.075%中性红溶液100 μL,继续培养1 h后吸弃中性红溶液,用PBS清洗2次,加入150 μL红细胞裂解液,在540 nm波长处检测各孔吸光度值(OD540)。计算相对吞噬率:吞噬率=(试验组OD540/空白组OD540)×100%。
(3)细胞因子水平。 细胞培养与处理方法同1.3.6(1)中,培养结束后吸取培养液,采用ELISA试剂盒测定NO、TNF-α、IL-6、IL-1β的水平。
1.4 数据处理
数据用SPSS 20.0统计分析软件进行处理和差异显著性分析,结果以“平均值±标准值”表示,用Origin 8.5绘图。
2 结果与分析
2.1 鹰嘴豆多肽的分子质量分布与氨基酸组成
鹰嘴豆多肽分子质量分布HPLC分析结果如图1所示。

图1 鹰嘴豆多肽分子质量的分布Fig.1 Molecular mass distribution of chickpea peptides
图1显示,样品出峰时间主要集中在14.0~25.0 min,保留时间16.8 min所出峰的分子质量为1 476 u;18.2 min所出峰的分子质量为673 u;20.4 min所出峰的分子质量为411 u;22.3 min所出峰的分子质量为118 u,该多肽组分峰面积占总面积的2.6%,为游离氨基酸,可知葡聚糖凝胶柱纯化后多肽纯度为97.4%。鹰嘴豆多肽分子质量主要集中在1 500 u以下,在1 500~120 u的多肽组分占87.1%,其中分子质量在1 000 u以下的多肽组分占74.9%。有文献报道,分子质量介于1 000~50 u的多肽类物质具有良好的免疫活性[6-7],据此可知本研究制备的鹰嘴豆多肽免疫活性良好。
表1显示,鹰嘴豆多肽富含谷氨酸、天冬氨酸、精氨酸、赖氨酸、亮氨酸、丝氨酸等氨基酸,其中谷氨酸质量分数最高(18.412%),其次是天冬氨酸及精氨酸,分别占9.592%和7.088%。

表1 鹰嘴豆多肽的氨基酸组成及其质量分数Table 1 Amino acid composition and mass fraction of chickpea peptides
2.2 鹰嘴豆多肽对小鼠体质量和免疫器官的影响
如表2所示,各组小鼠初始体质量无明显差异,21 d后,模型组小鼠体质量及免疫器官指数极显著低于空白组(P<0.01),表明脾脏和胸腺组织明显受损,显示造模成功。鹰嘴豆多肽高剂量组小鼠体质量较模型组显著增加(P<0.05),表明其具有增加小鼠体质量的功效;鹰嘴豆多肽低、中剂量组免疫脏器指数显著或极显著提高(P<0.05),高剂量组极显著提高(P<0.01),表现出剂量效应关系,说明其具有改善免疫器官损伤的作用。

表2 鹰嘴豆多肽对小鼠体质量和免疫器官指数的影响Table 2 Effect of chickpea polypeptides on mouse body weight and immune organ indexes
2.3 鹰嘴豆多肽对小鼠脾脏和胸腺组织结构的影响
脾脏组织切片染色结果如图2所示。由图2可以看出,空白组小鼠的脾脏红、白髓界线清楚,视野中无可见病变,白髓中存在较多结构完整的脾小体,红髓中脾索整体相连,脾窦明显。模型组小鼠脾脏红髓与白髓边界消失,各视野组织几乎变成单细胞,组织结构明显破损。与模型组相比,鹰嘴豆多肽中、高剂量组和阳性对照组的红髓、白髓界线清晰,脾索网络结构良好。表明鹰嘴豆多肽缓解了环磷酰胺引起的小鼠脾脏组织学病变。
胸腺组织切片染色结果如图3所示。由图3可以看出,空白组小鼠胸腺皮质和髓质界限分明,皮质颜色较深,面积较广,可以观察到胸腺细胞排列紧密(图3-A)。模型组小鼠胸腺皮质和髓质界限不清,皮质占比缩小而髓质占比增加,皮质区胸腺细胞数量减少(图3-B)。与模型组相比,鹰嘴豆多肽低、中、高剂量组皮质占比增加,皮、髓质界线逐渐清晰,中、高剂量组基本恢复到空白组水平(图3-D,E,F)。表明鹰嘴豆多肽也可缓解环磷酰胺引起的小鼠胸腺组织学病变。
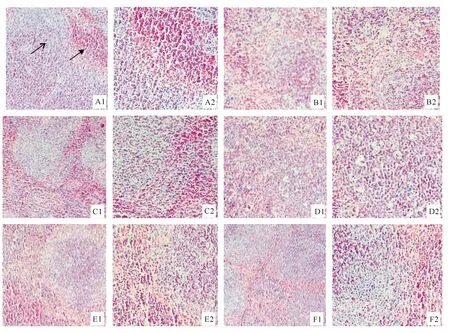
A1.空白组(×100);A2.空白组(×200);B1.模型组(×100);B2.模型组(×200);C1.阳性对照组(×100);C2.阳性对照组(×200); D1~F1.鹰嘴豆多肽低、中、高剂量组(×100);D2~F2.鹰嘴豆多肽低、中、高剂量组(×200)。.白髓, .红髓A1.Blank group(×100);A2.Blank group(×200);B1.Model group(×100);B2.Model group(×200);C1.Positive group(×100); C2.Positive group(×200);D1-F1.Chickpea polypeptide low,medium and high dose groups (×100); D2-F2.Chickpea polypeptide low,medium and high dose groups(×200)..White pulp, .Red pulp图2 鹰嘴豆多肽对小鼠脾脏组织结构的影响Fig.2 Effects of chickpea polypeptides on spleen tissue morphology in mice

A.空白组;B.模型组;C.阳性对照组;D~F.鹰嘴豆多肽低、中、高剂量组。.皮质, .髓质A.Blank group;B.Model group;C.Positive group;D-F.Chickpea polypeptide low,medium and high dose groups..Cortex, .Medulla图3 鹰嘴豆多肽对小鼠胸腺组织结构的影响(×100)Fig.3 Effect of chickpea polypeptides on tissue structure of thymus in mice(×100)
2.4 鹰嘴豆多肽对小鼠脾淋巴细胞增殖的影响
由图4可知,模型组小鼠脾淋巴细胞增殖率(刺激指数)极显著低于空白组(P<0.01);鹰嘴豆多肽各剂量组小鼠经ConA诱导的脾淋巴细胞增殖率与模型组相比显著或极显著提高,并表现出剂量效应关系,其中高剂量组作用效果最明显。
2.5 鹰嘴豆多肽对血清免疫球蛋白和细胞因子质量浓度的影响
由表3可知,模型组小鼠的血清IgG、IgA和IgM质量浓度均极显著低于空白组(P<0.01);鹰嘴豆多肽各剂量组小鼠的IgG、IgA和IgM质量浓度大多显著或极显著高于模型组,且随鹰嘴豆多肽用量的增加而升高,存在剂量效应关系。
从表4可以看出,模型组小鼠细胞因子IL-2、IL-6和IFN-γ质量浓度均极显著低于空白组(P<0.01)。鹰嘴豆多肽组小鼠血清中细胞因子IL-2、IL-6和IFN-γ质量浓度与空白组小鼠相比均有所降低,其中低、中剂量组显著或极显著降低,高剂量组降低不显著。与模型组相比,鹰嘴豆多肽组小鼠血清中IL-2、IL-6和IFN-γ质量浓度大多显著或极显著增加,且具有剂量效应关系。

与空白组相比,图柱上标*表示差异显著(P<0.05),标**表示 差异极显著(P<0.01); 与模型组相比,图柱上标#表示差异 显著(P<0.05),标##表示差异极显著(P<0.01)。图6,7同Compared with the blank group,* indicates significant difference (P<0.05),and ** indicates very significant difference (P<0.01); Compared with the model group,# indicates significant difference (P<0.05),and ## indicates extremely significant difference (P<0.01).The same for Fig.6 and 7图4 鹰嘴豆多肽对小鼠脾淋巴细胞增殖的影响Fig.4 Effect of chickpea polypeptides on proliferation of mouse spleen lymphocytes

表3 鹰嘴豆多肽对小鼠血清免疫球蛋白质量浓度的影响Table 3 Effect of chickpea polypeptides on mass concentration of serum immunoglobulin in mice serum

表4 鹰嘴豆多肽对小鼠血清细胞因子质量浓度的影响Table 4 Effect of chickpea polypeptides on mass concentration of cytokines in mice serum pg/mL
2.6 鹰嘴豆多肽对RAW264.7细胞增殖的影响
由表5可知,随着鹰嘴豆多肽质量浓度的增加,RAW264.7细胞的增殖率逐渐增大,其中当质量浓度为200和400 μg/mL时,细胞增殖率分别为15.76%和22.62%,与空白组差异极显著(P<0.01)。表明鹰嘴豆多肽可以促进RAW264.7细胞增殖,且表现出剂量效应关系。
2.7 鹰嘴豆多肽对RAW264.7细胞吞噬活性的作用
由图5可以看出,空白组RAW264.7细胞较小,呈圆形(图5-A);阳性对照组细胞增大,呈梭形并且出现伪足(图5-B);鹰嘴豆多肽组细胞也增大,细胞趋于长梭形,其中400 μg/mL剂量组细胞与阳性对照组细胞形态相近。表明鹰嘴豆多肽可以刺激RAW264.7细胞形态由正常状态变为激活状态。

表5 鹰嘴豆多肽对RAW264.7细胞增殖的影响Table 5 Effect of chickpea polypeptide on proliferation of RAW264.7 cells

A.空白组;B.阳性对照组;C~F.鹰嘴豆多肽质量浓度分别为50,100,200和400 μg/mLA.Blank group;B.Positive control group;C-F.Chickpea polypeptide mass concentrations are 50,100,200 and 400 μg/mL,respectively图5 鹰嘴豆多肽对RAW264.7细胞形态的影响(×100)Fig.5 Effect of chickpea peptides on morphology of RAW264.7 cells(×100)

CP50,CP100,CP200,CP400分别代表50,100,200,400 μg/mL 鹰嘴豆多肽处理。图7同CP50,CP100,CP200 and CP400 represent 50,100,200 and 400 μg/mL chickpea polypeptide treatments,respectively. The same for Fig.7图6 鹰嘴豆多肽对RAW264.7细胞吞噬能力的作用Fig.6 Effect of chickpea polypeptides on phagocytic ability of RAW264.7 cells
由图6可以看出,与空白组相比,鹰嘴豆多肽处理组(50 μg/mL组除外)可以显著增加RAW264.7细胞的相对吞噬率(P<0.05),且呈剂量效应关系,表明鹰嘴豆多肽可以促进RAW264.7细胞吞噬作用的提升。
2.8 鹰嘴豆多肽对RAW264.7细胞NO、TNF-α、IL-6和IL-1β水平的影响
与空白组相比,不同质量浓度鹰嘴豆多肽组RAW264.7细胞的NO和TNF-α水平均极显著提高(P<0.01),且随着质量浓度升高作用效果加强(图7-A,B)。与空白组对比, 100~400 μg/mL鹰嘴豆多肽组均能够显著或极显著提高RAW264.7细胞的IL-6和IL-1β水平,且存在剂量效应关系(图7-C,D)。表明鹰嘴豆多肽可促进RAW264.7细胞分泌NO、IL-6、IL-1β和TNF-α,从而发挥免疫调节作用。
3 讨 论
鹰嘴豆资源丰富,营养成分含量极高,是天然的植物蛋白资源。由鹰嘴豆蛋白质酶解得到的鹰嘴豆多肽必需氨基酸种类齐全且分子质量相对较小,易于消化吸收[15]。本研究所得鹰嘴豆多肽分子质量主要集中在1 000 u以下,富含谷氨酸、天冬氨酸、精氨酸、赖氨酸、亮氨酸、丝氨酸等,其中谷氨酸含量最高,占18.412%;其次是天冬氨酸和精氨酸,分别占9.592%和7.088%。有研究表明,豆科植物分子质量在1 000 u以下的蛋白肽具有良好的免疫活性,其中含有谷氨酸、天冬氨酸、精氨酸、酪氨酸和半胱氨酸等疏水性氨基酸的多肽免疫调节活性较强[16-18]。

图7 鹰嘴豆多肽对RAW264.7细胞分泌细胞因子的影响Fig.7 Effect of chickpea polypeptide on cytokine secretion of RAW264.7 cells
本研究采用环磷酰胺构建免疫功能低下的小鼠模型,模型组小鼠的免疫器官指数、血清免疫球蛋白及IL-2、IL-6和IFN-γ质量浓度均显著降低,说明免疫功能低下模型建造成功。本研究结果显示,鹰嘴豆多肽可提升免疫功能低下小鼠的脾脏指数和胸腺指数,可有效缓解环磷酰胺对小鼠脾脏和胸腺组织的损伤,表明鹰嘴豆多肽对小鼠胸腺和脾脏有一定的保护和损伤修复作用。本研究结果还表明,鹰嘴豆多肽可以促进小鼠脾淋巴细胞的增殖,提升经ConA诱导的小鼠脾淋巴细胞的增殖率。同时,鹰嘴豆多肽可以有效增强免疫功能低下小鼠血清中IL-2、IL-6和IFN-γ等细胞因子的分泌,且呈剂量效应关系。IL-2主要由Th1细胞分泌,是一种有效的T淋巴细胞生长因子,且IL-2可以促进Th1细胞自身的增殖与分化,在机体的细胞免疫方面发挥着重要作用[19-20];IL-6作为一种免疫调节因子,其功能多样,在许多方面发挥着重要作用,可以调节多种细胞的生长与分化,如促进机体T细胞的增殖、诱导NK细胞分化等[21-22];IFN-γ为Th1细胞产生的多效能活性蛋白质,可增强巨噬细胞介导的细胞免疫反应,也可增强NK细胞的杀伤能力[23-24]。本研究结果显示,鹰嘴豆多肽可有效促进小鼠体内多种细胞因子的分泌,进而通过细胞免疫途径增强小鼠的免疫力。环磷酰胺对小鼠血清IgG质量浓度影响较为明显,而IgG是血清中质量浓度最高的抗体,产生于主动免疫后,主要发挥体液免疫功能[25]。本研究中,鹰嘴豆多肽对环磷酰胺导致的小鼠血清IgG、IgA和IgM质量浓度下降有显著的恢复作用,且呈剂量效应关系,表明鹰嘴豆多肽可能通过体液免疫途径增强机体的免疫力。综上所述,鹰嘴豆多肽可以通过促进脾淋巴细胞增殖和血清细胞因子的分泌来提高机体的细胞免疫功能,通过提高血清免疫球蛋白的质量浓度来提高机体的体液免疫,这是其增强免疫功能的机制之一。
以巨噬细胞为主的吞噬细胞是病毒入侵和癌症发生的首要防线[26]。巨噬细胞被激活后,细胞增殖率显著增加,并可分泌大量与免疫活性相关的细胞因子,如炎性介质NO和细胞因子IL-6、TNF-α和IL-1β等[27],促进T细胞活化[28]。本研究考察了鹰嘴豆多肽对RAW264.7细胞功能的影响,发现鹰嘴豆多肽可活化巨噬细胞,促进巨噬细胞产生NO及细胞因子TNF-α、IL-1β和IL-6的释放,进而增强机体的免疫功能,发挥免疫调节作用。这从另一个角度说明,增强机体的先天性免疫功能也是鹰嘴豆多肽发挥免疫调节作用的机制之一。
4 结 论
鹰嘴豆多肽可以显著改善环磷酰胺导致的小鼠多项免疫相关指标的下降情况,促进脾淋巴细胞增殖,同时可以有效激活巨噬细胞,增强其吞噬能力,诱导白介素等细胞因子的生成,从而提高机体的先天性免疫机能。鹰嘴豆多肽具有良好的免疫调节活性,可有效增强机体的免疫力,具有极大的开发利用价值。
