同源建模和分子对接揭示甜菊糖苷糖基化关键酶SrUGT76G1的构效关系
2021-12-16张绍山杨云舒吕承承陈靳松
张绍山,杨云舒,吕承承,陈靳松,庄 艺,刘 圆,吴 卫*
• 药材与资源 •
同源建模和分子对接揭示甜菊糖苷糖基化关键酶SrUGT76G1的构效关系
张绍山1, 2, 3,杨云舒2,吕承承2,陈靳松2,庄 艺2,刘 圆1, 3,吴 卫2*
1. 西南民族大学青藏高原研究院,四川 成都 610041 2. 四川农业大学农学院,四川 成都 611130 3. 四川省羌彝药用资源保护与利用技术工程实验室,四川 成都 610225
揭示甜菊糖苷糖基化关键酶SrUGT76G1的构效关系。采用RT-PCR法克隆各甜叶菊材料中的变异序列;采用原核表达系统—大肠杆菌和体外催化反应验证各变异序列功能;采用Modeller 9.17软件对SrUGT76G1各变异序列蛋白进行同源建模,利用AutoDock Vina工具进行对接分析。除变异序列序列和序列外,还分别从110和B1188材料中获取了2个变异序列序列和序列。各变异序列蛋白体外催化反应和催化效率比较分析结果表明,N02蛋白相较于UGT76G1(N01-1,AY345974.1)活性显著下降,特别是以甜茶苷、甜菊糖苷(stevioside,ST)和莱鲍迪苷D(rebaudioside D,RD)为糖基受体底物时,B1188、N03和110-3蛋白对糖苷的糖基化功能已丧失;同源建模和分子对接分析发现由于各变异序列蛋白中氨基酸残基的改变,导致翻译形成的蛋白三维空间结构改变,导致无法完全包裹催化底物。SrUGT76G1形成的活性口袋能否较好地包裹糖基受体底物是其活性强弱和有无的关键。
甜叶菊;甜菊糖苷;SrUGT76G1;同源建模;分子对接
甜叶菊(Bertoni) Hemsl.为菊科(Asteraceae)甜叶菊属L.多年生草本植物,为药食两用植物,主要药食部位为干燥叶片,是继甘蔗、甜菜之后的第3种天然甜味剂[1-2]。我国目前已成为世界第一大甜叶菊种植国、生产国和出口国,约占世界市场的90%[3]。甜叶菊叶片的甜味主要来源于甜菊糖苷(stevia glycosides,SGs),其混合物甜度相当于蔗糖的250~300倍,但所含热量仅为蔗糖的1/300,故具有高甜度、低热量等优点[4-7]。目前,甜菊糖苷的安全性已得到联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)和世界卫生组织(World Health Organization,WHO)等国际组织的认可,是饮料、食品、医药及日用化工等领域的理想甜味替代剂[8-11]。我国卫生部于1985年和1990年分别批准甜菊糖苷作为不限量使用的天然甜味剂和医药用甜味剂辅料[12]。
甜菊糖苷代谢的糖基化途径中,糖基转移酶SrUGT76G1被鉴定能催化甜菊糖苷形成1,3-β--葡萄糖苷键,参与包括甜茶苷、甜叶菊苷B(rebaudioside B,RB)、甜叶菊苷A(rebaudioside A,RA)和甜叶菊苷M(rebaudioside M,RM)的形成[13-14]。通过RNA干扰、碱基突变、体外酶活性分析、同源建模和分子对接等方法研究的功能和分子机制,充分证明了在甜菊糖苷糖基化步骤中的重要作用。农杆菌介导的瞬时基因沉默降低了基因的表达,导致总糖苷含量显著下降,表明该酶的功能对糖苷含量有很大的作用[15]。根据氨基酸列相似性对目的蛋白进行同源建模,并将蛋白和底物进行分子对接,是一种被证明可以有效识别位于蛋白活性口袋(底物结合位点)中目标氨基酸残基的方法[16-17]。
课题组利用逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)的方法从糖苷含量有差异的不同基因型甜叶菊材料中克隆分析了基因,最终获的了该基因的5个变异序列~序列,其中~序列可形成完整的蛋白结构,且其功能存在显著差异[18]。在一定程度上揭示了该基因序列变异导致其蛋白空间构象的改变,进而导致其催化功能的差异,但受限于模板蛋白同源性较低(ID=30%),无法获取各SrUGT76G1变异序列蛋白的高质量三维构象[18]。幸运的是,2019年底Yang等[19]解析了SrUGT76G1(AY345974.1)蛋白的三维结构,这为通过同源建模构建各SrUGT76G1变异序列的高质量蛋白三维结构提供了保障。因此,本研究利用已发表的的2个变异序列序列和序列[18],以及利用RT-PCR方法从其他甜菊糖苷含量不同的甜叶菊材料中克隆基因,分析其序列差异并筛选变异序列;通过在大肠杆菌系统中表达重组蛋白,鉴定不同变异序列的功能。在此基础上,以SrUGT76G1(AY345974.1)为模板蛋白,采用同源建模和分子对接的方法探究SrUGT76G1的构效关系,以期进一步揭示基因催化糖苷糖基化的机制并为获取更加高效的变异序列提供支撑。
1 材料与试剂
1.1 材料
课题组前期研究基因的2个变异序列序列和序列[18]。甜叶菊材料经四川农业大学吴卫教授鉴定为甜叶菊(Bertoni) Hemsl.,命名为“110”和“B1188”,材料种植于四川农业大学成都校区实验圃。
1.2 试剂
大肠杆菌菌株DH5α和BL21(DE3)(TsingKe公司,北京);克隆载体Pclone007 blunt vecter(TsingKe公司,北京);原核表达载体pET-28a(+)由本实验室保存;总RNA提取试剂盒-E.Z.N.A.®Plant RNA Kit(OMEGA Bio-Tek,美国);反转录试剂盒-HiScript®II Q RT SuperMix for qPCR(+gDNA wiper)Kit(Vazyme公司,南京);基因克隆试剂盒-Phanta Max Super-Fidelity DNA Polymerase(Vazyme公司,南京);酶切所用酶-H I和d III(Takara公司,日本);DNA胶回收试剂盒-Gel Extraction Kit(100)(OMEGA公司,美国);同源重组试剂盒-ClonExpressTM II One Step Cloning Kit(Vazyme公司,南京);聚丙烯酰氨凝胶电泳试剂盒-10%聚丙烯酰氨凝胶电泳预混液试剂盒(新赛美公司);50 mg/mL异丙基-β--硫代半乳糖苷(IPTG)溶液(Solarbio公司,北京)。
2 方法
2.1 RT-PCR克隆甜叶菊材料中SrUGT76G1变异序列
RT-PCR克隆及其变异序列筛选参照Zhang等[18]报道相关方法。
2.2 各变异序列功能验证及其催化效率比较
由于SrUGT76G1参与糖苷1,3-β--葡萄糖苷键的形成,因此选择双糖苷甜菊双糖苷(steviolbioside)和甜茶苷、3糖苷甜菊糖苷(stevioside,ST)以及5糖苷莱鲍迪苷D(rebaudioside D,RD)分别作为底物,其中甜菊双糖苷理论上可在其C13位的第1个和第2个葡萄糖基上形成1,3-β--葡萄糖苷键,甜茶苷和ST理论上可在其C13和C19位的第1个葡萄糖基上形成1,3-β--葡萄糖苷键,RD理论上可在其C19位的第1个葡萄糖基上形成1,3-β--葡萄糖苷键(图1)。这4种糖苷底物可实现SrUGT76G1的各变异序列对糖苷C13和C19催化偏好以及糖基数量对其催化效率影响的考察。
参照Wang等[20]在比较其克隆到的3个变异序列催化效率时所用的方法,即将收集的各变异序列的诱导菌体经PBS缓冲液重悬,并经PBS稀释至菌体质量浓度为50 mg/mL,然后准确吸取一定体积的重悬菌液进行破碎,破碎方法一致,以保证获取的重组目的蛋白量一致,破碎液离心后,取350 μL上清液,6.25 μL、40 mmol/L的尿苷二磷酸葡萄糖(uridine 5′-diphosphoglucose-[glucose-1-3H],UDPG)、75 μL2.5 mmol/L的SGs于1.5 mL离心管中,30 ℃、200 r/min下诱导1 h,然后立即加入等体积水饱和的正丁醇终止反应并萃取产物,萃取液减压旋干后加入等体积的色谱甲醇溶解,经0.22 μm滤膜过滤后按以下高效液相色谱(HPLC)法检测:色谱柱TSKgel Amide-80 column(250 mm×4.6 mm,5 µm,TOSOH,日本);柱温40 ℃;检测波长210 nm;流动相体积流量1.0 mL/min;进样量10 µL;流动相为二元洗脱体系乙腈(A)-0.1%磷酸水(B),洗脱梯度:0~5.0 min,10%~15% B;5.0~16.0 min,15%~25% B;16.0~22.0 min,25%~30% B;22.0~40.0 min,30% B[18]。产物与糖苷标准品进行比较确认,以产物的相对峰面积代表产物的产量,以SrUGT76G1(AY345974.1)催化的产物峰面积为分母,其余变异序列对应的催化产物峰面积为分子,计算各变异序列较SrUGT76G1(AY345974.1)的催化效率。
2.3 变异序列的同源建模及其与甜菊糖苷对接
利用Yang等[19]解析的SrUGT76G1(AY345974.1)蛋白三维结构,在PDB蛋白数据库(https://www.rcsb.org/)中下载PDB号为“6inh”的SrUGT76G1,该蛋白复合体包括了底物(甜茶苷)和二磷酸尿苷(uridine diphosphate,UDP),以该蛋白的结构为模型,采用Modeller 9.17软件对SrUGT76G1各变异序列进行同源建模。根据molpdf、DOPE和GA341 potential评分选择最好的模型。通过在线(http://servicesn.mbi.ucla. edu/ SAVES/)检查模型的几何形状和质量。甜菊双糖苷、甜茶苷、ST和RD均是SrUGT76G1的糖基化底物,其中催化ST生成RA是最重要的反应,因此分子对接中采用ST为糖基受体,利用Chem3D软件生成ST,并优化其三维结构。利用AutoDock Vina工具进行对接分析,对接时根据“6inh”中配体的坐标位置来确定配体坐标[19]。使用PyMOL软件对结果进行分析。

图1 SrUGT76G1在甜菊醇糖基化代谢网络中的合成路线
3 结果与分析
3.1 SrUGT76G1基因在110和B1188材料中序列比较分析
利用特异性引物,通过RT-PCR从110和B1188材料中克隆了基因的开放阅读框(open reading frame,ORF)。通过构建到pclone007 blunt vector后测序,成功获得了2份不同基因型材料叶片组织中的,扩增产物大小约为1.4 kb,与预期一致。
将2份材料中获得的碱基序列与已研究报道的(AY345974.1)的比对分析发现:送测序的B1188材料中获得的单克隆,分析发现其中3个单克隆序列一致,但较AY345974.1序列发生了109个碱基的替换,以及在346位缺失了“AAGAGG”6个碱基,在这115个单核苷酸多态性(single nucleotide polymorphisms,SNP)中,没有引起氨基酸翻译的提前终止,用序列代表该差异序列;从110材料中获得的单克隆测序后发现1个单克隆序列较AY345974.1序列观察到了121个SNPs,包括在346位缺失了“AAGAGG”6个碱基,但没有导致蛋白翻译提前终止,用序列代表该差异序列。
包括课题组前期发表文章中的2个变异序列序列和序列在内,共获得了4个能形成完整蛋白的变异序列,分别是、、和序列,碱基序列经NCBI的ORFfinder(www.ncbi.nlm.nih.gov/orffinder/)翻译,进一步确定各变异序列均能形成包括C端和N端在内的完整蛋白(图2)。利用DNAMAN软件进行序列分析,确定以上各变异序列与(AY345974.1)的核苷酸相似度在92%~98%(图3)。

彩色背景的为各变异序列间的差异残基
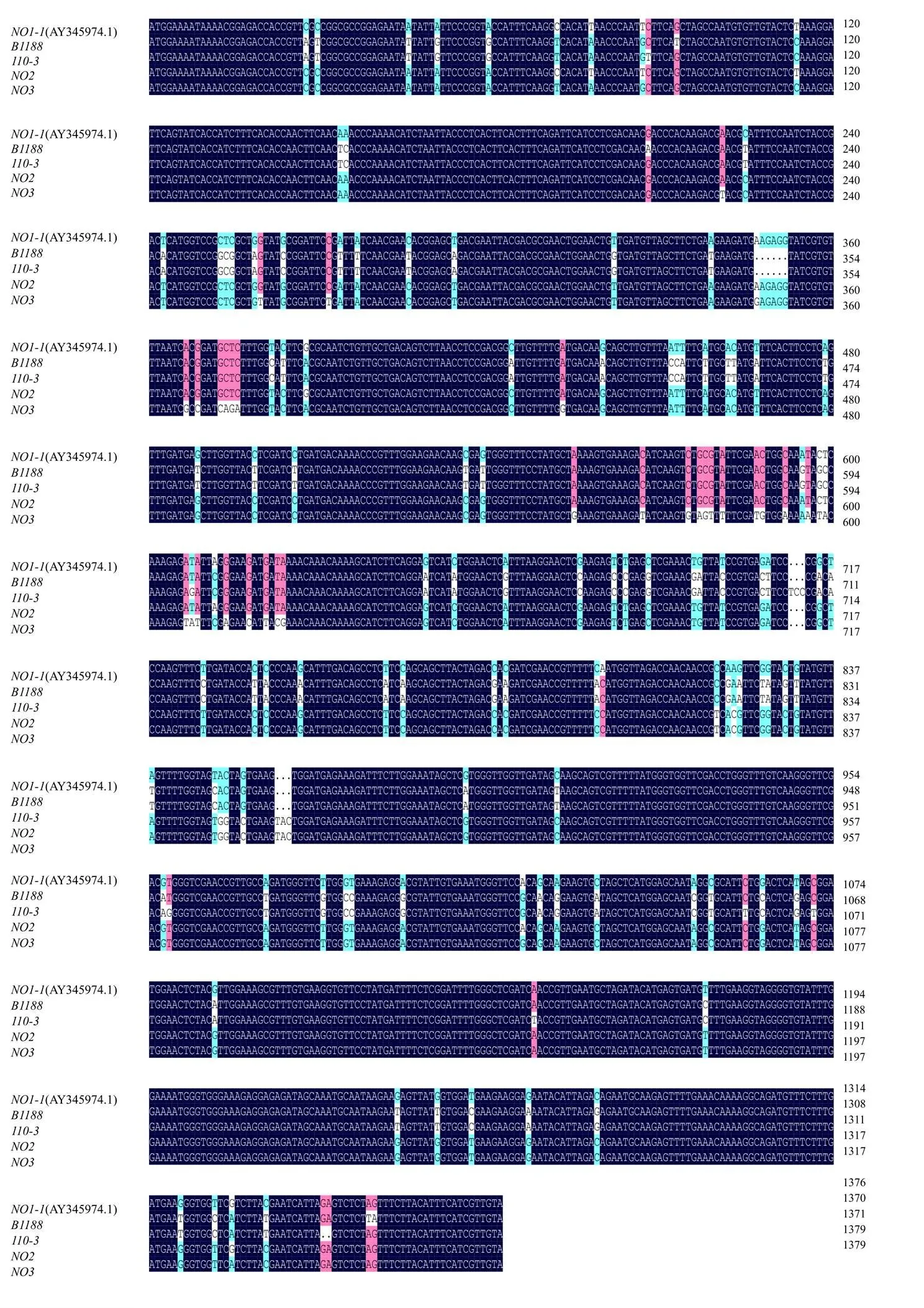
彩色背景的为各变异序列间差异碱基
3.2 SrUGT76G1变异序列的功能及催化效率比较分析
各SrUGT76G1变异序列菌体破碎离心后上清液的十二烷基硫酸钠聚丙烯酰胺凝胶(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测重组目的蛋白表达情况结果见图4,由图可得各变异序列均成功诱导表达出重组目的蛋白。具有催化活性的变异序列破碎液催化双糖苷steviobioside和甜茶苷、3糖苷ST和5糖苷RD的HPLC色谱图见图5,由于无法购得瑞鲍迪苷(rebaudioside G,RG),参照其同分异构体RB苷的保留时间对其进行确认。由图可知,N01-1蛋白和N02蛋白均可催化steviobioside形成RB苷和ST形成RA,N01-1蛋白可催化甜茶苷形成RD和催化RD形成少量的RM,而N02蛋白催化甜茶苷和RD的产物中没有检测到对应产物;N01-1蛋白催化甜茶苷苷的产物中,仅检测到了C13位糖基化的RD,而C19位糖基化的产物没有检测到,在催化ST的产物中也发现了同样的现象即没有检测到C19位进一步糖基化的产物;而N03、110-3和B1188蛋白均没有检测到对所用糖苷底物的催化活性。具有催化功能的N01-1和N02蛋白催化4种底物的催化效率分析结果见表1,可以看出,N02和N01-1蛋白催化steviobioside的效率无显著差异,而N02蛋白催化ST的效率显著低于N01-1蛋白。

箭头指示重组目的蛋白
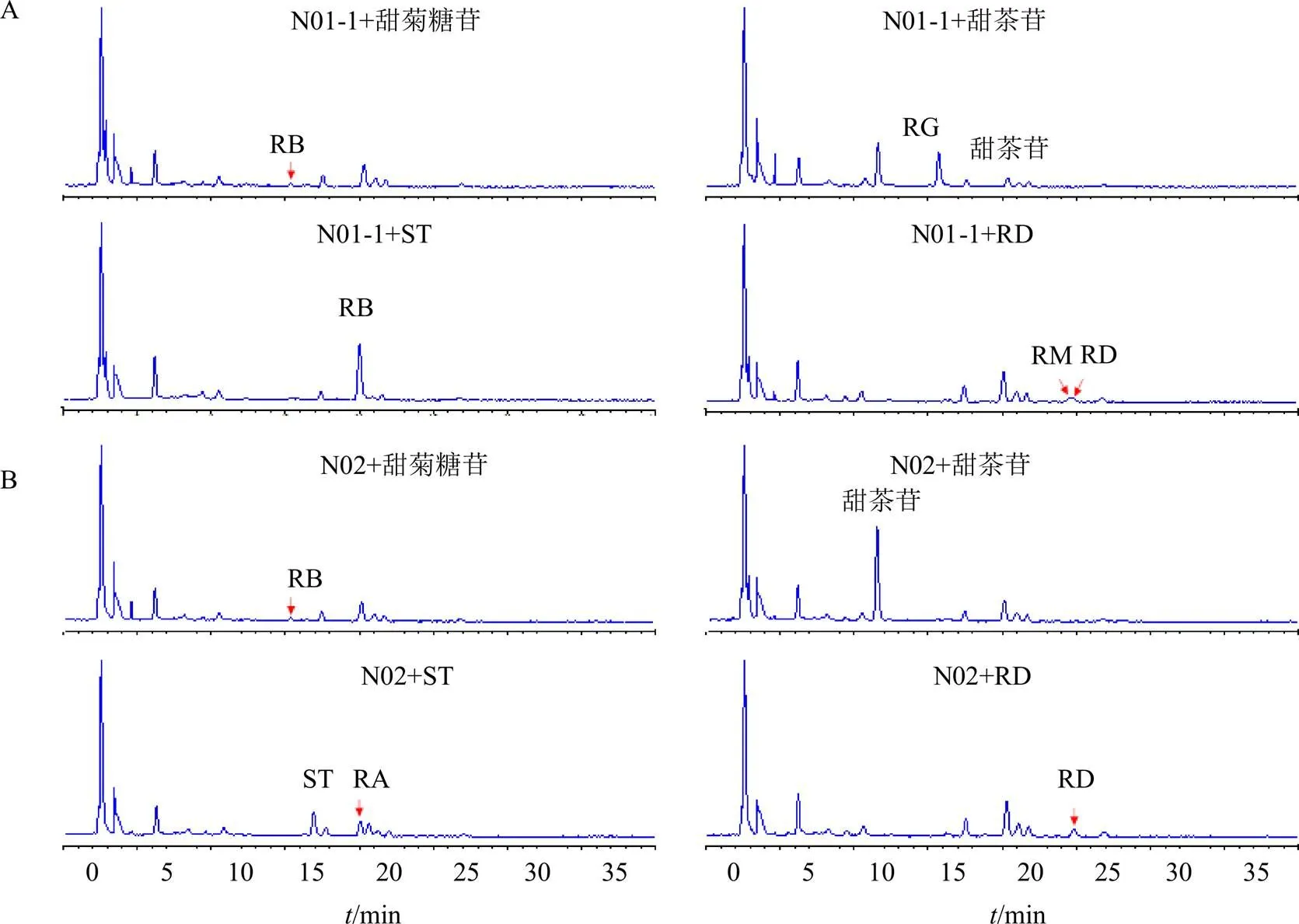
图5 N01-1 (A)和N02(B)重组蛋白分别与各糖苷底物催化反应的HPLC检测结果
3.3 同源建模及分子对接揭示SrUGT76G1变异序列功能差异
为了解这些氨基酸缺失、替换如何影响糖基化过程,导致酶活性的差异,对SrUGT76G1同拷贝进行了同源建模,并将这些模型与糖基受体底物ST进一步对接分析。结果显示SrUGT76G1变异序列蛋白的三级结构包括典型的由β折叠和α螺旋构成的面对面的2个Rossmann结构域,这是GT-B折叠型糖基转移酶的特征。将这4个SrUGT76G1变异序列的模型结构与建模模板进行叠加,表明C-末端的三级结构高度保守;N-端区域变化更大,说明它负责结合多变的底物受体。此外,4个变异序列的模型叠加后发现:N02蛋白与模板蛋白SrUGT76G1(AY345974.1)即N01蛋白叠加后二者除部分β折叠和loop区外,其余部分几乎能完全叠加,特别是在C端,这与二者均有催化活性一致;无催化活性的N03蛋白和SrUGT76G1(AY345974.1)叠加后除少部分非活性口袋处有loop区外,其余部位亦能良好的重叠;110-3蛋白和SrUGT76G1(AY345974.1)叠加后可看出它们间重叠性较差,特别是在N端,且不能正确折叠的loop区更多,说明较SrUGT76G1(AY345974.1)其蛋白构型发生了显著的变化,这与该变异序列的蛋白无糖苷催化活性一致;B1188蛋白和SrUGT76G1(AY345974.1)叠加后可看出它们间的重叠性也较差,同样的在N端的重叠性最差,以及不能正确折叠的loop区更多,说明较SrUGT76G1(AY345974.1)其蛋白构型也发生了显著的变化,这与该变异序列的蛋白无糖苷催化活性一致(图6)。

表1 SrUGT76G1各变异序列重组蛋白催化各糖苷底物的相对催化效率
“−”表示没有检测到
“−” means no detection
在Yang等[20]的研究中,由于去质子化的甜菊糖苷对UDPG的亲核反应太快,只能结晶到包含糖苷底物和UDP的SrUGT76G1晶体,但UDP的三维坐标仍然能反应出UDPG在该蛋白中的结合情况。因此,进一步将构建好的各变异序列的蛋白模型与ST和UDP对接分析,结果显示,各变异序列的活性口袋均有明显差异,且差异的大小与氨基酸序列相似性趋势一致,特别是结合ST的活性口袋差异巨大,具体差异和分析如下:N01-1蛋白与ST和UDP对接后可以看到N01-1蛋白形成的活性口袋较好地包裹了配体和底物,且底物反应基团的位置在同一个方向(图7-A),对识别ST底物的活性口袋分析,可以看到F22、P84、L85、G87、M88、I90、L126、W197、I199、L200、I203和L204构成的疏水口袋包裹着ST的甜菊醇母核和C19羧基上的葡萄糖基,而S283、T284、H356和H25与C13上的葡萄糖基形成了直接的相互作用,将STC13位上的反应基团锚定在于UDPG糖基供体中葡萄糖基相同的方向,从而让糖基化反应顺利进行(图7-B);N02蛋白与ST和UDP对接后可以看到N02蛋白形成的活性口袋亦较好的包裹了配体和底物,且底物反应基团的位置也在同一个方向(图7-C),对识别ST底物的活性口袋分析,可以看到F22、P84、L85、G87、M88、I90、L126、W197、I199、L200、I203、L204和G379构成的疏水口袋包裹着ST的甜菊醇母核和C19羧基上的葡萄糖基,这与N01-1蛋白的情况一致,而H357和Q382与C13上第1个葡萄糖基C4上的羟基形成了直接的相互作用,将STC13位上的反应基团(第1个葡萄糖基C3上的羟基)锚定在于UDPG糖基供体中葡萄糖基相同的方向,从而让糖基化反应顺利进行(图7-D);N03蛋白与ST和UDP对接后,可以看到N03蛋白形成的活性口袋仍然能较好的包裹配体和底物,且底物反应基团的位置也在同一个方向(图8-A),对识别ST底物的活性口袋分析,可以看到相比具有催化活性的N01-1和N02蛋白,N03蛋白由于氨基酸替换后不再构成疏水性的口袋,其中K199侧链上的氨基以及L85和M88中羧基上的羰基与ST C19位羧基上的葡萄糖基形成了氢键,这可能导致了ST不能转动,从而无法与UDPG完成糖基化反应(图8-B);110-3蛋白与ST和UDP对接后,可以看到虽然ST和UDPG底物反应基团的位置仍然在同一个方向,但110-3蛋白形成的活性口袋已经不能完整的包裹底物,ST中C19位上的葡萄糖已经裸露在蛋白外面(图8-C),对识别ST底物的活性口袋分析,可以看到110-3蛋白由于疏水性的口袋不能完整包裹ST,导致了ST与UDPG的距离较具有催化活性的N01-1和N02蛋白的更远,这可能导致了C13位上的葡萄糖基无法与UDPG完成糖基化反应(图8-D);B1188蛋白与ST和UDP对接后,可以看到ST的位置发生了显著的变化,ST中C13位上的参与糖基化的葡萄基已经远离了UDPG(图9-A),对识别ST底物的活性口袋分析,可以看到构成疏水口袋的残基较之前的已经发生了显著变化,导致口袋的形状和大小也发生改变,最终导致ST仅能在S87和E284极性相互作用下固定在活性口袋口,这可能导致了该变异序列的蛋白活性丧失(图9-B)。

绿色为SrUGT76G1(6INH)、青色为N02、灰色为N03、菊红色为110-3、天蓝色为B1188

A-N01-1蛋白与ST和UDP对接后整体结构图 B-A图中识别ST底物的活性口袋 C-N02蛋白与ST和UDP对接后整体结构图 D-C图中识别ST底物的活性口袋

A-N03蛋白与ST和UDP对接后整体结构图 B-A图中识别ST底物的活性口袋 C-110-3蛋白与ST和UDP对接后整体结构图 D-C图中识别ST底物的活性口袋

A-与ST和UDP对接后整体结构图 B-A图中识别ST底物的活性口袋
4 讨论
各SrUGT76G1变异序列的体外糖苷催化结果说明,SrUGT76G1是一个可识别多种糖苷底物的酶,氨基酸序列的改变对其功能有重要影响,其对各底物的催化偏好依赖于糖苷中糖基化基团的位置和糖苷上糖基的数量,具体表现为更偏好糖基化C13位羟基上的第1个葡萄糖,更偏好糖基化糖基数目相对较少的糖苷。N02蛋白对已连有1,2-β--葡萄糖基的糖苷(甜菊双糖苷和ST)仍具有催化活性,而对没有1,2-β--葡萄糖基的糖苷(甜茶苷和RD)则丧失了活性,说明SrUGT76G1更偏好糖基化已连有1,2-β--葡萄糖基的糖苷,这与Kishore等[14]和Houghton-Larsen等[21]的研究结果一致。此外,也说明甜叶菊中(AY345974.1)是经长期进化和自然选择的具有高效催化效率的序列。
据前人对甜叶菊中基因的序列分析研究结果,该基因在甜叶菊存在着广泛的序列变异,且这些变异对该基因的功能有显著影响[22],这与本研究中由于序列的差异导致N02、N03、110-3和B1188等蛋白活性丧失一致。本研究中变异序列N01-1、N02和N03蛋白氨基酸序列相似度较高,但功能差异较大,其中N01-1(AY345974.1)蛋白和N02蛋白对于steviobioside和ST具有相同的功能,说明N03、110-3和B1188酶活性丧失的主要原因可能不是和序列中的SNPs引起。在分子对接分析中,构成SrUGT76G1疏水口袋的残基是否有极性的变化,残基的差异是否导致活性口袋的形状和大小改变,活性口袋是否能较好的包裹糖基受体底物是该酶能否催化糖苷糖基化的关键;SrUGT76G1酶活的有无与强弱受蛋白的整体结构影响更大,可能单个残基的改变不会显著提高其催化效率,但却可能导致其活性的丧失。2016年Olsson等[13]利用其他物种中已解析三维结构的糖基转移酶和SrUGT76G1的氨基酸序列,构建了SrUGT76G1的蛋白模型,与糖苷底物和UDPG对接分析后识别到了49个活性口袋的氨基酸残基,进一步构建了一个包含1748个SrUGT76G1变异序列库,酶活验证后鉴定出了一些关键残基。充分证明利用同源建模和分子对接技术能较好的预测和揭示甜叶菊SrUGT76G1蛋白的三维空间结构和构效关系。
综上所述,本研究基于功能有差异的各SrUGT76G1变异序列,采用同源建模和分子对接的方法揭示了其结构和功能之间的关系,这为今后通过分子设计来改变其空间结构,从而获取高效变异序列积累了一定的科学数据。
利益冲突 所有作者均声明不存在利益冲突
[1] Yadav A K, Singh S, Dhyani D,. A review on the improvement of[(Bertoni)] [J]., 2011, 91(1): 1-27.
[2] 万会达, 李丹, 夏咏梅. 甜菊糖苷类物质的功能性研究进展 [J]. 食品科学, 2015, 36(17): 264-269.
[3] 王亚平, 李世光, 赵金庆, 等. 中国甜菊糖产业现状及其应对 [J]. 对外经贸, 2013(10): 4-6.
[4] Bondarev N I, Sukhanova M A, Reshetnyak O V,. Steviol glycoside content in different organs ofand its dynamics during ontogeny [J]., 2003, 47(2): 261-264.
[5] 赵兴华, 张全香, 苑晓威, 等. 大孔吸附树脂纯化甜菊糖苷的工艺研究 [J]. 中草药, 2012, 43(10): 1971-1974.
[6] Brahmachari G, Mandal L C, Roy R,. Stevioside and related compounds-molecules of pharmaceutical promise: A critical overview [J]., 2011, 344(1): 5-19.
[7] Jeppesen P B, Gregersen S, Alstrup K K,. Stevioside induces antihyperglycaemic, insulinotropic and glucagonostatic effects: Studies in the diabetic Goto- Kakizaki (GK) rats [J]., 2002, 9(1): 9-14.
[8] Takahashi K, Matsuda M, Ohashi K,. Analysis of anti-activity of extract from[J]., 2001, 49(1): 15-24.
[9] Hong J, Chen L, Jeppesen P B,. Stevioside counteracts the alpha-cell hypersecretion caused by long-term palmitate exposure [J]., 2006, 290(3): E416-E422.
[10] Shukla S, Mehta A, Mehta P,. Antioxidant ability and total phenolic content of aqueous leaf extract ofBert [J]., 2012, 64(7/8): 807-811.
[11] Adebiyi O E, Olayemi F O, Tan N H,.antioxidant activity, total phenolic and flavonoid contents of ethanol extract of stem and leaf of[J]., 2017, 6(1): 10-14.
[12] Jeppesen P B, Gregersen S, Alstrup K K,. Stevioside induces antihyperglycaemic, insulinotropic and glucagonostatic effects: Studies in the diabetic Goto-Kakizaki (GK) rats [J]., 2002, 9(1): 9-14.
[13] Olsson K, Carlsen S, Semmler A,. Microbial production of next-generationsweeteners [J]., 2016, 15(1): 207.
[14] Mao G H, Yu X D. Recombinant production of steviol glycosides: US, 10081826 [P]. 2018-09-25.
[15] Guleria P, Yadav S K.mediated transient gene silencing (AMTS) in: Insights into steviol glycoside biosynthesis pathway [J]., 2013, 8(9): e74731.
[16] Osmani S A, Bak S, Imberty A,. Catalytic key amino acids and UDP-sugar donor specificity of a plant glucuronosyltransferase, UGT94B1: Molecular modeling substantiated by site-specific mutagenesis and biochemical analyses [J]., 2008, 148(3): 1295-1308.
[17] Hans J, Brandt W, Vogt T. Site-directed mutagenesis and protein 3D-homology modelling suggest a catalytic mechanism for UDP-glucose-dependent betanidin 5-O-glucosyltransferase from[J]., 2004, 39(3): 319-333.
[18] Zhang S S, Chen H, Xiao J Y,. Mutations in the uridine diphosphate glucosyltransferase 76G1 gene result in different contents of the major steviol glycosides in[J]., 2019, 162: 141-147.
[19] Yang T, Zhang J Z, Ke D,. Hydrophobic recognition allows the glycosyltransferase UGT76G1 to catalyze its substrate in two orientations [J]., 2019, 10(1): 3214.
[20] Wang J F, Li S Y, Xiong Z Q,. Pathway mining-based integration of critical enzyme parts for de novo biosynthesis of steviolglycosides sweetener in[J]., 2016, 26(2): 258-261.
[21] Houghton-Larsen J, Hicks P M, Naesby M, et al. Recombinant production of steviol glycosides, US Patent WO 2013/022989 A2.
[22] Yang Y H, Huang S Z, Han Y L,. Base substitution mutations in uridinediphosphate-dependent glycosy ltransferase 76G1 gene ofcauses the low levels of rebaudioside A: Mutations in UGT76G1, a key gene of steviol glycosides synthesis [J]., 2014, 80: 220-225.
Characterizing structure-activity relationship of key glycosyltransferase SrUGT76G1 by homologous modeling and molecular docking
ZHANG Shao-shan1, 2, 3, YANG Yun-shu2, LYU Cheng-cheng2, CHEN Jin-song2, ZHUANG Yi2, LIU Yuan1, 3,WU Wei2
1. Institute of Qinghai-Tibetan Plateau, Southwest Minzu University, Chengdu 610041, China 2. Agronomy College, Sichuan Agricultural University, Chengdu 611130, China 3. Sichuan Provincial Qiang-Yi Medicinal Resources Protection and Utilization Technology Engineering Laboratory, Chengdu 610225, China
To reveal the structure-activity relationship of SrUGT76G1, which was a key glycosyltransferase involving the glucosylation of steviol glycosides.RT-PCR was used to clone thefrom differentmaterials. The prokaryotic expression systemandcatalytic reaction were used to verify the function of the SrUGT76G1 variants. Modeller 9.17 software was used to model the homology of SrUGT76G1 variants, and the docking analysis was performed with AutoDock Vina tool.In addition toand, two variantsandwere obtained from 110 and B1188 materials respectively. Compared with UGT76G1 (N01-1, AY345974.1), the activity of N02 protein was significantly lower than that of SrUGT76G1, especially using rubusoside, stevioside (ST) and rebaudioside D (RD) as receptor substrates. And the enzyme activities of B1188, N03 and 110-3 variants were lost. Homology modeling and molecular docking analysis showed that the change of amino acid residues in each variant resulted in the change of the three-dimensional structure of the SrUGT76G1 protein, resulting in the failure to completely wrap the substrates.Whether the active pocket formed by SrUGT76G1 can wrap the receptor substrate well is the key to its activity.
(Bertoni) Hemsl.; steviol glycoside; SrUGT76G1; homologous modeling; molecular docking
R286.12
A
0253 - 2670(2021)24 - 7606 - 10
10.7501/j.issn.0253-2670.2021.24.023
2021-05-09
国家自然科学基金资助项目(31671757);西南民族大学人才类(自科)-引进人才科研启动金资助项目(16011211073)
张绍山(1990—),博士,助理研究员,主要从事药用植物栽培、质量评价和次生代谢产物调控研究。E-mail: 1007354550@qq.com
吴 卫,博士,教授,博士生导师,从事药用植物次生代谢产物调控研究。E-mail: ewuwei@sicau.edu.cn
[责任编辑 时圣明]
