β-细辛醚脂质立方液晶纳米粒的Bottom-up法制备工艺优化及处方筛选
2021-12-16李绍林赵珍东沈小钟潘颖珊
李绍林,段 启,赵珍东,沈小钟,夏 黎,潘颖珊
β-细辛醚脂质立方液晶纳米粒的Bottom-up法制备工艺优化及处方筛选
李绍林,段 启*,赵珍东,沈小钟,夏 黎,潘颖珊
广东食品药品职业学院,广东 广州 510520
以β-细辛醚为模型药物,制备β-细辛醚脂质立方液晶纳米粒(β-asarone lipid cubic liquid crystal nanoparticles,β-A@LCNPs)载药系统。采用Bottom-up法,以β-A@LCNPs的包封率、载药量、稳定性常数的归一化综合评分为质量考察指标,分别通过单因素考察立方液晶制备工艺,优化工艺参数,并通过星点设计响应面法,优选β-A@LCNPs最佳处方。优选的β-A@LCNPs制备工艺参数为60 ℃条件下,配置β-A@LCNPs悬浊液,而后1000 r/min匀速搅拌1.5 h,最后置于细胞超声仪,200 W超声15次,每次5 s,间隔10 s;优选的β-A@LCNPs处方为单油酸甘油酯300 mg、β-细辛醚20 mg、聚乙烯醇27000 25 mg、水40 mL。β-A@LCNPs制备工艺简单易行,重复性好;所得β-A@LCNPs立方结构形态完整,均一稳定。
β-细辛醚;脂质立方液晶;响应面法;纳米粒;Bottom-up法;包封率;载药量;稳定性常数
立方液晶纳米粒(cubic liquid crystalline nanoparticles,LCNPs),又称脂质立方液晶纳米粒或纳米立方体,是两亲性脂质和表面活性剂在水中自发形成的双连续的立方液晶纳米分散体系,即脂质和表面活性剂结合水形成立方液晶相[1-2],再以类似固体纳米粒的形式分散在过量的水中形成分散体系,是一种新型纳米载药系统,其中水溶性药物可以包封在类脂立方液晶的水道中,脂溶性的药物包封在脂质双分子层中,两亲性分子可贯穿其中[3-4]。立方液晶介于层状液晶、六角液晶之间的一种相态,具有更好的热力学稳定性、生物黏附性、生物可降解性、多样性包载药物能力等特点[5],作为新型纳米载药系统在化学药、生物药、中药领域都有广泛应用研究,已成为国内外制剂研究的热点之一[6-8]。
LCNPs制备方法有Top-down法、Bottom-up法、热处理法、注入法、喷雾干燥法等。上述方法中,Bottom-up法是目前制备LCNPs常用的方法[9]。Bottom-up法是将脂质材料和稳定剂溶于有机溶剂中得到有机相,然后将有机相缓慢滴加到过量水相中,在搅拌、超声等外界机械力分散作用下即可形成纳米级粒子[10]。Bottom-up法更容易在较小能量输出条件下产生粒子均匀、粒径较小的LCNPs。Bottom-up法制备纳米粒过程中因稳定剂加入,纳米粒分散体有较好的稳定性[11-12]。
β-细辛醚为天南星科菖蒲属植物石菖蒲Schott有效成分,药理研究表明β-细辛醚药理作用广泛,具有保护神经系统、保护心血管、抗哮喘、抗肿瘤、驱虫等功效,具有极大的临床运用价值[13-14],但β-细辛醚水溶性差,不稳定,且体内吸收、代谢速度极快,药物浓度起伏大,难以维持足够长的有效血药浓度,生物利用度低,制约了药物的临床应用[15]。采用新剂型改进药物,是解决药物存在问题的有效方法。本实验选取β-细辛醚为模型药物,采用Bottom-up法优化β-细辛醚脂质立方液晶纳米粒(β-asarone lipid cubic liquid crystal nanoparticles,β-A@LCNPs)的制备工艺,并通过星点设计响应面法筛选β-A@LCNPs处方。
1 仪器与试药
丹东百特BT-90纳米激光粒度仪,丹东百特仪器有限公司;Agilent 1200型高效液相色谱仪,包括四元泵洗脱系统、自动进样器、在线脱气装置、柱温箱及光电二极管矩阵检测器,美国Agilent公司;VORTEX 4涡旋振荡器,上海达姆实业有限公司;DDS-307A电导率仪,上海仪电科学仪器公司;G220透射电子显微镜(TEM),荷兰FEI公司;TG16.5离心机,上海卢湘仪离心机公司;KQ-50TDB高频数控超声仪,昆山超声仪器公司;TK-12B型透皮扩散仪,上海凯锴科贸有限公司。
β-细辛醚对照品,广东食品药品职业学院自制,HPLC峰面积归一化法测得质量分数为99.21%;石菖蒲,批号201909160810,购自广州致信药业有限公司,经广东食品药品职业学院梁永枢副主任中药师鉴定为天南星科菖蒲属植物石菖蒲Schott的干燥根茎;聚氧乙烯蓖麻油(cremephor EL,CEL)、泊洛沙姆407(polyethylene-polypropylene glycol,F127)、单油酸甘油酯(glyceryl monoolein,GMO),德国BASF公司;聚乙烯醇15000(polyvinyl alcohol,PVA150)、聚乙烯醇27000(PVA)、烷基酚聚氧乙烯醚(OP10乳化剂),上海麦克林生化科技有限公司;液相用甲醇、乙腈、乙醇为色谱纯;聚乙二醇200(PEG200)、PEG400、异丙醇、丙二醇、丙三醇、去氧胆酸钠、无水乙醇均为分析纯,购于广州化学试剂厂;水为双蒸水。
2 方法与结果
2.1 β-A@LCNPs的制备
采用Bottom-up法制备β-A@LCNPs,精密称取适量GMO于50 mL烧杯中,取处方量β-细辛醚滴加无水乙醇至完全溶解,倒入上述烧杯中混匀,水浴至60 ℃,作为A相;精密称取适量PVA于100 mL烧杯中,加入适量蒸馏水,水浴至60 ℃,使PVA完全溶解,作为B相;将A相缓慢倒入B相中,60 ℃恒温条件下,以800 r/min磁粒搅拌1.5 h,再于细胞超声破碎仪上超声5 min(超声功率为150 W,5 s/次,每次间隔5 s),即得β-A@LCNPs。
2.2 β-细辛醚的含量测定
2.2.1 色谱条件 色谱柱为Eclipse XDB-C18柱(150 mm×4.6 mm,5 μm);流动相为甲醇-水(65∶35);柱温30 ℃;体积流量1.0 mL/min;检测波长253 nm;进样量10 µL;理论塔板数以β-细辛醚计不少于3400。色谱图见图1。
2.2.2 对照品溶液制备 精密称取β-细辛醚对照品适量,至棕色量瓶中,加甲醇定容,制成β-细辛醚浓度为32.27 µg/mL的溶液,过0.45 µm微孔滤膜,取续滤液,即得。
2.2.3 供试品溶液制备 精密吸取β-A@LCNPs悬浊液样品1 mL至10 mL棕色量瓶中,加甲醇定容,过0.45 µm微孔滤膜,取续滤液,即得。

图1 β-细辛醚对照品(A)、β-A@LCNPs样品(B)的HPLC图
2.2.4 线性关系考察 精密吸取β-细辛醚对照品溶液1、2、4、6、8 mL,分别置于10 mL量瓶中,加甲醇至刻度摇匀,备用。精密吸取上述对照品溶液各10 μL,进样,记录色谱图,测定峰面积,以峰面积()对进样量()进行线性回归,得回归方程=72 859.93-560.6,=0.999 99,结果表明β-细辛醚在32.27~258.16 ng,峰面积与进样量呈良好线性关系。
2.2.5 精密度试验 精密吸取上述对照品溶液各10 μL,按“2.2.1”项色谱条件,重复进样6次。结果β-细辛醚峰面积的RSD为0.15%,表明仪器精密度良好。
2.2.6 稳定性试验 分别于制备后0、0.5、1.0、3.0、6.0、12.0 h精密吸取10 μL供试品溶液进样测定,结果β-细辛醚峰面积的RSD为1.23%,表明供试品溶液在12 h内测定稳定性良好。
2.2.7 重复性试验 分别取6份β-A@LCNPs悬浊液样品,照“2.2.3”项方法制得6份供试品溶液,照“2.2.1”项色谱条件分别进样10 μL进行测定,结果β-细辛醚质量分数的RSD为0.93%,表明该方法重复性良好。
2.2.8 加样回收率试验 精密量取1 mL已测定β-细辛醚含量的β-A@LCNPs悬浊液至10 mL棕色量瓶中,共6份,分别加入2 mL已知质量浓度的对照品溶液,照“2.2.3”项方法制备供试品溶液,按“2.2.1”项色谱条件测定β-细辛醚含量,计算回收率,结果β-细辛醚的平均加样回收率为99.81%,RSD为0.75%,表明本方法β-细辛醚具有较好的加样回收率。
2.2.9 样品定量测定 按“2.2.3”项方法制备供试品进样液,依照“2.2.1”项色谱条件进样,测定β-细辛醚峰面积,代入线性方程,计算出样品中β-细辛醚的含量。
2.3 β-A@LCNPs质量考察指标测定
2.3.1 β-A@LCNPs包封率及载药量的测定 称取一定量β-细辛醚(td),按“2.1”项方法制备得β-A@LCNPs溶液,将β-A@LCNPs溶液采用高速离心法,13 485×离心10 min,分离得到上清液和β-A@LCNPs沉淀。吸取上清液,按照“2.2.1”项色谱条件检测分析上清液中游离的β-细辛醚含量,测定游离β-细辛醚质量(fd);取下层沉淀,采用冷冻干燥法将其干燥得β-A@LCNPs,并精密称定,得纳米粒总质量(LCNPs)。根据公式(1)、(2)分别计算β-A@LCNPs包封率和载药量。
包封率=(td-fd)/td(1)
载药量=(td-fd)/LCNPs(2)
2.3.2 稳定性常数(e)的测定 采用离心-可见光分光光度法测定β-A@LCNPs的e。具体测定方法为量取β-A@LCNPs,检测波长450 nm,采用可见光分光光度法测定其浊度为0;900×离心30 min,吸取上层液,可见光分光光度法同波长测定离心后上层液的浊度为,根据公式(3)计算e。
e=(0-)/0(3)
2.3.3 归一化总评值()计算[16]综合考量β-A@LCNPs的包封率、载药量及e值,作为制剂质量评价因素,因而采用Derringer’s法将包封率、载药量和e转换为值。根据Hassan法分别求Partial期望值(d),其中包封率及载药量值越大,表示β-A@LCNPs质量越好,而e值越小,则说明β-A@LCNPs质量越好,根据公式(4)分别将包封率及载药量归一化为Partial期望值,记为1、2;根据公式(5)将e归一化为Partial期望值,记为3,再根据公式(6)将1、2、3转化为值。
d=(x-)/(-) (4)
d=(-x)/(-) (5)
=(123)1/3(6)
为响应值中的最小值,为响应值中的最大值,d为每个因素Partial期望值,x为参数实测值
2.4 单因素法考察β-A@LCNPs制备工艺及处方
经前期预试验,采用Bottom-up法制备β-A@ LCNPs,以载药量、包封率及e的值为β-A@ LCNPs质量评价指标,保持其他条件等同,考察单个因素变化对值的影响,初选工艺及处方。
2.4.1 搅拌时间考察 采用Bottom-up法制备β-A@LCNPs,取β-细辛醚20 mg滴加无水乙醇至完全溶解,加入装有0.20 g GMO的烧杯中,水浴至60 ℃,作为A相;称取20 mg PVA加入装有40 mL蒸馏水中水浴至60 ℃,使PVA完全溶解,作为B相;将A相缓慢倒入B相中,重复上述操作,平行制备5份样品,备用;60 ℃恒温条件下,以1000 r/min匀速搅拌,分别搅拌0.5、1.0、1.5、2.0、2.5 h,考察不同搅拌时间对制备β-A@LCNPs值的影响。测定各样品包封率、载药量、e值,并计算值,结果见表1。可知,搅拌时间在1.5 h内,随着搅拌时间增长,β-A@LCNPs的值增加,当搅拌时间超过1.5 h,β-A@LCNPs的值反而呈下降趋势,这可能由于搅拌时间过长,搅拌剪切力破坏已形成纳米粒的系统结构,致使药物溶出,载药量及包封率下降,因此,选择搅拌时间1.5 h。

表1 搅拌时间对包封率、载药量、Ke和D值的影响
2.4.2 搅拌速率考察 参照“2.3.1”项方法平行配置5份β-A@LCNPs悬浊液,60 ℃恒温条件下,分别以500、800、1000、1200、1500 r/min不同搅拌速度,搅拌1.5 h,考察不同搅拌速度对制备β-A@LCNPs值的影响。测定各样品包封率、载药量、e值,并计算值,结果见表2。可知,搅拌速度在1000 r/min内,随着搅拌速度增加,β-A@LCNPs的值增加,当搅拌速度超过1000 r/min时,β-A@LCNPs的值反而呈下降趋势,这可能由于搅拌速度小,纳米粒子不容易分散开,易沉;而速度过快,纳米粒子间碰撞加剧,粒子聚集而析出,值较小,因此,选择搅拌速度1000 r/min。

表2 搅拌速率对包封率、载药量、Ke、D值的影响
2.4.3 超声功率考察 参照“2.3.1”项方法平行配置5份β-A@LCNPs悬浊液,60 ℃恒温条件下,1000 r/min转速,匀速搅拌1.5 h,而后分别置于细胞超声仪,分别以100、150、200、250、300 W超声处理10次,每次5 s,间隔10 s,测定各样品包封率、载药量、e,并计算值,结果见表3。可知,超声功率对样品的值影响较大,当超声功率>200 W时,随着超声功率的增加,包封率及载药量下降,值减小,这可能由于超声功率过大对纳米粒子结构造成破坏,因而确定超声功率为200 W。

表3 超声功率对包封率、载药量、Ke和D值的影响
2.4.4 超声次数考察 参照“2.3.1”项方法平行配置5份β-A@LCNPs悬浊液,60 ℃恒温条件下,1000 r/min转速,匀速搅拌1.5 h,而后分别置于细胞超声仪,设定超声功率为200 W,分别超声5、10、15、20、25次,每次5 s,间隔10 s,测定各样品包封率、载药量、e,并计算值,结果见表4。可知,当超声次数超过15次时,β-A@LCNPs的值减小,说明超声次数过多导致晶型发生改变,药物渗漏,包封率下降,载药量下降。所以,综合考虑选择超声次数为15次。

表4 超声次数对包封率、载药量、Ke和D值的影响
2.4.5 GMO用量考察 参照“2.3.1”项方法平行配置GMO量分别为0.15、0.20、0.25、0.30、0.35 g,其余各量等同(PVA 20 mg、β-细辛醚20 mg、水40 mL)β-A@LCNPs悬浊液,60 ℃恒温条件下,1000 r/min转速,匀速搅拌1.5 h,而后置细胞超声仪,200 W,超声15次,每次5 s,间隔10 s,测定各样品包封率、载药量、e值,并计算值,结果见表5。可知,GMO加入量对该载药系统的值具有明显影响,当GMO用量为0.25 g时,值最大,这与GMO用量对纳米粒子结构稳定有关,需进一步优选用量。
2.4.6 投药量考察 保持其他条件等同(GMO 0.25 g、PVA 20 mg、水40 mL),分别配置不同投药量(10、15、20、25、30 mg),同等制备工艺(参照“2.3.5”项),制备β-A@LCNPs,分别测定各样品包封率、载药量、e值,并计算值,结果见表6。可知,投药量<20 mg,随着投药量增加值增大,当投药量>20 mg,随着投药量增加值减小,说明投药量对β-A@LCNPs制备的值有较大影响,需做进一步考察优化。

表5 GMO用量对包封率、载药量、Ke和D值的影响

表6 投药量对包封率、载药量、Ke和D值的影响
2.4.7 稳定剂种类筛选 保持其它条件等同(GMO 0.25 g、β-细辛醚20 mg、水40 mL),分别称取你20 mg不同稳定剂(F127、PVA150、PVA),同等制备工艺(参照“2.3.5”项),制备β-A@LCNPs,分别测定各样品包封率、载药量、e值,并计算值,结果见表7。可知,PVA作稳定剂时,包封率、载药量、e及值最大,故选择PVA作为β-细辛醚LCNPs载药系统稳定剂。
2.4.8 稳定剂PVA用量考察 保持其他条件等同(GMO 0.25 g、β-细辛醚20 mg、水40 mL),分别称取不同剂量PVA(10、15、20、25、30 mg),同等制备工艺(参照“2.3.5”项),制备β-A@LCNPs,分别测定各样品包封率、载药量、e值,并计算值,结果见表8。可知,投药量<20 mg,随着投药量增加值增大,当投药量>20 mg,随着投药量增加值减小,说明说明PVA在一定范围内可以参与脂质立方液晶结构的组装并能支撑整个骨架,但是当用量超过20 mg,其又可能会导致结构的破坏或者晶型结构的转变,导致包封率、载药量、e及值下降,需做进一步考察优化。

表7 不同稳定剂对包封率、载药量、Ke和D值的影响

表8 PVA用量对包封率、载药量、Ke和D值的影响
2.4.9 分散相水量考察 保持其它条件等同(GMO 0.25 g、PVA 20 mg、β-细辛醚20 mg),分别量取不同体积分散水相(20、30、40、50、60 mL),同等制备工艺(参照“2.3.5”项),制备β-A@LCNPs,分别测定各样品包封率、载药量、e值,并计算值,结果见表9。可知,随着水相体积增加,该递释系统值增加,当水相体积>30 mL时,值几乎不变。原因可能当水含量少,β-A@LCNPs的浓度大,纳米粒易相互黏合,药物易析出;水相体积大,纳米粒能较好的分散,不聚集,载药量、包封率较高,e较小,值变大。考虑该载药系统的药物浓度,需对水相用量进一步优选。
2.5 星点设计响应面法优化β-A@LCNPs处方
通过单因素法考察发现GMO量、β-细辛醚量、PVA量及水相对β-A@LCNPs质量综合评分影响较大,并采用星点设计响应面法对β-A@LCNPs处方进一步优化。
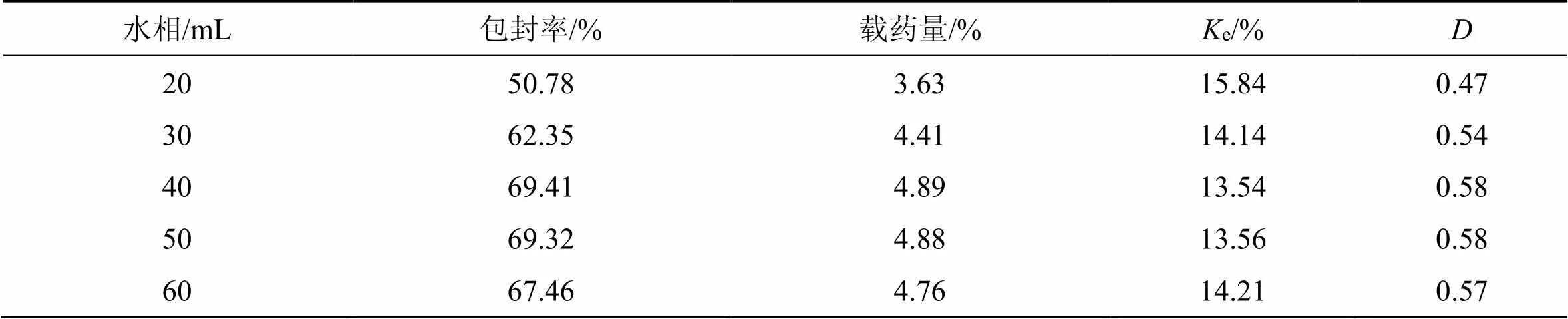
表9 分散相水量对包封率、载药量、Ke和D值的影响
2.5.1 试验设计 选取GMO量(1)、β-细辛醚量(2)、PVA量(3)、水相(4)4个因素作为自变量,每个因素设5水平,用代码值−、−1、0、+1、+来表示(4因素星点设计的=1.682)。代码值所代表的实际操作物理量见因素水平表10。分别测定各试验样品的包封率、载药量和e,参照“2.2.3”项下方法,计算值,作为β-A@LCNPs综合评价考察指标,采用星点设计优化处方,试验安排及结果见表10。

表10 星点设计试验安排及结果
2.5.2 模型拟合 将所得数据用Design-Expert 8.0.5b软件进行响应面试验分析[17],以各考察指标的值为响应值,对各因素进行多元线性回归和二项式拟合。多元线性回归方程=0.71-0.009 51-0.032-0.0433+0.007 74,=0.245 1,>0.05;二项式拟合方程=0.0121-0.0072-0.0433+0.0234+0.02612+0.09413+0.03814+0.02323-0.01824-0.0234-0.002 812+0.008 722-0.02632-0.08842,=0.997 5,<0.01。
从拟合方程的相关系数可见,多元线性回归方程的相关系数较低,表示自变量与因变量之间线性相关性较差,可见多元线性回归拟合度不佳,预测性较差,因此该数学模型不合适。而多元二项式拟合方程相关系数较高,拟合效果较好。其中,1、2、3、4、12、22、32及42项为4因素对指标的单独作用,而12、23、13、24、14和34项为因素的交互作用,方程从整体上反映了各因素及其相互作用对指标值的影响。
2.5.3 方差分析 采用ANOVA分析响应面的回归参数。表11中统计分析数据显示给出了线性项、二次项、以及交互项对各考察指标综合得分的影响,其中GMO量(1)、PVA量(3),对响应值(综合评分值)的曲面效应显著(<0.05);GMO量(1)与PVA量(3)的交互项(13)、水量的二次项(42)对响应值(值)的曲面效应极显著(<0.01);在所选取的各因素水平范围内,按照对响应值(值)的影响排序:PVA量(3)>GMO量(1)>水(4)>β-细辛醚(2)。二项式回归方程失拟检验不显著,说明未知因素对试验结果干扰很小。拟合检验极显著,说明该方程与实际情况拟合很好,较好地反应了β-A@LCNPs综合得分(值)与GMO、β-细辛醚、PVA、水不同配方用量的关系,可以对条件范围内不同配方的β-A@LCNPs进行质量评价(综合评分值)进行预测。
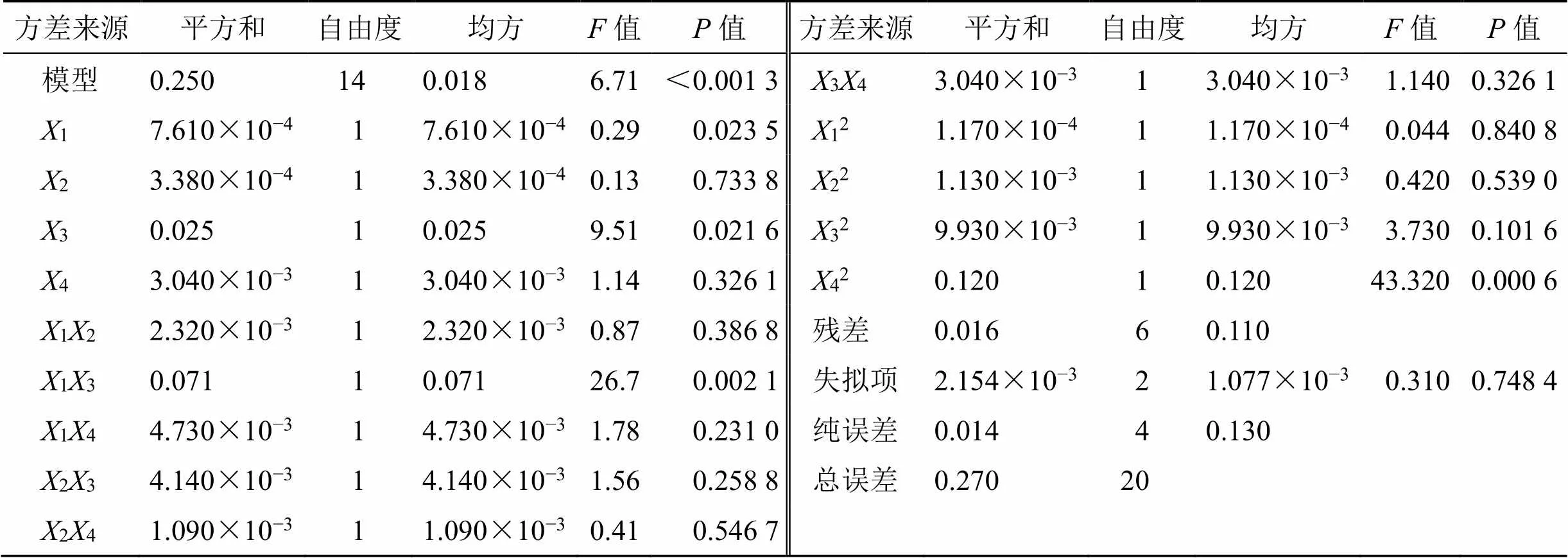
表11 响应面二次模型的方差分析结果
2.5.4 响应面优化、预测与验证 根据二次多项式模型,应用Design-Expert 8.0.5b软件绘制各考察指标综合得分与各自变量间的三维响应曲面图及等高线图,结果见图2。
结合二次回归模型进行预测分析,β-A@LCNPs值最大值为0.745 5,此时最优处方GMO 300 mg、β-细辛醚20 mg、PVA 25 mg、水40 mL。

图2 各因素间对β-A@LCNPs D值的影响
按最优处方,配制3份β-A@LCNPs,对每份样品进行质量综合评价得分进行实验验证,结果β-A@LCNPs包封率平均值为90.78%、载药量平均值为5.31%、e平均值为7.21%,值平均为0.72,实际值与预测值相比偏差率为−2.91%,RSD为1.36%,表明所建立的数学模型具有良好的预测性,所选处方重现性好,工艺稳定。
2.6 β-A@LCNPs粒径分布测试
按β-A@LCNPs最优处方及工艺平行制备3份样品,用蒸馏水稀释10倍,分别测定其粒径分布,结果显示,β-A@LCNPs粒径分布成正态分布,平均粒径为(85.28±3.26)nm,多分散系数(PDI)为0.190±0.003。
2.7 β-A@LCNPs TEM观察
按β-A@LCNPs最优处方及工艺制备β-A@ LCNPs样品,稀释100倍,滴在样品台上,放置于干燥皿中自然干燥。样品干燥后放入离子溅射仪中镀金膜,再将样品置于透射电镜中观察[18],结果见图3。由图3可见,β-A@LCNPs在水中分散较好,且粒径大小差异较小。通过放大电镜倍数发现,β-A@LCNPs为立方体结构,外观完整,且存在空间结构堆积。

图3 β-A@LCNPs的TEM图
2.8 体外经皮渗透考察
分别配制相同药物浓度(载药量5.31%)的β-A@LCNPs(按最优处方与制备工艺制备)与β-细辛醚乳液(精密称取20 mg β-细辛醚,滴加无水乙醇至完全溶解,再加入10 mL聚氧乙烯蓖麻油,搅拌均匀,而后逐滴加入30 mL蒸馏水,边滴边搅拌均匀,即得[19])进行体外经皮渗透考察。
取β-A@LCNPs和β-细辛醚乳液各5 mL,分别加入Franz扩散池[20],渗透膜为小鼠腹部脱毛全皮,所用鼠皮的厚度均一,有效扩散面积为4.50 cm2,接收池体积为18 mL,接收介质为32 ℃生理盐水,200 r/min匀速磁力搅拌,以β-细辛醚为考察指标,分别于1、2、4、6、8、10、12 h抽取5 mL接收液(同时补加5 mL空白接收液),过0.45 μm微孔,参照“2.2.1”项下方法,测定接收液中β-细辛醚含量,以上试验,β-A@LCNPs和普通乳分别平行做3组试验,取均值,绘制渗透曲线,拟合参数,得药物体外经皮渗透动力学曲线方程见表12,通过比较体外经皮渗透动力学参数稳态透皮速率(s)和单位面积累积渗透量(Q),可以看出β-A@LCNPs较β-细辛醚乳液透皮速率提升了3倍,制剂透皮性能得到显著提升。
Q=C/
s=d/d
C=C+0/ps
C为时间药物的校正质量浓度,C为时间药物的测定质量浓度,ps为时前药物的测定质量浓度,0为每次取样体积,为接收液的总体积,Q为时间单位面积累积渗透量,为有效扩散面积
3 讨论
本研究采用Bottom-up法将模型药物β-细辛醚制备为LCNPs载药体系,通过单因素方法分别考察搅拌时间、搅拌速率、超声功率、超声次数、对β-A@LCNPs制备工艺进行考察优化,确立最佳制备工艺。并在单因素考察处方剂量对β-A@LCNPs质量影响的基础上,采用星点设计响应面法,以β-A@LCNPs各组分为考察因素,结合Design-Expert 4因素5水平设计安排试验,以β-A@LCNPs质量综合评分(值)为评价指标,优选出最佳β-A@LCNPs处方,优选的β-A@LCNPs制备工艺、处方稳定可行。

表12 β-A@LCNPs与β-细辛醚乳液体外经皮渗透动力学参数(n = 3)
目前国内多采用绘制三元相图液晶区筛选立方液晶处方,但往往存在可选择区域范围广,考察指标相对主观,最终确立的处方多是预设的考察参数优选,无法动态连续筛选指标,精确度不高。本实验LCNPs最佳处方筛选,在单因素考察指标参数范围的基础上,采用星点设计响应面法,各因素对效应的影响并非线性,且考虑到多因素间的交互作用,区别于线性设计的正交设计或均匀设计筛选处方,星点设计通过多次试验结果参数进行模型拟合优化,找到拟合度最佳方程,指标参数具有连续性,多元高次方程综合考量单因素及因素间的协同效应,推算出最佳配方,验证及重复性好,工艺稳定。星点设计响应面法筛选立方液晶处方,预测指导性更强,具有较好的推广应用价值,为β-A@LCNPs制备工艺提供了科学、合理的理论和实验依据。
立方液晶载药系统制备方法有热融法、喷雾干燥法、Top-down法、Bottom-up法,其中热融法、喷雾干燥法所需温度高,对温度敏感性药物不适宜[21],Top-down法在制备过程需要更高能量,系统温度高,纳米粒在高温条件下容易碰撞引起絮凝[3],本文选用Bottom-up法加入有机溶剂有助β-细辛醚溶解,制备方法简单,制备工艺稳定可靠,制备的β-A@LCNPs质量以包封率、载药量、稳定性为评价指标的综合评分高、质量好。
利益冲突 所有作者均声明不存在利益冲突
[1] 阮世发, 乡世健, 洪军辉, 等. 积雪草苷立方液晶制备工艺与含量测定方法研究 [J]. 辽宁中医药大学学报, 2017, 19(6): 54-56.
[2] 李绍林. 脂质立方液晶纳米粒载药系统的研究进展 [J]. 现代医药卫生, 2020, 36(20): 3261-3264.
[3] 芶子杰, 邓盛齐, 陶静, 等. 适于规模放大的姜黄素脂质立方液晶制备工艺探讨 [J]. 中国新药杂志, 2017, 26(8): 946-951.
[4] 杨杰, 田兰, 柴东坤, 等. 脂质立方液晶作为药物载体的靶向作用研究进展 [J]. 中国兽药杂志, 2019, 53(7): 79-85.
[5] 田勇, 李见春, 李婷婷, 等. 富马酸喹硫平脂质立方液晶制备工艺研究 [J]. 中国药业, 2020, 29(17): 25-28.
[6] 刘丽丽, 史畑女, 方蕾, 等. 马钱子总碱-白芍总苷脂质立方液晶纳米粒制备及体外评价 [J]. 中草药, 2019, 50(17): 4076-4083.
[7] 单倩倩, 蒋晓静, 桂双英,等.雷公藤甲素立方液晶的制备及体外评价. 中国药学杂志, 2019, 54(9): 726-733.
[8] 岳鹏飞, 刘阳, 谢锦, 等. 药物纳米晶体制备技术30年发展回顾与展望 [J]. 药学学报, 2018, 53(4): 529-537.
[9] 郝秀华, 孙悦, 王蕾, 等. 星点设计优化野黄芩素制备工艺 [J]. 特产研究, 2019, 41(2): 6-10.
[10] 房盛楠. 盐酸普萘洛尔立方液晶凝胶的制备与评价 [D]. 福州: 福建医科大学, 2017.
[11] 王清清, 陈明龙, 胡霞, 等. 马来酸噻吗洛尔立方液晶纳米粒眼用制剂的制备和表征 [J]. 药学学报, 2018, 53(11): 1894-1900.
[12] 徐玲霞, 冯文珍, 申宝德, 等. 吴茱萸次碱脂质立方液晶纳米粒包封率的测定方法研究 [J]. 中华中医药杂志, 2018, 33(10): 4373-4376.
[13] 杨雪鸥, 唐智勇, 黄雪梅, 等. 石菖蒲β-细辛醚研究进展 [J]. 中药材, 2016, 39(3): 686-690.
[14] 兰烨荣, 刘素香, 张铁军, 等. 细辛醚的研究进展 [J]. 现代药物与临床, 2013, 28(2): 252-257.
[15] 刘春玲, 侯广玉, 孙艳, 等. β-细辛醚对AD大鼠海马神经元蛋白质组图谱的影响 [J]. 全科口腔医学电子杂志, 2019, 6(24): 187-188.
[16] Sug H. A method for normalization of relation schema based on data to abide by the third normal form [J]., 2020, 19(8): 216-225.
[17] 祝露佳, 陈礼迎, 郑爽, 等. 星点设计-效应面法优化银杏内酯B纳米冻干制剂的制备工艺及其体外释放研究[J]. 中草药, 2019, 50(22): 5439-5447.
[18] 唐明华, 郭军, 陈木子. 透射电镜三维重构确定金纳米粒子的立体结构 [J]. 分析科学学报, 2017, 33(4): 499-502.
[19] 赵瑛, 王莉. β-细辛醚鼻用微乳凝胶的制备及其释放度考察 [J]. 抗感染药学, 2019, 16(5): 743-747.
[20] 周刚, 付晓婷, 潘静茹, 等. 他克莫司软膏透皮一致性的体外Franz扩散池测定比较研究 [J]. 药物分析杂志, 2020, 40(12): 2126-2133.
[21] 曾令军, 房盛楠, 张灵娜, 等. 盐酸普萘洛尔立方液晶纳米粒的制备及体外评价[J]. 中国药师, 2020, 23(6): 1094-1101.
Bottom-up preparation process optimization and prescription screening for β-asarone lipid cubic liquid crystal nanoparticles
LI Shao-lin, DUAN Qi, ZHAO Zhen-dong, SHEN Xiao-zhong, XIA Li, PAN Ying-shan
Guang Dong Food and Drug Vocational College, Guangzhou 510520, China
To prepare β-asarone lipid cubic liquid crystal nanoparticles (β-A@LCNPs) drug delivery system with β-asarone as model drug.The quality of β-A@LCNPs was evaluated by the normalized comprehensive score of encapsulation rate, drug loading capacity and stability constant. The preparation process of cubic liquid crystal was investigated by single factor, and the process parameters were optimized. The optimal formulation of β-A@LCNPs was optimized by response surface method of centroid design.The optimal preparation process parameters of β-A@LCNPs were as follows: Bottom-up method, 60 ℃, β-A@LCNPs suspension was prepared, then 1000 r/min uniform stirring for 1.5 h, finally placed in the cell ultrasound instrument, 200 watt ultrasonic power, ultrasonic 15 times, 5 s each time, 10 s interval; The optimal prescription for β-A@LCNPs was glycerin monoleate 300 mg, β-asarone 20 mg, polyvinyl alcohol 27000 25 mg and water 40 mL.The preparation process of β-A@LCNPs is simple, easy to perform and has good repeatability. The β-A@LCNPs were homogeneous and stable.
β-asarone; lipid cubic liquid crystal; response surface method; nanoparticles; Bottom-up method; encapsulation rate; drug loading capacity; stability constant
R283.6
A
0253 - 2670(2021)24 - 7464 - 09
10.7501/j.issn.0253-2670.2021.24.008
2021-07-31
广东省教育厅自然科学基金项目(2017GKQNCX037);广州市科技计划项目(202102080588);广东省医学基金项目(B2021236);广东省中医药局项目(20211280)
李绍林(1983—),男,博士,主要从事中药新药与新技术研究。Tel: (020)28854910 E-mail: lisl@gdyzy.edu.cn
段 启(1969—),男,教授,主要从事中药制剂与炮制研究。Tel: (020)28854910 E-mail: duanq@gdyzy.edu.cn
[责任编辑 郑礼胜]
