多孔竹炭负载SnO2的制备及其电化学性能研究
2021-12-16陈前林李翠芹
吴 洪,陈前林,李翠芹
(贵州大学化学与化工学院,贵阳 550025)
0 引 言
众多能量储存装置中,锂离子电池具有工作电压高、能量密度高、使用寿命长、安全性能高和绿色环保等优点,已经在电脑、手机、手表和新能源汽车等领域广泛应用[1-2]。作为传统锂离子电池的负极材料,石墨因为理论容量低(372 mAh·g-1)和倍率性能差已经不能满足快速发展的市场需求[3-4]。锡基材料具有比容量高(Sn: 994 mAh·g-1;SnO: 875 mAh·g-1;SnO2: 782 mAh·g-1)、脱/嵌锂电位低(0.6 V)、资源丰富和绿色环保等优点,因此,有望替代石墨用作锂离子电池负极材料[5-7]。但是,锡基材料在充放电过程中体积会发生巨大的体积变化,导致锡基电极材料粉碎脱落,致使电池的比容量急剧衰减,循环稳定性差[8]。
为了解决上述问题,研究者们使用碳与锡基材料进行复合来改善其循环稳定性能[9-10]。例如,Wen等[11]制备了SnO2/Graphene复合材料,其中石墨烯可以缓冲SnO2充放电过程中体积变化,从而提高SnO2的循环稳定性。其次引入B2O3能有效缓冲SnO2的体积变化和改善其电化学性能,这是由于硼离子具有可以接受电子和释放电子的性质,从而增加电子的密度,提高电池的循环稳定性[12]。在众多炭材料中,生物质炭具有资源丰富、价格低廉、环境友好、结构稳定、孔隙度高、物理化学性质容易调控等特点,非常受研究者们青睐,例苎麻[13]、丝瓜瓤[14]、稻谷壳[15]、香蕉皮[16]和坚果壳[17]等生物质炭作为锂离子电池负极材料时,具有高的比容量和循环稳定性。竹子生长周期短,原材料易获取,竹炭制备过程简单,且竹炭具有丰富的孔结构和高的比表面积,因此受到研究者们广泛的关注。例如,Han等[18]以竹炭纤维为基材,采用葡萄糖包覆SnO2,制备了BCF/SnO2/C复合材料,竹炭纤维和碳包覆缓解了SnO2的体积变化,提高了SnO2的循环稳定性。
本文以多孔竹炭为载体,结晶四氯化锡为锡源,硼酸为硼源,采用溶胶-凝胶法成功制得B2O3-SnO2/C复合材料,竹炭具有高的比表面积,丰富的孔结构和官能团,可以使SnO2和B2O3均匀分布在竹炭表面上,缓解SnO2充放电过程中体积变化,同时提高SnO2导电性和循环稳定性;而B2O3的加入可以缓冲SnO2的体积变化和提高放电比容量。B2O3-SnO2/C复合材料制备过程简单,为制备高放电比容量、良好循环稳定性的电极材料提供一定的参考。
1 实 验
1.1 多孔竹炭的制备
竹子取于遵义,清洗干净,然后使用粉碎机(上海顶帅电器有限公司,LD-Y400)将竹子粉碎成竹粉,并移入80 ℃的鼓风烘箱中干燥24 h。球磨罐中加入40 mL超纯水和30 g氢氧化钾(Macklin,AR),搅拌均匀后,再加入30 g竹粉。湿法球磨12 h后(转速:300 r/min),取出并放入80 ℃鼓风烘箱中干燥30 h。然后在管式炉中,氮气气氛下进行热处理,升温(5 ℃/min)至300 ℃,保温2 h后继续加热至800 ℃,保温3 h,自然冷却后取出产物,加入到2 mol/L HCl溶液中,60 ℃下水浴回流24 h后,抽滤并使用超纯水洗涤至中性,所得滤饼放入到80 ℃鼓风烘箱中干燥12 h,得到多孔竹炭。
1.2 B2O3-SnO2/C复合材料的制备
茄形瓶中加入600 mg多孔竹炭、60 mL超纯水,超声分散30 min后,加入2.1 g结晶四氯化锡(SnCl4·5H2O),在40 ℃水浴条件磁力搅拌12 h后,再加入0.27 g硼酸,继续搅拌24 h,过滤得到固体产物,产物移入80 ℃鼓风烘箱中干燥12 h。随后在管式炉中,升温(5 ℃/min)至500 ℃,氩气气氛下保温1 h,再降温至420 ℃,空气环境下继续保温1 h,自然冷却得到B2O3-SnO2/C复合材料。
1.3 电极片的制备及电池组装
按质量比8 ∶1 ∶1均匀混合B2O3-SnO2/C、导电炭黑(乙炔黑)和聚偏氟乙烯(粘结剂),然后加入N-甲基吡咯烷酮(NMP),搅拌8 h后均匀涂覆在铜箔集流体上;将涂覆好的铜箔置于80 ℃真空烘箱中干燥12 h,去除NMP,然后切成直径为14 mm的电极圆片。电池的组装:以锂片为对电极,聚丙烯微孔膜Celgard2400为隔膜,电解液为1 mol/L LiPF6(v(EC) ∶v(DMC)=1 ∶1)。在充满氩气的手套箱中成功组装纽扣半电池(CR2430),静置12 h后进行电化学性能测试。采用商业纳米SnO2(Macklin, 50~70 nm)制备电极片,其他实验操作步骤与上述一致。
1.4 电极材料的结构与形貌表征
使用德国的BRUKER D8 ADVANCE型X射线(XRD)粉末衍射仪, Cu靶Kα射线λ=0.154 06 nm条件下分析样品的物相,扫描速率为10 (°)/min,扫描范围10°~80°。使用美国的Thermo DXR2xi型拉曼光谱仪,在532 nm激发波长对样品进行拉曼光谱测试分析。用德国蔡司的ΣIGMA+X-Max20型扫描电子显微镜(SEM)和美国FEI公司的FEI Tecnai G2 F20型透射电子显微镜(TEM)观察样品的表面形貌和微观结构。使用美国NOVA-1000型自动气体吸附仪对样品的表面积和孔结构进行测试,脱气温度120 ℃,脱气时间6 h,77 K条件下进行测试,使用Brunauer-Emett-Teller(BET)法计算比表面积。使用美国的Thermo SCIENTIFIC ESCALAB 250Xi型X射线光电子能谱法(XPS)测定样品表面的元素含量和化学状态,其激发源为Al Kα射线,束斑为400 μm,分析室真空度优于5.0×10-7mBar,工作电压为12 kV,灯丝电流为6 mA,全谱扫描时,能量为100 eV,步长1 eV。
1.5 电化学性能测试
采用蓝电测试系统(CT3001A)在室温下进行恒流充放电测试。充放电电压范围为0.01~3 V,在0.25 C、0.5 C、1 C和2 C倍率下进行恒电流充放电测试。使用上海辰华CHI760E电化学工作站进行循环伏安(cyclic voltammetry, CV)曲线的测试,其扫描电压范围为0.01~3 V,扫描速率为0.2 mV/s、0.4 mV/s、0.6 mV/s、0.8 mV/s和1 mV/s;在开路电压下进行交流阻抗(EIS)的测试,测试频率范围为0.01~105Hz,振幅为5 mV。
2 结果与讨论
2.1 结构与形貌表征
图1(a)为多孔竹炭、SnO2、SnO2/C和B2O3-SnO2/C材料的XRD谱。多孔竹炭的XRD谱中2θ大约在24.6°和44.5°处出现两个衍射宽峰,分别对应石墨炭材料的(002)和(100)晶面,表明多孔竹炭为无定形碳,且无定形结构利于锂离子的嵌入/脱出[19]。对于SnO2、SnO2/C和B2O3-SnO2/C材料,根据SnO2四方金红石结构(JCPDS No.41-1445),在2θ=26.6°、33.9°、37.9°、51.8°和65.9°处对可以清晰观察到SnO2的特征峰,对应于SnO2的(110)、(101)、(200)、(211)和(301)晶面,证实SnO2的存在。SnO2分布在多孔竹炭表面,其衍射峰掩盖了竹炭的衍射峰,导致多孔竹炭的非晶峰不明显[9,20]。由于B2O3是非晶相,在B2O3-SnO2/C复合材料的XRD谱中没有观察到B2O3的衍射峰。根据SnO2-B2O3/C复合材料的XPS能谱表征分析表明,B 1s(原子数分数为3.5%)的结合能为193.37 eV(图1(c)所示),证实B2O3的存在[21]。图1(b)为SnO2/C和B2O3-SnO2/C复合材料的拉曼光谱,在约1 342 cm-1(称为D谱带)和1 597 cm-1(称为G谱带)处出现两个峰,D谱带代表炭材料的无序结构或缺陷,G谱带代表有序结构炭[22]。通常采用ID/IG的强度来衡量材料的无序程度,SnO2/C与SnO2-B2O3/C复合材料的ID/IG值分别为0.75和0.94,表明SnO2-B2O3/C复合材料的结构无序程度增加,这可能是非晶相B2O3引起无序度增加,表明SnO2和B2O3材料已负载于多孔竹炭表面[11]。图1(d)显示了Sn 3d的高分辨光谱(原子数分数为9.9%),在487.9 eV和496.3 eV处衍射峰归属于Sn4+的Sn 3d5/2和Sn 3d3/2的特征峰[23]。图1(e)中O1s的高分辨光谱(原子数分数为26.8%),在531.5 eV处的Sn—O键,532.1 eV处的Sn—O—C键,533.2 eV处C—O—C键和Sn—O—C键的存在表明SnO2晶体通过C—O基团与炭基体结合,保证了SnO2颗粒均匀稳定地分散在多孔竹炭表面[24]。图1(f)中C 1s的高分辨光谱(原子数分数为59.8%)284.8 eV和287.8 eV分别对应C—C键和C—O键的特征峰[25]。
图2(a)显示了纳米SnO2的扫描电镜照片,可以观察到大量SnO2颗粒的分布;图2(b)显示了竹炭的多孔结构有利于SnO2和B2O3负载在多孔竹炭表面。图2(c)和图2(d)分别为SnO2/C和B2O3-SnO2/C复合材料的扫描电镜照片,可以看到SnO2和B2O3负载在竹炭上并且竹炭的微观结构没有变化。图2(e)、(f)分别为多孔竹炭和B2O3-SnO2/C复合材料的透射电镜照片,图2(g)为B2O3-SnO2/C复合材料的高倍透射电镜(HRTEM)照片,从图中观察出SnO2颗粒大小均一性较好,SnO2周围存在无定形区域,表明非晶B2O3分布在SnO2周围[11]。同时观察到SnO2金红石结构的(110)晶面,测得其晶面间距为0.333 nm,表明形成了高度结晶的金红石相[26]。图2(h)~(l)为C、O、Sn和B的元素面扫图,从图中观察到Sn、B和O元素均匀分布在多孔竹炭表面,进一步表明SnO2和B2O3负载在多孔竹炭表面。
图3(a)为多孔竹炭、SnO2/C和B2O3-SnO2/C复合材料的氮气吸附-脱吸等温线,两种复合材料的等温线属于典型的I和IV型等温线,表明多孔竹炭、SnO2/C和B2O3-SnO2/C复合材料同时存在微孔和中孔结构,其中孔结构允许电解质充分浸润和锂离子快速的扩散[27]。如图3(b)所示,多孔竹炭孔、SnO2/C复合材料和B2O3-SnO2/C复合材料的孔径分别分布在1~6 nm、1~4 nm和1~6 nm范围内。根据Brunauer-Emmett-Teller(BET)理论计算得到多孔竹炭,SnO2/C和B2O3-SnO2/C复合材料的比表面积分别为1 911 m2/g、1 424 m2/g和861 m2/g,孔容分别为1.21 cm3/g、0.63 cm3/g和0.45 cm3/g。这是由于SnO2和B2O3负载在竹炭表面,导致竹炭的比表面积和孔容降低。
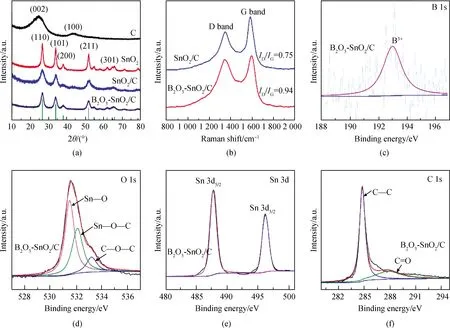
图1 (a)多孔竹炭、SnO2、SnO2/C、B2O3-SnO2/C材料的XRD谱;(b)SnO2/C、B2O3-SnO2/C材料的Raman图; B2O3-SnO2/C材料的XPS谱:(c)B 1s、(d)O 1s、(e)Sn 3d、(f)C 1sFig.1 (a) XRD patterns of porous bamboo charcoal, SnO2, SnO2/C, B2O3-SnO2/C materials; (b) Raman diagrams of SnO2/C, B2O3-SnO2/C materials; XPS patterns of B2O3-SnO2/C materials: (c) B 1s, (d) O 1s, (e) Sn 3d, (f) C 1s


图2 (a)纳米SnO2,(b)多孔竹炭,(c)SnO2/C复合材料,(d)B2O3-SnO2/C复合材料的SEM照片;(e)多孔竹炭, (f)B2O3-SnO2/C复合材料的TEM照片;(g)B2O3-SnO2/C复合材料的HRTEM照片;(h)~(l)C,O,Sn和B元素的面扫图Fig.2 SEM images of (a) nano-SnO2, (b) porous bamboo charcoal, (c) SnO2/C composite, (d) B2O3-SnO2/C composite; TEM images of (e) porous bamboo charcoal, (f) B2O3-SnO2/C composite; (g) HRTEM images of B2O3-SnO2/C composite; (h)~(l) elemental mapping of C, O, Sn and B
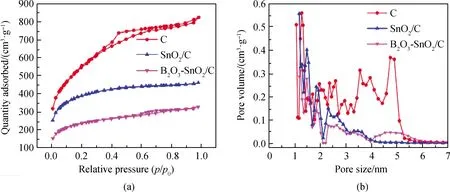
图3 多孔竹炭、SnO2/C和B2O3-SnO2/C复合材料的(a)氮气吸附-脱附等温线;(b)孔径尺寸分布Fig.3 (a) Nitrogen adsorption-desorption isotherm and (b) pore size distribution of porous bamboo charcoal, SnO2/C and B2O3-SnO2/C composite
2.2 电化学性能表征
图4(a)为B2O3-SnO2/C电极材料的CV曲线。由图可知,由于B2O3-SnO2/C电极材料首次循环发生副反应导致第1圈循环没有重合,第2、3圈重叠在一起,表明B2O3-SnO2/C电极材料具有良好的循环稳定性。在CV曲线中,0.4~1.25 V之间的还原峰表示SnO2被还原为Sn,同时形成Li2O(式(1))。同时,在这一反应过程中,Li+插入到多孔竹炭中形成LixC,如式(2)所示。在0.5~0.75 V之间的峰为Li+的嵌入和脱出如式(3)所示。在1.25~1.5 V之间的峰值归因于Li2O的可逆生成/分解和式(1)的部分可逆反应[12,28]。除了Sn以外没有其他峰出现,说明B2O3没有参与充放电过程。
SnO2+4Li++4e-→2Li2O+Sn
(1)
C+xLi++xe-↔LixC
(2)
Sn+xLi++xe-↔LixSn
(3)
2Li2O+Sn↔SnO2+4Li++4e-
(4)
图4(b)显示了B2O3-SnO2/C电极材料在0.01~3 V电压范围内,充放电倍率为0.25 C和1 C。从图4(b)中可以看出,在0.4~1.25 V之间第1次循环出现一个明显的平台,表示SnO2向Sn和Li2O的不可逆还原。虽然B2O3-SnO2/C电极材料首次放电比容量达到了2 747.1 mAh/g,但是库伦效率较低(50.05%),这是由于B2O3-SnO2/C电极表面形成固体电解质膜(SEI)层[29]和不可逆分解导致的。
图4(c)为SnO2、SnO2/C和B2O3-SnO2/C电极材料的充放电循环曲线,首先在0.25 C倍率下充放电循环3次,活化电极材料。SnO2电极材料倍率升高到0.5 C继续循环到60次,首次放电比容量为1 289.7 mAh/g,放电比容量连续下降,经过60次充放电循环后放电比容量衰减到153.9 mAh/g。纳米SnO2锂离子电池放电比容量衰减快,循环寿命短,归因于SnO2在充放电循环过程体积发生膨胀/收缩导致SnO2粉碎[30]。而SnO2/C电极材料放电比容量缓慢降低,经过200次循环之后,放电比容量为417.1 mAh/g,库伦效率为98.92%,相对于SnO2电极材料,多孔竹炭提高了SnO2/C电极材料的循环稳定性。B2O3-SnO2/C电极材料在1 C倍率下充放电循环40次后,放电比容量趋于平稳,经过200次循环后放电比容量几乎没有衰减,可逆的放电比容量为649.9 mAh/g,库伦效率为98.89%,容量保留率为58.6%。
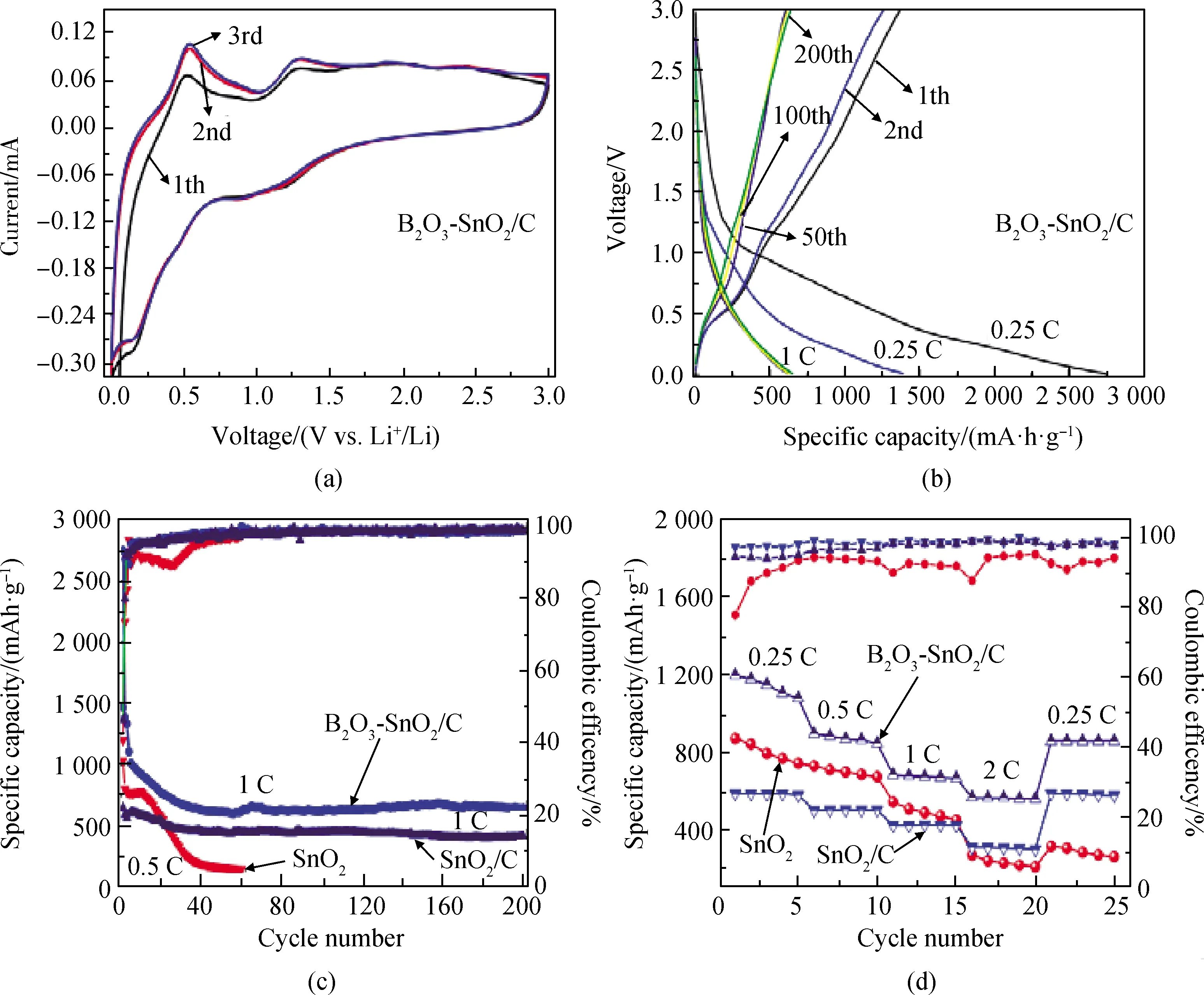
图4 (a)B2O3-SnO2/C复合材料的CV图;(b)B2O3-SnO2/C复合材料在第1次、2次、50次、100次、200次的充放电曲线; (c)材料SnO2、SnO2/C和B2O3-SnO2/C的充放电循环图;(d)倍率图Fig.4 (a) CV diagram of B2O3-SnO2/C composite; (b) charge and discharge curves of B2O3-SnO2/C composite at 1th, 2nd, 50th, 100th, and 200th cycles; (c) charge and discharge cycle diagram of material SnO2, SnO2/C, and B2O3-SnO2/C; (d) rate diagram
图4(d)评估了SnO2、SnO2/C和B2O3-SnO2/C电极材料在0.01~3 V之间充放电倍率性能,测试倍率分别为0.25 C、0.5 C、1 C和2 C,当恢复到0.25 C倍率时,B2O3-SnO2/C电极的比容量出现了衰减,这是由于循环过程中,氧化硼具有较低的电化学活性,从而导致容量衰减和恢复率变低[31]。并且在不同充放电倍率下,B2O3-SnO2/C电极材料的放电比容量要高于SnO2/C和SnO2电极材料(如表1所示),这归因于B2O3的电子缺陷性质,SnO2/C复合材料中引入B2O3后,硼原子可以接受电子,硼离子可以释放电子,从而增加电极材料的电子密度[26];另一个原因是硼离子占据了间隙位置并释放自由电子,导致自由电子密度增加[32],使得B2O3-SnO2/C复合材料的电子结构发生了改变,硼原子在锂离子嵌入过程中充当电子受体,因此更多的Li+可逆地嵌入到电极材料中,提高了B2O3-SnO2/C复合材料的放电比容量[33-35]。B2O3-SnO2/C复合材料显示出优异的循环稳定性,这归因于竹炭和B2O3的在充放电过程中缓冲了SnO2的体积变化,提高电极材料的循环稳定性[36]。

表1 SnO2、SnO2/C、B2O3-SnO2/C电极材料不同倍率下的放电比容量
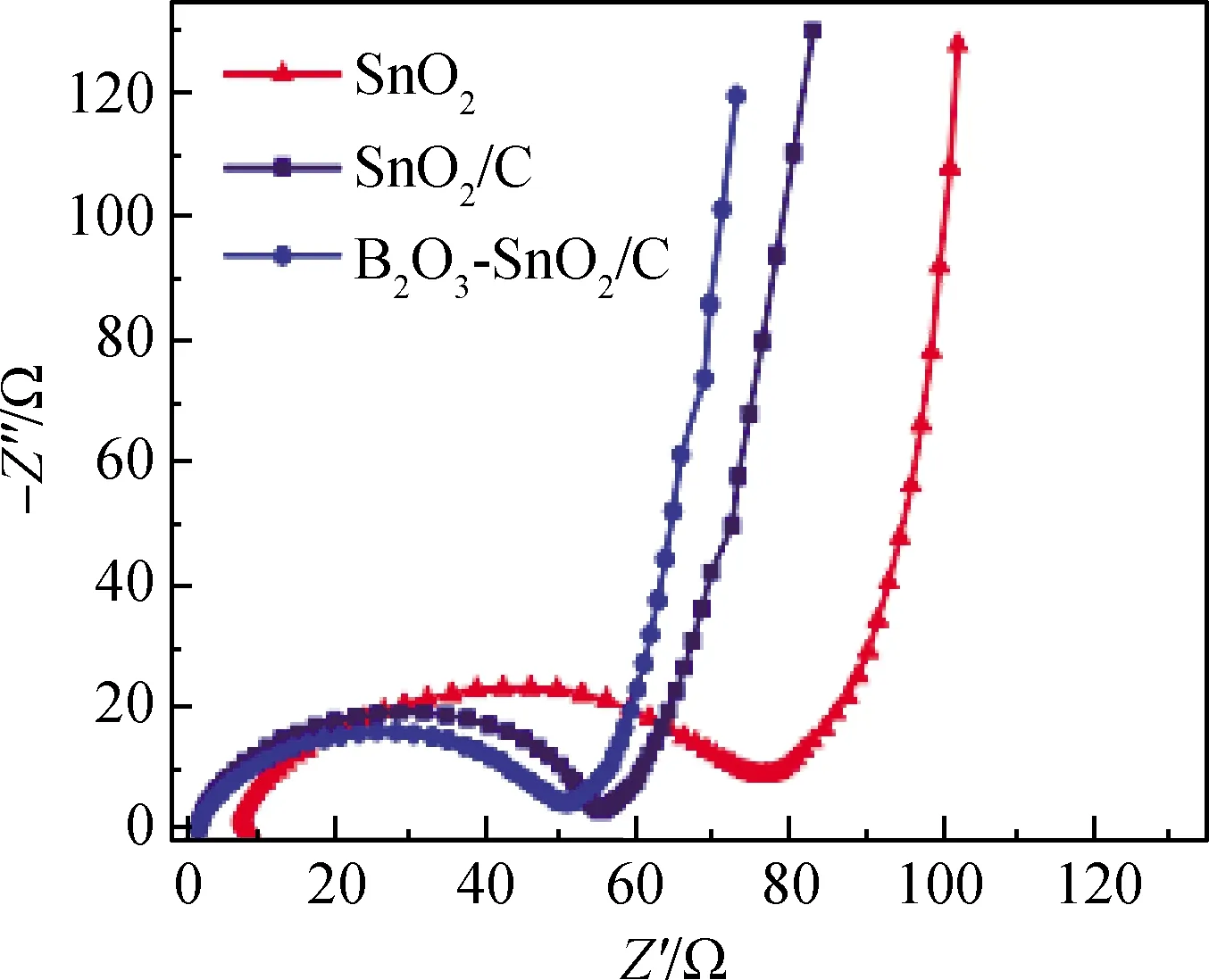
图5 SnO2、SnO2/C、B2O3-SnO2/C材料的 阻抗图谱(EIS)Fig.5 Impedance spectra (EIS) of SnO2, SnO2/C, B2O3-SnO2/C materials
图5为SnO2、SnO2/C和B2O3-SnO2/C电极材料的电化学阻抗曲线,谱图由一个半圆和倾斜直线组成。高频区的半圆表示电极/电解质界面之间的电荷转移电阻,低频区的倾斜直线归于Warburg阻抗。B2O3-SnO2/C电极材料的半圆直径小于SnO2和SnO2/C电极材料的半圆直径,表明B2O3-SnO2/C电极材料的电荷转移电阻较小,从而导致B2O3-SnO2/C电极材料具有较高的电化学活性,这归因于多孔竹炭和B2O3提高了复合材料的导电性。
为了进一步说明B2O3-SnO2/C多孔复合材料的充放电储存机理,分析了伪电容行为并计算了伪电容在储存电荷中的贡献率。图6(a)为0.2~1 mV/s不同扫描速率下的CV曲线,这些CV曲线表现出相似的电化学行为,揭示了B2O3-SnO2/C多孔复合材料在充放电过程出色的Li+扩散动力学。
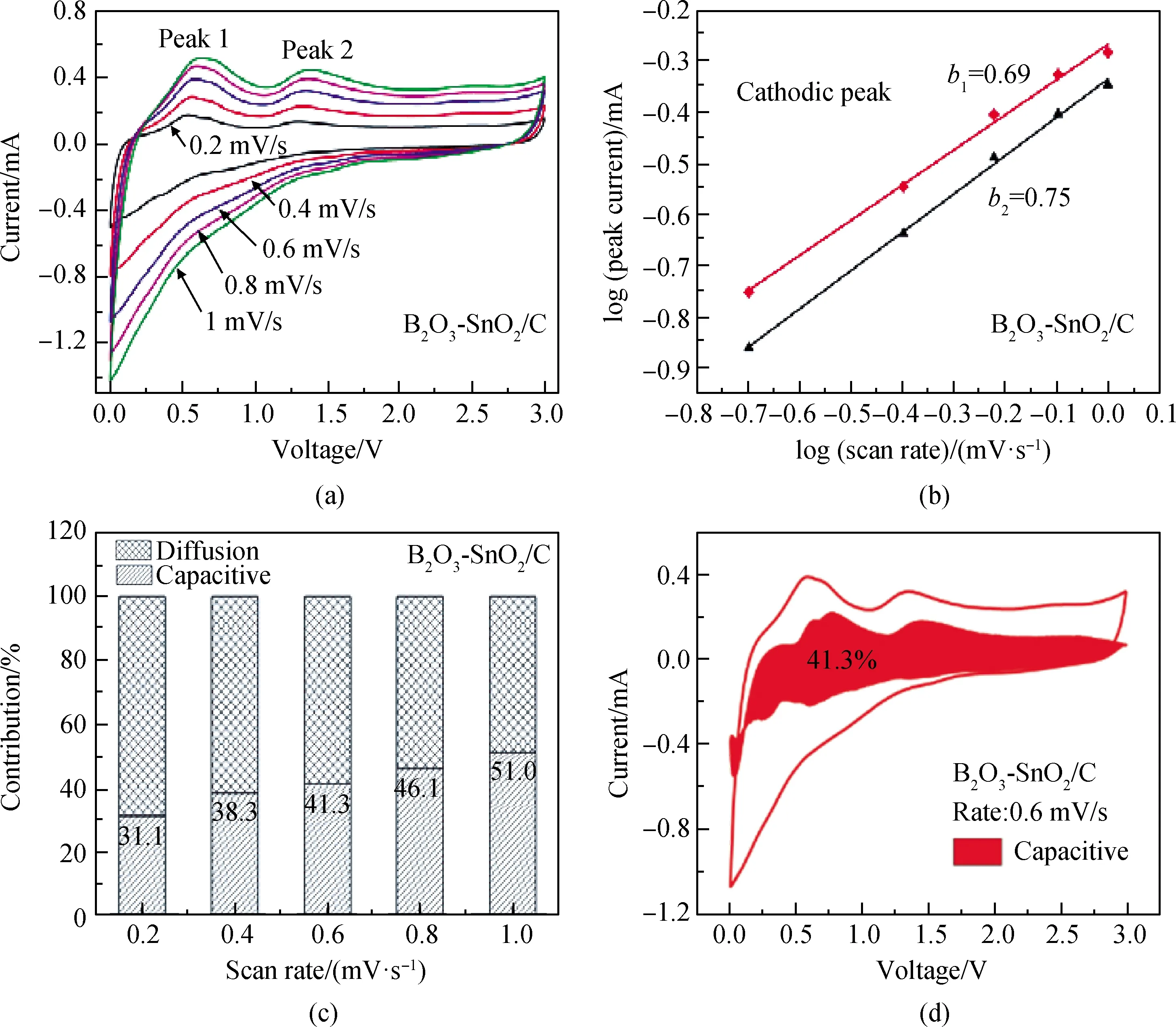
图6 (a)在0.2~1.0 mV/s不同扫描速率下的CV曲线;(b)阴极扫描对应log i与log v之间的拟合曲线; (c)在扫描速率0.2 mV/s、0.4 mV/s、0.6 mV/s、0.8 mV/s和1.0 mV/s下的电容贡献; (d)B2O3-SnO2/C电极在0.6 mV/s扫描速率的区域为电容贡献Fig.6 (a) CV curves obtained by testing at different scan rates of 0.2~1.0 mV/s; (b) fitting line between log i and log v corresponding to cathodic scan; (c) capacitance contribution at scan rates 0.2 mV/s, 0.4 mV/s, 0.6 mV/s, 0.8 mV/s and 1.0 mV/s; (d) B2O3-SnO2/C electrode in the area of 0.6 mV/s scan rate is the capacitance contribution
根据经验公式(5),可以通过CV中峰值电流(i)与扫描速率(v)之间的关系来判断充放电过程中是否存在电容行为。
i=αvb
(5)
对公式(5)两边取对数可以得公式(6):
logi=blogv+logα
(6)
式中:α为常数;logi与logv之间为线性关系;b为直线的斜率,当b值为0.5时,则表示以扩散为主导的锂储存;当b≥1时,则表示以表面控制的电容行为主导的锂储存;当b值在0.5~1内,表示扩散控制行为和电容行为两种锂储存行为[37]。
图6(b)显示了直线的斜率b,b值为0.69与0.75,表示B2O3-SnO2/C多孔复合材料充放电过程受扩散控制行为和电容行为两种锂储存行为控制。电容贡献率计算使用式(7):
i(v)=k1v+k2v1/2
(7)
公式(7)由两部分组成,k1v部分表示电容控制贡献;k2v1/2部分表示扩散控制贡献[38]。图6(c)显示了在0.2 mV/s、0.4 mV/s、0.6 mV/s、0.8 mV/s和1.0 mV/s的扫描速率下电容控制贡献率分别为31.1%、38.3%、41.3%、46.1%和51.0%,随着扫描速率的增加,电容控制的贡献率也随着增加。图6(d)显示在0.6 mV/s扫描速率时电容行为贡献率为41.3%,电容控制区域呈现出与CV曲线相似的轮廓,表明B2O3-SnO2/C多孔复合材料存在电容控制行为。总之,B2O3-SnO2/C多孔复合材料充放电过程受扩散控制与电容控制两种行为控制,这是B2O3-SnO2/C复合材料提供优异电化学性能的原因之一。
3 结 论
针对SnO2循环稳定性较差的问题,选用多孔竹炭、SnCl4·5H2O和硼酸为原料,采用溶胶-凝胶法成功制备得到B2O3-SnO2/C复合材料,对其物相结构、微观形貌和电化学性能等进行了研究。获得的结论如下:
(1)B2O3-SnO2/C复合材料中SnO2和B2O3均匀分布在多孔竹炭表面,B2O3分布于SnO2周围;多孔竹炭和B2O3在充放电过程中缓冲SnO2的体积变化,提高了B2O3-SnO2/C复合材料的循环稳定性。
(2)在不同倍率(0.25 C、0.5 C、1 C和2 C)测试材料的充放电循环性能,结果表明,B2O3-SnO2/C复合材料均高于SnO2和SnO2/C的放电比容量。
(3)B2O3-SnO2/C多孔复合材料充放电过程中受扩散与电容两种行为控制,在0.2 mV/s、0.4 mV/s、0.6 mV/s、0.8 mV/s和1.0 mV/s的扫描速率下电容控制贡献率分别为31.1%、38.3%、41.3%、46.1%和51.0%,随着扫描速率的增加,电容控制的贡献率也随着增加。
B2O3-SnO2/C复合材料的制备工艺简单、安全和绿色环保。这对于其他生物质材料和金属氧化物制备电极材料具有一定的参考。
